人教版化学九年级下册 8-3 金属资源的利用和保护课件(共28张PPT)
文档属性
| 名称 | 人教版化学九年级下册 8-3 金属资源的利用和保护课件(共28张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-17 11:01:56 | ||
图片预览








文档简介
(共29张PPT)
第八单元 金属和金属材料
课题3 金属资源的利用和保护
1.知道一些常见的金属(铁等)矿物,了解从铁矿石中将铁还原出来的方法
2.了解导致钢铁锈蚀的因素以及减缓钢铁锈蚀的办法
3.知道废弃金属对环境的污染,认识回收金属的重要性
自然界中以单质形式存在的金
自然界中以单质形式存在的银
一、地球上金属资源的存在
菱铁矿
铝土矿
黄铜矿
辉铜矿
赤铁矿(主要成分
是Fe2O3)
黄铁矿
1.金属资源的存在:______________。
2.金属元素在地壳中的含量:排在前两位的是______、_____。
3.自然界中金属的存在形式:_____、_______。
4.以化合物形式存在的金属具体表现为:_______。
5.我国矿物种类和储量情况:______________。
铝
铁
地壳和海洋
单质
化合物
矿石
齐全、丰富
铁矿石是怎样炼成铁的呢?让我们通过实验来研究铁冶炼的化学原理。
一氧化碳与氧化铁的反应
二、铁的冶炼
1.实验室模拟铁的冶炼
1.实验过程中先加热还是先通气?实验完毕时先停止加热吗?
2.实验需要改进吗?一氧化碳有毒,实验完毕的尾气怎么处理?
【思考】
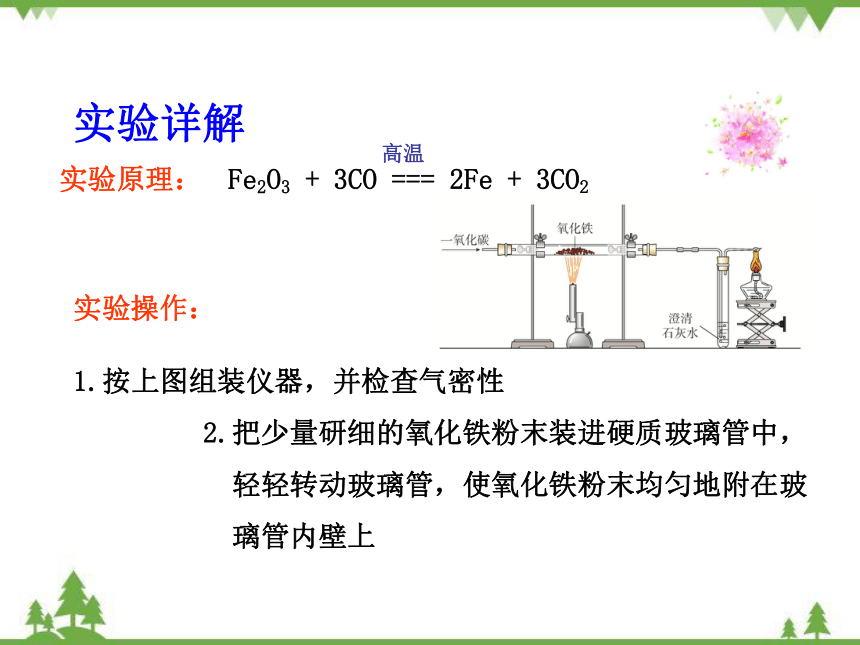
实验详解
1.按上图组装仪器,并检查气密性
2.把少量研细的氧化铁粉末装进硬质玻璃管中,
轻轻转动玻璃管,使氧化铁粉末均匀地附在玻
璃管内壁上
Fe2O3 + 3CO === 2Fe + 3CO2
高温
实验原理:
实验操作:
3.把硬质玻璃管接入装置系统中,先通入一氧化碳气体排出管内的空气;待排尽后,点燃出气口处的酒精灯及酒精喷灯,并观察装置中所发生的变化。 4.当红棕色粉末已转变成黑色后,先停止
加热,再通一会儿一氧化碳,直至玻璃管
冷却。
产物铁的检验:用磁铁检验黑色粉末,能被磁铁吸引,证明黑色粉末为铁。
红色(氧化铁)粉末逐渐变成黑色,同时澄清的石灰水逐渐变浑浊。
实验现象:
问题讨论:
1.如何验证反应中生成了什么物质?
产物二氧化碳的检验:将产生的气体通入到澄清石灰水中,澄清石灰水变浑浊,则生成二氧化碳:
CO2+Ca(OH)2=CaCO3↓+H2O
把尾气点燃,防止未反应的一氧化碳污染空气。
2.装置中右边的酒精灯起什么作用?
3.石灰水的作用有哪些?
用来检验生成物二氧化碳,并吸收二氧化碳便于处理尾气。
1.一氧化碳还原氧化铁是在封闭的硬质玻璃管中进行的,先通一氧化碳,可以把管内的空气排出,防止一氧化碳与空气混合受热爆炸. 2.实验完毕先停止加热,并继续通入一氧化碳直到玻璃管冷却为止。防止高温的条件下,生成的铁再被氧化。
注意事项:
实验改进: 可将上述装置除尾气的部分,改成用气球或方便袋收集,这样收集得到的未燃的一氧化碳气体可重复利用。
1.原料:铁矿石、焦炭、石灰石、空气
2.设备:高炉
3.反应原理:
C+O2 CO2
CO2+C 2CO
Fe2O3+3CO 2Fe+3CO2
CaCO3 CaO+CO2 ↑
CaO+SiO2 CaSiO3
2.工业炼铁
【例】用1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少吨?
【解析】带入化学方程式计算的数据应是纯净物的质量:
赤铁矿石 氧化铁 铁 生铁
方法1:根据化学式:
1000t×80%×70%÷96% = 583.3t
方法2:根据化学方程式(略)
【思考】 实际生产中,所用原料或产物一般都含有杂质,如何进行计算?
如何防止生锈?
三、金属的腐蚀与防护
1.铁生锈的实质:铁与空
气中的氧气、水蒸气等发
生化学反应的过程。
2.铁锈的主要成份为:氧化铁
3.铁制品锈蚀的条件:铁制品与氧气(或空气)、 水蒸气
同时接触
1.探究铁的生锈过程
(1)原理:破坏铁生锈的两个必备条件之一即可防止生锈。
2.防止铁生锈的原理和方法
金属防锈常用方法
干
保持金属表面干燥
在金属表面覆盖保护膜,如涂油或喷漆或搪瓷
在金属表面加电镀层
改变金属组成或结构,增强抗腐蚀性能
对金属烤蓝处理,使其表面形成致密氧化膜保护金属
膜
镀
改
烤
三、金属资源保护
1.防止金属的腐蚀
2.废旧金属的回收与利用
3.有计划、合理地开采矿物,严禁不顾国家利益的乱采矿
4.其他途径:寻找金属的代用品
【例1】钢铁是使用最多的金属材料,但每年因锈蚀而损失的数
量巨大,如何防止金属腐蚀已成为科学研究中的重大问题。以下有关金属腐蚀的叙述错误的是 ( )
A.钢铁在潮湿的空气中比在干燥的空气中更容易生锈
B.钢铁锈蚀的实质是与空气中的氧气、水蒸气等发生了化学变化
C.铝比钢铁中的铁活泼,因而铝的抗腐蚀性能比钢铁差
D.在钢铁表面刷油漆可以防止钢铁锈蚀
C
知识点一、金属的锈蚀
知识点二、炼铁
B
【例2】
(1)磁铁矿的主要成分是: ;(填化学式)
(2)写出CO与Fe2O3在高温条件下反应的化学方程式:
(3)高炉炼铁得到的主要产品是 ;(填序号)
A.纯铁 B.生铁 C.钢
Fe3O4
Fe2O3 + 3CO === 2Fe + 3CO2
高温
1.铁钉在下列哪些情况下容易生锈( )
A.在干燥的空气中 B.在潮湿的空气中
C.部分浸入食盐水中 D.浸没于植物油中
2.关于铁丝在氧气中燃烧、铁丝生锈的说法正确的是( )
A.铁丝燃烧产生白烟
B.铁丝生锈是缓慢氧化
C.铁丝燃烧的产物是Fe2O3
D.铁锈的主要成分是Fe3O4
B C
B
3.如图是探究铁锈蚀条件的装置。调节L端与R端的液
面使高度一致,塞紧木塞,一周后观察。下列推断错误
的是( )
A.b管中铁钉不会锈蚀
B.L端与R端液面高度仍然保持一致
C.该实验说明铁锈蚀与空气、水有关
D.若将a管中的水改为食盐水能加快铁的锈蚀
B
4.下列家庭生活垃圾:①废旧书刊报纸 ②废电池 ③废弃橡胶、塑料制品 ④易拉罐饮料瓶 ⑤废弃电线 ⑥破旧铁锅、铝壶 ⑦变质剩饭菜 ⑧瓜皮果壳 ⑨废弃玻璃物品等,其中可回收利用的有:________。
回收利用与保护金属资源相关联的是______。
①②③④⑤⑥⑨
②④⑤⑥
Fe+CuSO4=FeSO4+Cu,
5.某工厂欲从只含有CuSO4的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如下:
(1)操作a、b的名称分别是________、_______。
(2)写出流程中有关反应的化学方程式:
______________________、_______________ 。
以上两个反应能够发生的原因是
__ _______________________ 。
在金属活动性顺序中,铁位于铜、氢之前。
过滤
蒸发
Fe+H2SO4=FeSO4+H2↑
6.每年都要从大自然中提取大量的金
属,用于满足日常生活和工农业生产的需要。
(1)钢铁是我们日常生活中使用最多的金属材料。高炉炼铁常
以焦炭、铁矿石、石灰石、空气等为原料。
一氧化碳和Fe2O3反应的化学方程式为 。
(2)我国钢铁年产量很高,但因锈蚀造成的损失也很惊人。人
们常采取在铁制品表面涂刷油漆或镀上其他金属等方法,以防止
其锈蚀。上述方法所依据的原理是 。
将铁制品与空气和水 隔绝
Fe2O3 + 3CO === 2Fe + 3CO2
高温
(3)我国矿物储量很丰富,但人均占有量并不多,请保护金属资源!下面几种做法中,可有效保护金属资源的
是 (填字母)。
a.回收利用废旧金属制品
b.任意开采铁矿石
c.铁制品不加处理,存放在潮湿的环境中
d.寻找、开发金属的代用品
a d
1.金属资源的存在形式:单质、化合物
2.工业炼铁的主要化学反应原理是:
3.钢铁的锈蚀主要是铁与空气中的氧气、水蒸气等物质发生化学反应的结果。
4.金属资源的保护:防腐、回收、合理并有计划地开采、寻找金属的代用品。
Fe2O3 + 3CO === 2Fe + 3CO2
高温
第八单元 金属和金属材料
课题3 金属资源的利用和保护
1.知道一些常见的金属(铁等)矿物,了解从铁矿石中将铁还原出来的方法
2.了解导致钢铁锈蚀的因素以及减缓钢铁锈蚀的办法
3.知道废弃金属对环境的污染,认识回收金属的重要性
自然界中以单质形式存在的金
自然界中以单质形式存在的银
一、地球上金属资源的存在
菱铁矿
铝土矿
黄铜矿
辉铜矿
赤铁矿(主要成分
是Fe2O3)
黄铁矿
1.金属资源的存在:______________。
2.金属元素在地壳中的含量:排在前两位的是______、_____。
3.自然界中金属的存在形式:_____、_______。
4.以化合物形式存在的金属具体表现为:_______。
5.我国矿物种类和储量情况:______________。
铝
铁
地壳和海洋
单质
化合物
矿石
齐全、丰富
铁矿石是怎样炼成铁的呢?让我们通过实验来研究铁冶炼的化学原理。
一氧化碳与氧化铁的反应
二、铁的冶炼
1.实验室模拟铁的冶炼
1.实验过程中先加热还是先通气?实验完毕时先停止加热吗?
2.实验需要改进吗?一氧化碳有毒,实验完毕的尾气怎么处理?
【思考】
实验详解
1.按上图组装仪器,并检查气密性
2.把少量研细的氧化铁粉末装进硬质玻璃管中,
轻轻转动玻璃管,使氧化铁粉末均匀地附在玻
璃管内壁上
Fe2O3 + 3CO === 2Fe + 3CO2
高温
实验原理:
实验操作:
3.把硬质玻璃管接入装置系统中,先通入一氧化碳气体排出管内的空气;待排尽后,点燃出气口处的酒精灯及酒精喷灯,并观察装置中所发生的变化。 4.当红棕色粉末已转变成黑色后,先停止
加热,再通一会儿一氧化碳,直至玻璃管
冷却。
产物铁的检验:用磁铁检验黑色粉末,能被磁铁吸引,证明黑色粉末为铁。
红色(氧化铁)粉末逐渐变成黑色,同时澄清的石灰水逐渐变浑浊。
实验现象:
问题讨论:
1.如何验证反应中生成了什么物质?
产物二氧化碳的检验:将产生的气体通入到澄清石灰水中,澄清石灰水变浑浊,则生成二氧化碳:
CO2+Ca(OH)2=CaCO3↓+H2O
把尾气点燃,防止未反应的一氧化碳污染空气。
2.装置中右边的酒精灯起什么作用?
3.石灰水的作用有哪些?
用来检验生成物二氧化碳,并吸收二氧化碳便于处理尾气。
1.一氧化碳还原氧化铁是在封闭的硬质玻璃管中进行的,先通一氧化碳,可以把管内的空气排出,防止一氧化碳与空气混合受热爆炸. 2.实验完毕先停止加热,并继续通入一氧化碳直到玻璃管冷却为止。防止高温的条件下,生成的铁再被氧化。
注意事项:
实验改进: 可将上述装置除尾气的部分,改成用气球或方便袋收集,这样收集得到的未燃的一氧化碳气体可重复利用。
1.原料:铁矿石、焦炭、石灰石、空气
2.设备:高炉
3.反应原理:
C+O2 CO2
CO2+C 2CO
Fe2O3+3CO 2Fe+3CO2
CaCO3 CaO+CO2 ↑
CaO+SiO2 CaSiO3
2.工业炼铁
【例】用1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少吨?
【解析】带入化学方程式计算的数据应是纯净物的质量:
赤铁矿石 氧化铁 铁 生铁
方法1:根据化学式:
1000t×80%×70%÷96% = 583.3t
方法2:根据化学方程式(略)
【思考】 实际生产中,所用原料或产物一般都含有杂质,如何进行计算?
如何防止生锈?
三、金属的腐蚀与防护
1.铁生锈的实质:铁与空
气中的氧气、水蒸气等发
生化学反应的过程。
2.铁锈的主要成份为:氧化铁
3.铁制品锈蚀的条件:铁制品与氧气(或空气)、 水蒸气
同时接触
1.探究铁的生锈过程
(1)原理:破坏铁生锈的两个必备条件之一即可防止生锈。
2.防止铁生锈的原理和方法
金属防锈常用方法
干
保持金属表面干燥
在金属表面覆盖保护膜,如涂油或喷漆或搪瓷
在金属表面加电镀层
改变金属组成或结构,增强抗腐蚀性能
对金属烤蓝处理,使其表面形成致密氧化膜保护金属
膜
镀
改
烤
三、金属资源保护
1.防止金属的腐蚀
2.废旧金属的回收与利用
3.有计划、合理地开采矿物,严禁不顾国家利益的乱采矿
4.其他途径:寻找金属的代用品
【例1】钢铁是使用最多的金属材料,但每年因锈蚀而损失的数
量巨大,如何防止金属腐蚀已成为科学研究中的重大问题。以下有关金属腐蚀的叙述错误的是 ( )
A.钢铁在潮湿的空气中比在干燥的空气中更容易生锈
B.钢铁锈蚀的实质是与空气中的氧气、水蒸气等发生了化学变化
C.铝比钢铁中的铁活泼,因而铝的抗腐蚀性能比钢铁差
D.在钢铁表面刷油漆可以防止钢铁锈蚀
C
知识点一、金属的锈蚀
知识点二、炼铁
B
【例2】
(1)磁铁矿的主要成分是: ;(填化学式)
(2)写出CO与Fe2O3在高温条件下反应的化学方程式:
(3)高炉炼铁得到的主要产品是 ;(填序号)
A.纯铁 B.生铁 C.钢
Fe3O4
Fe2O3 + 3CO === 2Fe + 3CO2
高温
1.铁钉在下列哪些情况下容易生锈( )
A.在干燥的空气中 B.在潮湿的空气中
C.部分浸入食盐水中 D.浸没于植物油中
2.关于铁丝在氧气中燃烧、铁丝生锈的说法正确的是( )
A.铁丝燃烧产生白烟
B.铁丝生锈是缓慢氧化
C.铁丝燃烧的产物是Fe2O3
D.铁锈的主要成分是Fe3O4
B C
B
3.如图是探究铁锈蚀条件的装置。调节L端与R端的液
面使高度一致,塞紧木塞,一周后观察。下列推断错误
的是( )
A.b管中铁钉不会锈蚀
B.L端与R端液面高度仍然保持一致
C.该实验说明铁锈蚀与空气、水有关
D.若将a管中的水改为食盐水能加快铁的锈蚀
B
4.下列家庭生活垃圾:①废旧书刊报纸 ②废电池 ③废弃橡胶、塑料制品 ④易拉罐饮料瓶 ⑤废弃电线 ⑥破旧铁锅、铝壶 ⑦变质剩饭菜 ⑧瓜皮果壳 ⑨废弃玻璃物品等,其中可回收利用的有:________。
回收利用与保护金属资源相关联的是______。
①②③④⑤⑥⑨
②④⑤⑥
Fe+CuSO4=FeSO4+Cu,
5.某工厂欲从只含有CuSO4的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如下:
(1)操作a、b的名称分别是________、_______。
(2)写出流程中有关反应的化学方程式:
______________________、_______________ 。
以上两个反应能够发生的原因是
__ _______________________ 。
在金属活动性顺序中,铁位于铜、氢之前。
过滤
蒸发
Fe+H2SO4=FeSO4+H2↑
6.每年都要从大自然中提取大量的金
属,用于满足日常生活和工农业生产的需要。
(1)钢铁是我们日常生活中使用最多的金属材料。高炉炼铁常
以焦炭、铁矿石、石灰石、空气等为原料。
一氧化碳和Fe2O3反应的化学方程式为 。
(2)我国钢铁年产量很高,但因锈蚀造成的损失也很惊人。人
们常采取在铁制品表面涂刷油漆或镀上其他金属等方法,以防止
其锈蚀。上述方法所依据的原理是 。
将铁制品与空气和水 隔绝
Fe2O3 + 3CO === 2Fe + 3CO2
高温
(3)我国矿物储量很丰富,但人均占有量并不多,请保护金属资源!下面几种做法中,可有效保护金属资源的
是 (填字母)。
a.回收利用废旧金属制品
b.任意开采铁矿石
c.铁制品不加处理,存放在潮湿的环境中
d.寻找、开发金属的代用品
a d
1.金属资源的存在形式:单质、化合物
2.工业炼铁的主要化学反应原理是:
3.钢铁的锈蚀主要是铁与空气中的氧气、水蒸气等物质发生化学反应的结果。
4.金属资源的保护:防腐、回收、合理并有计划地开采、寻找金属的代用品。
Fe2O3 + 3CO === 2Fe + 3CO2
高温
同课章节目录
