1.2离子反应第一课时课件2022-2023学年高一上学期化学人教版(2019)必修第一册(14张ppt)
文档属性
| 名称 | 1.2离子反应第一课时课件2022-2023学年高一上学期化学人教版(2019)必修第一册(14张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 539.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-17 15:14:23 | ||
图片预览




文档简介
(共13张PPT)
第二节 离子反应
酸、碱、盐在水溶液中的电离
第一课时
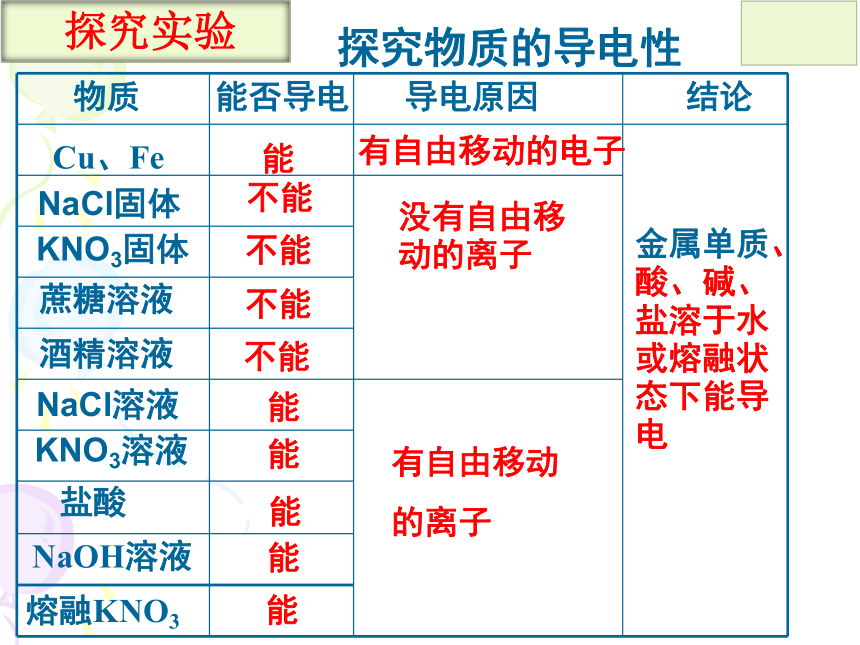
探究物质的导电性
物质
Cu、Fe
蔗糖溶液
酒精溶液
能否导电
导电原因
结论
能
有自由移动的电子
有自由移动
的离子
没有自由移动的离子
金属单质、酸、碱、盐溶于水或熔融状态下能导电
探究实验
NaCl固体
KNO3固体
不能
不能
NaCl溶液
KNO3溶液
能
能
不能
不能
盐酸
能
NaOH溶液
能
熔融KNO3
能
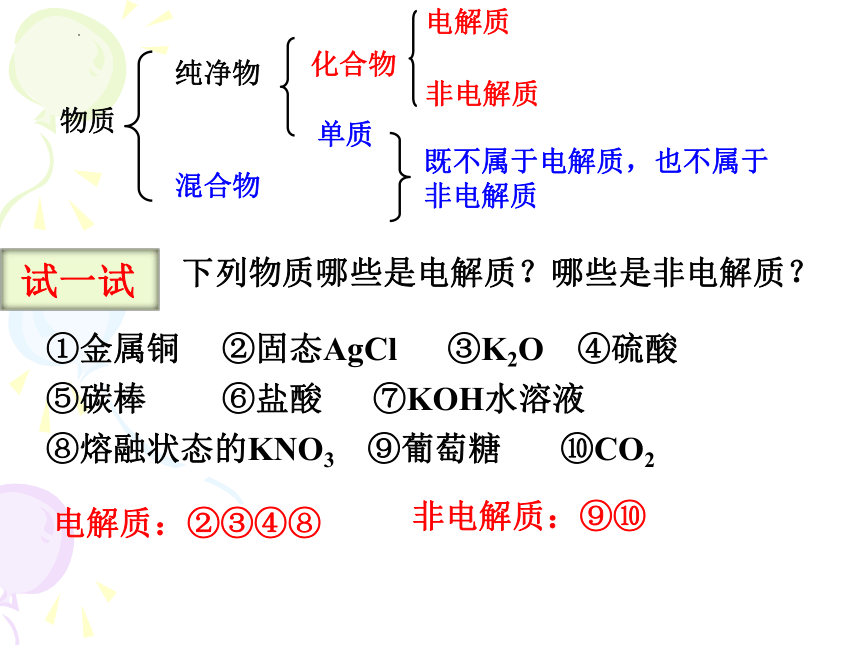
一、电解质和非电解质
1.电解质:在水溶液里或熔融状态下能导电的 化合物。
如酸 、碱、盐、活泼金属氧化物等
2.非电解质:在水溶液和熔融状态下都不能导电的化合物。
大多数有机物、非金属氧化物等
物质
纯净物
混合物
电解质
非电解质
化合物
单质
既不属于电解质,也不属于非电解质
下列物质哪些是电解质?哪些是非电解质?
①金属铜 ②固态AgCl ③K2O ④硫酸
⑤碳棒 ⑥盐酸 ⑦KOH水溶液
⑧熔融状态的KNO3 ⑨葡萄糖 ⑩CO2
电解质:②③④⑧
非电解质:⑨⑩
试一试
下列物质哪些能导电?
①金属铜 ②固态AgCl ③K2O ④硫酸
⑤碳棒 ⑥盐酸 ⑦KOH水溶液
⑧熔融状态的KNO3 ⑨葡萄糖 ⑩CO2
能导电:①⑤ ⑥ ⑦⑧
试一试
思考1:能导电的物质类型有哪些?
思考2:能导电的物质一定是电解质(②③④⑧)吗?
思考3:电解质都能导电吗?
判断正误
(1)Cu和NaOH溶液都能导电,所以Cu和NaOH溶液都是电解质。
×
(2)BaSO4和AgCl都难溶于水,其水溶液几乎不导电,所以BaSO4和AgCl都不是电解质。
×
(3)NH3溶于水都导电,所以NH3是电解质。
×
电解质与非电解质的本质区别:
本身能否电离出离子
1 . NaCl溶液( )导电,熔融NaCl( )导电。
能
能
2 . NaCl溶液(熔融NaCl)为什么能导电?
3 . NaCl固体( )导电,为什么?
不能
4 . NaCl溶液有什么离子?这些离子从何而来?
二、电离
(1 )定义:
电解质在水溶液中(或熔融状态时)产生自由移
动的离子的过程。
(2)表示方法
——电离方程式
(用来表示电解质电离过程的式子)
请你来判断
H2SO4 = H+ + SO42—
BaCl2 = Ba+2 + 2Cl—
HNO3 = H+ + N3— + 3O2—
BaCl2 = Ba2+ + 2Cl—
H2SO4 = 2H+ + SO42—
HNO3 = H+ + NO3—
下列电离方程式书写正确吗
?
H2SO4、HNO3、HCl能电离出哪些相同的离子?
酸:凡电离时生成的阳离子全部是H+的化合物。
HCl = H+ + Cl—
练一练
完成下列物质的电离方程式:
Ba(OH)2 =
NaOH=
Na2CO3=
KNO3=
(NH4)2SO4=
Ba2+ + 2OH-
Na+ + OH-
碱:凡电离时生成的阴离子全部是OH-离子的化合物。
2Na+ + CO32-
K+ + NO3-
2NH4+ + SO42-
盐:凡电离时生成金属离子(包括NH4+)和酸根离子(包括酸式酸根离子)的化合物。
巩固练习
1 .下列电离方程式正确的是( )
A . CaCl2 = Ca+2 + 2Cl-
B . FeSO4 = Fe3+ + SO42-
C . Fe2(SO4)3 = 2Fe3+ + 3 SO42-
D . NH4Cl = N3- + 4 H+ + Cl-
C
巩固练习
2 .下列说法中错误的是( )
A . NaOH溶液、CuSO4溶液在水溶液中均能导电,故NaOH、CuSO4均是电解质
B .乙醇、葡萄糖溶于水和熔融状态下都不能导电,故乙醇、葡萄糖均是非电解质
C . NH3是非电解质,液氨不是非电解质
D . AgCl难溶于水,其水溶液几乎不导电,故AgCl不是电解质。
CD
巩固练习
3 .下列说法说法正确的是( )
A .金属Cu、碳棒都能导电,故Cu、C都是电解质
B . CO2溶于水可导电,故CO2是电解质
C .固体NaCl中不含有Na+和Cl—,故固体NaCl不能导电
D . Na2O在熔融状态下能导电,故Na2O是电解质
D
第二节 离子反应
酸、碱、盐在水溶液中的电离
第一课时
探究物质的导电性
物质
Cu、Fe
蔗糖溶液
酒精溶液
能否导电
导电原因
结论
能
有自由移动的电子
有自由移动
的离子
没有自由移动的离子
金属单质、酸、碱、盐溶于水或熔融状态下能导电
探究实验
NaCl固体
KNO3固体
不能
不能
NaCl溶液
KNO3溶液
能
能
不能
不能
盐酸
能
NaOH溶液
能
熔融KNO3
能
一、电解质和非电解质
1.电解质:在水溶液里或熔融状态下能导电的 化合物。
如酸 、碱、盐、活泼金属氧化物等
2.非电解质:在水溶液和熔融状态下都不能导电的化合物。
大多数有机物、非金属氧化物等
物质
纯净物
混合物
电解质
非电解质
化合物
单质
既不属于电解质,也不属于非电解质
下列物质哪些是电解质?哪些是非电解质?
①金属铜 ②固态AgCl ③K2O ④硫酸
⑤碳棒 ⑥盐酸 ⑦KOH水溶液
⑧熔融状态的KNO3 ⑨葡萄糖 ⑩CO2
电解质:②③④⑧
非电解质:⑨⑩
试一试
下列物质哪些能导电?
①金属铜 ②固态AgCl ③K2O ④硫酸
⑤碳棒 ⑥盐酸 ⑦KOH水溶液
⑧熔融状态的KNO3 ⑨葡萄糖 ⑩CO2
能导电:①⑤ ⑥ ⑦⑧
试一试
思考1:能导电的物质类型有哪些?
思考2:能导电的物质一定是电解质(②③④⑧)吗?
思考3:电解质都能导电吗?
判断正误
(1)Cu和NaOH溶液都能导电,所以Cu和NaOH溶液都是电解质。
×
(2)BaSO4和AgCl都难溶于水,其水溶液几乎不导电,所以BaSO4和AgCl都不是电解质。
×
(3)NH3溶于水都导电,所以NH3是电解质。
×
电解质与非电解质的本质区别:
本身能否电离出离子
1 . NaCl溶液( )导电,熔融NaCl( )导电。
能
能
2 . NaCl溶液(熔融NaCl)为什么能导电?
3 . NaCl固体( )导电,为什么?
不能
4 . NaCl溶液有什么离子?这些离子从何而来?
二、电离
(1 )定义:
电解质在水溶液中(或熔融状态时)产生自由移
动的离子的过程。
(2)表示方法
——电离方程式
(用来表示电解质电离过程的式子)
请你来判断
H2SO4 = H+ + SO42—
BaCl2 = Ba+2 + 2Cl—
HNO3 = H+ + N3— + 3O2—
BaCl2 = Ba2+ + 2Cl—
H2SO4 = 2H+ + SO42—
HNO3 = H+ + NO3—
下列电离方程式书写正确吗
?
H2SO4、HNO3、HCl能电离出哪些相同的离子?
酸:凡电离时生成的阳离子全部是H+的化合物。
HCl = H+ + Cl—
练一练
完成下列物质的电离方程式:
Ba(OH)2 =
NaOH=
Na2CO3=
KNO3=
(NH4)2SO4=
Ba2+ + 2OH-
Na+ + OH-
碱:凡电离时生成的阴离子全部是OH-离子的化合物。
2Na+ + CO32-
K+ + NO3-
2NH4+ + SO42-
盐:凡电离时生成金属离子(包括NH4+)和酸根离子(包括酸式酸根离子)的化合物。
巩固练习
1 .下列电离方程式正确的是( )
A . CaCl2 = Ca+2 + 2Cl-
B . FeSO4 = Fe3+ + SO42-
C . Fe2(SO4)3 = 2Fe3+ + 3 SO42-
D . NH4Cl = N3- + 4 H+ + Cl-
C
巩固练习
2 .下列说法中错误的是( )
A . NaOH溶液、CuSO4溶液在水溶液中均能导电,故NaOH、CuSO4均是电解质
B .乙醇、葡萄糖溶于水和熔融状态下都不能导电,故乙醇、葡萄糖均是非电解质
C . NH3是非电解质,液氨不是非电解质
D . AgCl难溶于水,其水溶液几乎不导电,故AgCl不是电解质。
CD
巩固练习
3 .下列说法说法正确的是( )
A .金属Cu、碳棒都能导电,故Cu、C都是电解质
B . CO2溶于水可导电,故CO2是电解质
C .固体NaCl中不含有Na+和Cl—,故固体NaCl不能导电
D . Na2O在熔融状态下能导电,故Na2O是电解质
D
