化学人教版(2019)必修第二册7.3.1乙醇(共41张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册7.3.1乙醇(共41张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 7.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-17 15:35:14 | ||
图片预览







文档简介
(共41张PPT)
第三节 乙醇与乙酸
课时1 乙醇
第七章 有机化合物
01
学习目标
CONTENT
乙醇的结构及用途
02
03
乙醇的物理和化学性质
烃的衍生物、官能团
【引入】
早在几千年前,人类就掌握了发酵法酿酒的技术。各种酒类都含有浓度不等的乙醇。
请同学们说一些含有酒的诗句?
明月几时有?
把酒问青天!
借问酒家何处有 牧童遥指杏花村(杜甫)
花间一壶酒,独酌无相亲。
举杯邀明月,对影成三人 (李白)
劝君更尽一杯酒,西出阳关无故人 (李白)
【引入】
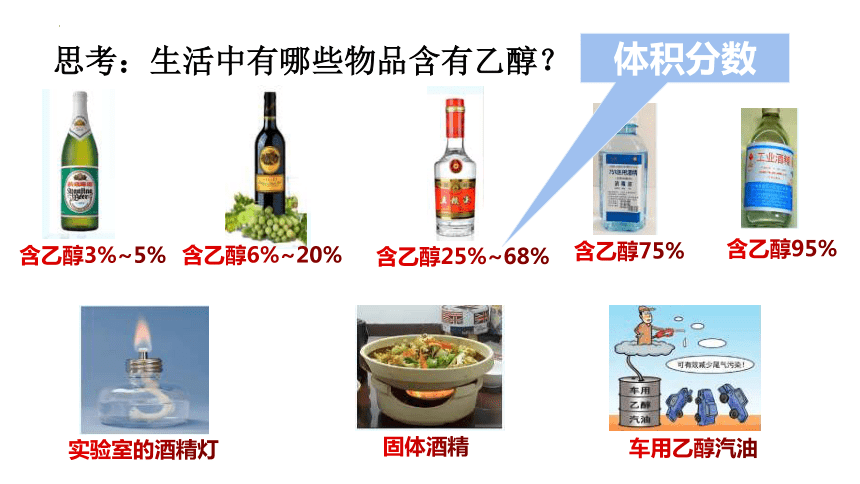
含乙醇3%~5%
含乙醇6%~20%
含乙醇25%~68%
含乙醇75%
含乙醇95%
实验室的酒精灯
固体酒精
车用乙醇汽油
思考:生活中有哪些物品含有乙醇?
体积分数
思考1:以下说法或事实体现了乙醇哪些物理性质?
1.病人发烧通常用酒精擦拭全身,用此法降温。
2.衣服上沾上少许汽油用酒精可以去除。
3.酒香不怕巷子深
4.白酒的主要成分是乙醇和水
5.酒精灯用完后为什么要盖上灯帽
6.用酒泡中药(药酒)—如泡枸杞
(易挥发)
(良好的有机溶剂)
(易挥发、有特殊香味)
(乙醇易溶于水)
(易挥发)
(良好的有机溶剂)
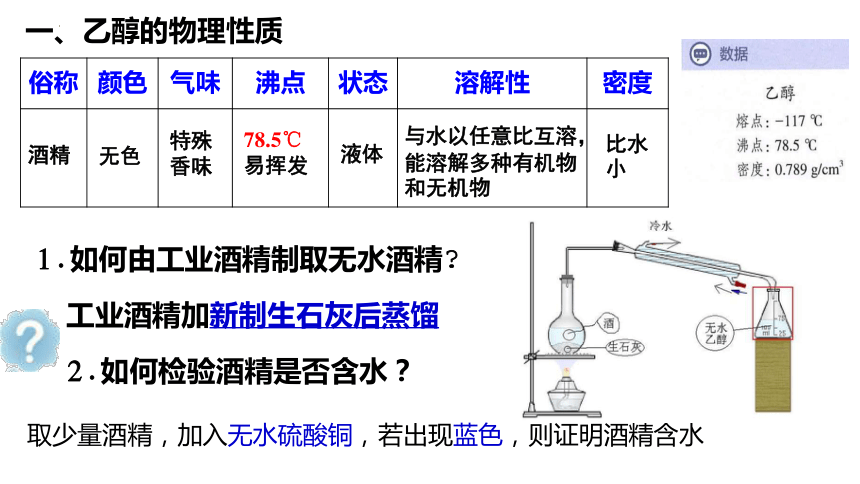
一、乙醇的物理性质
俗称 颜色 气味 沸点 状态 溶解性 密度
无色
特殊
香味
液体
比水小
与水以任意比互溶,
能溶解多种有机物和无机物
酒精
78.5℃
易挥发
1.如何由工业酒精制取无水酒精
工业酒精加新制生石灰后蒸馏
2.如何检验酒精是否含水?
取少量酒精,加入无水硫酸铜,若出现蓝色,则证明酒精含水
经燃烧法测定,乙醇的分子式为C2H6O。请根据其分子式,结合C、H和O原子的成键原则,推测乙醇的结构式
A:
B:
方法一:根据工业上利用乙烯与水加成制乙醇,推测出乙醇的结构式为A
二、乙醇的组成和结构
6个H不同
6个H相同
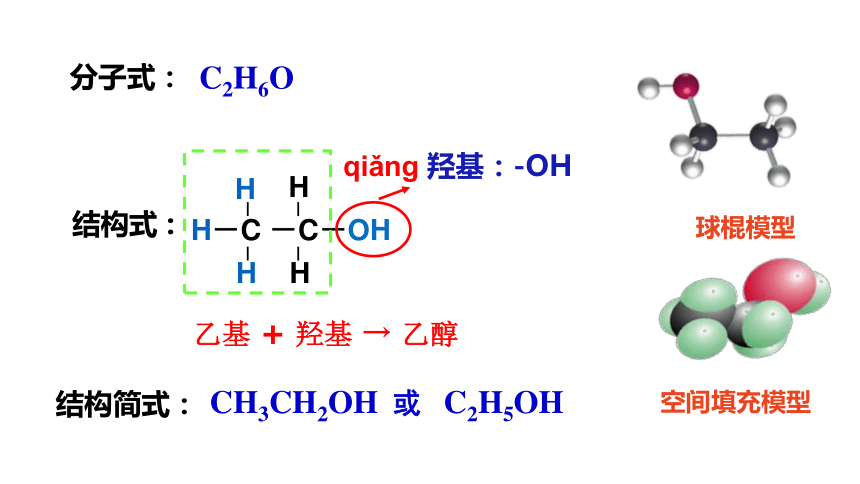
C2H6O
分子式:
结构式 :
H-C -C-OH
-
H
-
-
-
H
H
H
结构简式:
CH3CH2OH
或 C2H5OH
球棍模型
空间填充模型
qiǎng 羟基:-OH
乙基 + 羟基 → 乙醇
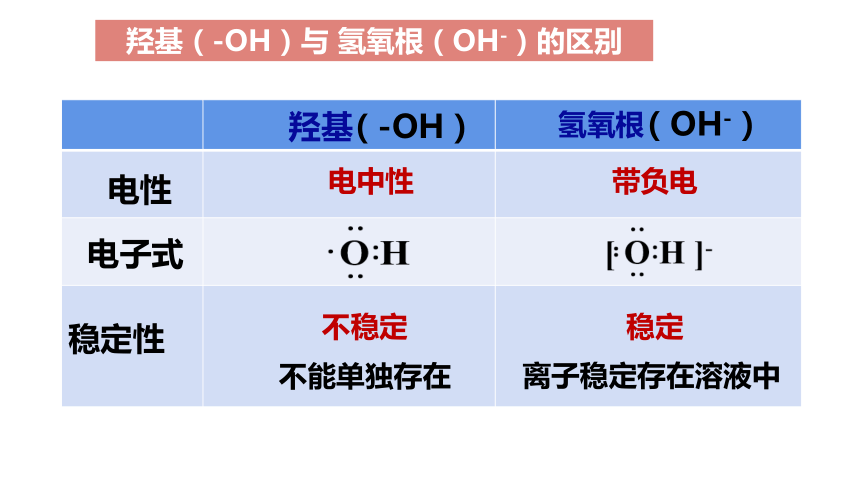
羟基(-OH)与 氢氧根(OH-)的区别
羟基
(-OH)
氢氧根
(OH-)
电性
电中性
带负电
不稳定
稳定
稳定性
不能单独存在
离子稳定存在溶液中
电子式
烃的衍生物:
烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物称为烃的衍生物。
如:
CH3Cl、
CH2Cl2、
CHCl3、
CCl4
除C、H元素外,还含有其他元素
A:
B:
二、乙醇的组成和结构
方法二:可以与金属钠反应来区别
思考:如何用实验证明乙醇的结构?(已知钠与烃基上的氢不反应)
1.与活泼金属(如Na)反应
【实验7-4】
在盛有少量无水乙醇的试管中,加入一小块新切的、用滤纸吸干表面煤油的钠,在试管口迅速塞上带尖嘴导管的橡胶塞,用小试管收集气体并检验其纯度,然后点燃(如图7-19),在将干燥的小烧杯罩在火焰上。待烧杯璧上出现液滴后,迅速倒转烧杯,想其中加入少量澄清石灰水。观察现象,并与前面做过的水与钠反应的实现现象进行比较。
三、乙醇的化学性质
1、乙醇与金属钠反应
【实验7-4】
实验现象:
钠沉于试管底部,不熔化,无响声,表面有气泡产生;
烧杯内壁有水雾产生,加入澄清石灰水后未变浑浊。
反应原理:
2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑
乙醇钠
(置换反应或取代反应)
【思考】比较钠与水、乙醇反应的现象,能得到什么结论?
Na与H2O 浮 熔 游 响 红
沉
不熔
不游
不响
红
Na与C2H5OH
结论:1.密度:水>钠>乙醇
2.剧烈程度:
钠与水的反应更剧烈
说明 乙醇-OH中的H不如H2O中的H活泼
2CH3CH2OH + Mg (CH3CH2O)2Mg + H2↑
乙醇镁
与其它活泼金属如钾、钙、镁和铝等与乙醇反应
思考:反应中断什么键?
H C C O H
H
H
H
H
⑤
④
②
③
①
① 处O—H键断开
应用:此反应可检验-OH的存在和计算-OH的数目。
2-OH ~ 2Na ~ H2
决定有机化合物的化学特性的原子或原子团
官能团:
碳碳双键
硝基(-NO2)
碳溴键(-Br)
H—C C—H
碳碳三键
CH3-COOH
羧基(-COOH)
羟基(-OH)
注意:
苯环( 、烷基不是官能团
随堂训练
1.关于乙醇结构与性质方面的说法中正确的是( )
A.乙醇结构中有—OH,所以乙醇溶解于水,可以电离出OH-
B.乙醇能电离出H+,所以是电解质
C.乙醇与钠反应可以产生氢气,所以乙醇显酸性
D.乙醇、水分别与钠,乙醇的反应比水更平缓
D
2、下列物质,都能与Na反应放出H2,其产生H2的速率排列顺序正确的是( )
①C2H5OH ②H2CO3溶液 ③H2O
A.①>②>③ B.②>①>③ C.③>①>② D.②>③>①
3、A、B、C三种醇与足量的金属钠反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为3∶6∶2,则A、B、C醇分子中羟基数之比为( )
A.3∶2∶1 B.2∶6∶3 C.3∶6∶2 D.2∶1∶3
D
D
C2H5OH +3O2 → 2CO2+3H2O
点燃
淡蓝色火焰,安静地燃烧,放出大量的热。
三、化学性质
2. 氧化反应
1) 燃烧
高温焊接 银器 或 铜器 时,表面会生成黑色的氧化物,师傅说:把铜、银器具趁热蘸一下酒精,铜、银会光亮如初!这是为什么呢?
三、乙醇的化学性质
2.氧化反应——②乙醇的催化氧化
【实验7-5】向试管中加入少量乙醇,取一根铜丝,下端绕成螺旋状,在酒精灯上灼烧后插入乙醇中,反复几次,注意观察反应现象,并小心闻试管中液体产生的气味。
铜丝红
Δ
变黑
有刺激性气味
插入乙醇溶液中
又变红
Cu
Δ
CuO
乙醛CH3CHO
插入乙醇溶液中
Cu
Cu催化剂
现象
中间产物
(2)催化氧化
①
②
①
②
加热
插入乙醇
铜丝由红变黑
铜丝由黑变红
现象分析:
2Cu + O2 2CuO
CuO + CH3CH2OH Cu + CH3CHO + H2O
Cu
2CH3CH2OH+O2 2CH3CHO+2H2O
乙醛
乙醛
2Cu+O2 2CuO
CuO+ CH3CH2OH Cu+ CH3CHO+ H2O
2
2
2
2
2
思考:反应中乙醇断什么键?
H—C —C—O—H ,
H H
H H
②
①
① 、②处O—H键断开
相加
Cu
乙醇
乙醛
氧原子
水
反应机理
思考:反应中乙醇断什么键?
反应原理:
脱去羟基上的氢和与羟基相连碳上的一个氢
2H-C-C-O-H + O2
Cu△
-
-
-
-
H
H
H
H
-
H
2CH3-C=O
+ 2H2O
1、焊接银器时,表面会生成发黑的氧化膜;
2、银匠都是先把银在火上烧热,马上蘸一下酒精,银会光亮如初!这是何原理?
学以致用
乙醇的催化氧化
2C2H5OH + O2
Ag
2CH3CHO + 2 H2O
乙醇的催化氧化中断裂的键:
H—C—C—O—H
H H
H H
R1CHO
不能被氧化
R2
C
O
R1
R1
-CH2
-OH
①
R2
CH
OH
R1
②
R1
C
R2
R3
OH
③
酮 官能团名称:酮羰基
与—OH相连的碳原子上有2个H,
催化氧化生成醛
与—OH相连的碳原子上有1个H,
催化氧化生成酮
与—OH相连的碳原子上没有H,
不能发生催化氧化
醇的催化氧化的反应条件:Cu或Ag、加热
醇发生催化氧化对结构的要求:羟基所连碳上必须有H.
,即具有
醇的催化氧化生成物的规律
a.只有R—CH2OH结构的醇,才能被氧化成醛
如:2R—CH2OH+O2 2R—CHO+2H2O
有机反应中:
有机物“去氢”或“得氧”的反应称为氧化反应;
有机物“加氢”或“去氧”的反应称为还原反应。
1.下列醇分子中可以被氧化生成醛的是( )。
A.CH3OH B.(CH3)3C—OH C.CH3—O—CH3 D.
*随堂训练
A
A
2、
【思考】判断以下三种醇能否发生催化氧化反应?并总结规律
CH3
OH
C
O
H
H
C
O
H
H
H
H
CH
CH3
CH3
OH
C
OH
CH3
CH3
CH3
√
√
×
脱去2H
脱去2H
C
CH3
CH3
O H
H
C
O
CH3
CH3
规律:醇分子中与羟基相连碳上必须H,才能发生催化氧化反应,且氧化产物不一定是醛类。
乙醛
C
O
H
H
H
C
H
C2H4O
分子式:
结构式:
结构简式:
CH3CHO
乙醛分子中的-CHO叫做醛基,是醛类物质的官能团。
球棍模型
空间填充模型
注意:不能写成-COH
适当条件下,乙醛可以被氧气进一步氧化,最终生成乙酸。
2CH3CHO + O2 2CH3COOH
催化剂
3) 乙醇被强氧化剂氧化
CH3CH2OH CH3COOH
酸性KMnO4溶液
溶液褪色
现象
溶液由 橙色 变成 绿色
现象
Cr2O72-
Cr3+
酸性K2Cr2O7溶液
CH3CH2OH CH3COOH
酒后驾驶检测原理
酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色Cr3+。下列对乙醇的描述与此测定原理有关的是
①乙醇沸点低 ②乙醇密度比水小 ③乙醇有还原性
④乙醇是烃的含氧化合物
A.②④ B.②③ C.①③ D.①④
C
(1) 用作酒精灯、火锅、内燃机等的燃料。
(2) 用作化工原料、香料、化妆品、涂料等。
(3) 消毒剂,医疗上常用体积分数为75%的乙醇溶液作消毒剂。
四、乙醇的用途
生活中的化学
过量饮酒的危害
人们饮用的酒是由粮食或水果酸造而成。种酒都含有一定量的乙醇。酒中乙醇的体积分数,称为酒的度数:1°表示100mL酒中含有1ml乙醇。
乙醇进入人体内,一部分被小肠吸收,通过血液循环进入肝脏,在肝脏中被氧化成乙醛、乙酸,最终被氧化成二氧化碳和水,释放出能量。过量饮酒,人体肝脏一时无法使乙醇、乙醛和乙酸等全部转化,血液中高浓度的乙醇将减缓大脑中信使分子的有效传递,影响判断力。长期过量饮酒,会使人发胖,还会损伤肝脏。血液中高浓度的乙醛还能致癌,并容易导致心血管病急性发作。因此,青少年不应饮酒,机动车驾驶员严禁酒后驾车。
乙醇脱氢酶
乙醇
乙醛
乙醛脱氢酶
乙酸
CO2
P79
三、小结
乙醇
乙醛
乙酸
CO2+H2O
Cu/Ag,加热
O2
O2
KMnO4(H+)/K2Cr2O4(H+)
O2(点燃)
1.乙醇与钠反应
2.乙醇的氧化反应
条件控制在有机反应中的作用
与Na反应,断_____键
催化氧化,断______键
燃烧,断_________ _键
①
① ③
【课堂小结】
①② ③④⑤
小结
【课堂小结】
C—C—O—H
H
H
H
H
H
①
②
④
③
与金属钠反应时在何处断键( );发生催化氧化反应时在何处断键( )
A. ①
B. ③
C. ① ③
D. ② ③
A
C
把质量为mg的铜丝灼烧变黑,立即放入下列物质中,能使铜丝变红,而且质量仍为mg的是( )
A.稀硫酸
B. 酒精
C.稀硝酸
D.水
B
课堂练习
C
拓展练习
2.把质量为mg的铜丝灼烧变黑,立即放入下列物质中,能使铜丝变红,而且质量仍为mg的是( )
A.稀硫酸
B. 酒精
C.稀硝酸
D.水
B
谢谢观看
Small pure and fresh and teaching courseware
第三节 乙醇与乙酸
课时1 乙醇
第七章 有机化合物
01
学习目标
CONTENT
乙醇的结构及用途
02
03
乙醇的物理和化学性质
烃的衍生物、官能团
【引入】
早在几千年前,人类就掌握了发酵法酿酒的技术。各种酒类都含有浓度不等的乙醇。
请同学们说一些含有酒的诗句?
明月几时有?
把酒问青天!
借问酒家何处有 牧童遥指杏花村(杜甫)
花间一壶酒,独酌无相亲。
举杯邀明月,对影成三人 (李白)
劝君更尽一杯酒,西出阳关无故人 (李白)
【引入】
含乙醇3%~5%
含乙醇6%~20%
含乙醇25%~68%
含乙醇75%
含乙醇95%
实验室的酒精灯
固体酒精
车用乙醇汽油
思考:生活中有哪些物品含有乙醇?
体积分数
思考1:以下说法或事实体现了乙醇哪些物理性质?
1.病人发烧通常用酒精擦拭全身,用此法降温。
2.衣服上沾上少许汽油用酒精可以去除。
3.酒香不怕巷子深
4.白酒的主要成分是乙醇和水
5.酒精灯用完后为什么要盖上灯帽
6.用酒泡中药(药酒)—如泡枸杞
(易挥发)
(良好的有机溶剂)
(易挥发、有特殊香味)
(乙醇易溶于水)
(易挥发)
(良好的有机溶剂)
一、乙醇的物理性质
俗称 颜色 气味 沸点 状态 溶解性 密度
无色
特殊
香味
液体
比水小
与水以任意比互溶,
能溶解多种有机物和无机物
酒精
78.5℃
易挥发
1.如何由工业酒精制取无水酒精
工业酒精加新制生石灰后蒸馏
2.如何检验酒精是否含水?
取少量酒精,加入无水硫酸铜,若出现蓝色,则证明酒精含水
经燃烧法测定,乙醇的分子式为C2H6O。请根据其分子式,结合C、H和O原子的成键原则,推测乙醇的结构式
A:
B:
方法一:根据工业上利用乙烯与水加成制乙醇,推测出乙醇的结构式为A
二、乙醇的组成和结构
6个H不同
6个H相同
C2H6O
分子式:
结构式 :
H-C -C-OH
-
H
-
-
-
H
H
H
结构简式:
CH3CH2OH
或 C2H5OH
球棍模型
空间填充模型
qiǎng 羟基:-OH
乙基 + 羟基 → 乙醇
羟基(-OH)与 氢氧根(OH-)的区别
羟基
(-OH)
氢氧根
(OH-)
电性
电中性
带负电
不稳定
稳定
稳定性
不能单独存在
离子稳定存在溶液中
电子式
烃的衍生物:
烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物称为烃的衍生物。
如:
CH3Cl、
CH2Cl2、
CHCl3、
CCl4
除C、H元素外,还含有其他元素
A:
B:
二、乙醇的组成和结构
方法二:可以与金属钠反应来区别
思考:如何用实验证明乙醇的结构?(已知钠与烃基上的氢不反应)
1.与活泼金属(如Na)反应
【实验7-4】
在盛有少量无水乙醇的试管中,加入一小块新切的、用滤纸吸干表面煤油的钠,在试管口迅速塞上带尖嘴导管的橡胶塞,用小试管收集气体并检验其纯度,然后点燃(如图7-19),在将干燥的小烧杯罩在火焰上。待烧杯璧上出现液滴后,迅速倒转烧杯,想其中加入少量澄清石灰水。观察现象,并与前面做过的水与钠反应的实现现象进行比较。
三、乙醇的化学性质
1、乙醇与金属钠反应
【实验7-4】
实验现象:
钠沉于试管底部,不熔化,无响声,表面有气泡产生;
烧杯内壁有水雾产生,加入澄清石灰水后未变浑浊。
反应原理:
2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑
乙醇钠
(置换反应或取代反应)
【思考】比较钠与水、乙醇反应的现象,能得到什么结论?
Na与H2O 浮 熔 游 响 红
沉
不熔
不游
不响
红
Na与C2H5OH
结论:1.密度:水>钠>乙醇
2.剧烈程度:
钠与水的反应更剧烈
说明 乙醇-OH中的H不如H2O中的H活泼
2CH3CH2OH + Mg (CH3CH2O)2Mg + H2↑
乙醇镁
与其它活泼金属如钾、钙、镁和铝等与乙醇反应
思考:反应中断什么键?
H C C O H
H
H
H
H
⑤
④
②
③
①
① 处O—H键断开
应用:此反应可检验-OH的存在和计算-OH的数目。
2-OH ~ 2Na ~ H2
决定有机化合物的化学特性的原子或原子团
官能团:
碳碳双键
硝基(-NO2)
碳溴键(-Br)
H—C C—H
碳碳三键
CH3-COOH
羧基(-COOH)
羟基(-OH)
注意:
苯环( 、烷基不是官能团
随堂训练
1.关于乙醇结构与性质方面的说法中正确的是( )
A.乙醇结构中有—OH,所以乙醇溶解于水,可以电离出OH-
B.乙醇能电离出H+,所以是电解质
C.乙醇与钠反应可以产生氢气,所以乙醇显酸性
D.乙醇、水分别与钠,乙醇的反应比水更平缓
D
2、下列物质,都能与Na反应放出H2,其产生H2的速率排列顺序正确的是( )
①C2H5OH ②H2CO3溶液 ③H2O
A.①>②>③ B.②>①>③ C.③>①>② D.②>③>①
3、A、B、C三种醇与足量的金属钠反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为3∶6∶2,则A、B、C醇分子中羟基数之比为( )
A.3∶2∶1 B.2∶6∶3 C.3∶6∶2 D.2∶1∶3
D
D
C2H5OH +3O2 → 2CO2+3H2O
点燃
淡蓝色火焰,安静地燃烧,放出大量的热。
三、化学性质
2. 氧化反应
1) 燃烧
高温焊接 银器 或 铜器 时,表面会生成黑色的氧化物,师傅说:把铜、银器具趁热蘸一下酒精,铜、银会光亮如初!这是为什么呢?
三、乙醇的化学性质
2.氧化反应——②乙醇的催化氧化
【实验7-5】向试管中加入少量乙醇,取一根铜丝,下端绕成螺旋状,在酒精灯上灼烧后插入乙醇中,反复几次,注意观察反应现象,并小心闻试管中液体产生的气味。
铜丝红
Δ
变黑
有刺激性气味
插入乙醇溶液中
又变红
Cu
Δ
CuO
乙醛CH3CHO
插入乙醇溶液中
Cu
Cu催化剂
现象
中间产物
(2)催化氧化
①
②
①
②
加热
插入乙醇
铜丝由红变黑
铜丝由黑变红
现象分析:
2Cu + O2 2CuO
CuO + CH3CH2OH Cu + CH3CHO + H2O
Cu
2CH3CH2OH+O2 2CH3CHO+2H2O
乙醛
乙醛
2Cu+O2 2CuO
CuO+ CH3CH2OH Cu+ CH3CHO+ H2O
2
2
2
2
2
思考:反应中乙醇断什么键?
H—C —C—O—H ,
H H
H H
②
①
① 、②处O—H键断开
相加
Cu
乙醇
乙醛
氧原子
水
反应机理
思考:反应中乙醇断什么键?
反应原理:
脱去羟基上的氢和与羟基相连碳上的一个氢
2H-C-C-O-H + O2
Cu△
-
-
-
-
H
H
H
H
-
H
2CH3-C=O
+ 2H2O
1、焊接银器时,表面会生成发黑的氧化膜;
2、银匠都是先把银在火上烧热,马上蘸一下酒精,银会光亮如初!这是何原理?
学以致用
乙醇的催化氧化
2C2H5OH + O2
Ag
2CH3CHO + 2 H2O
乙醇的催化氧化中断裂的键:
H—C—C—O—H
H H
H H
R1CHO
不能被氧化
R2
C
O
R1
R1
-CH2
-OH
①
R2
CH
OH
R1
②
R1
C
R2
R3
OH
③
酮 官能团名称:酮羰基
与—OH相连的碳原子上有2个H,
催化氧化生成醛
与—OH相连的碳原子上有1个H,
催化氧化生成酮
与—OH相连的碳原子上没有H,
不能发生催化氧化
醇的催化氧化的反应条件:Cu或Ag、加热
醇发生催化氧化对结构的要求:羟基所连碳上必须有H.
,即具有
醇的催化氧化生成物的规律
a.只有R—CH2OH结构的醇,才能被氧化成醛
如:2R—CH2OH+O2 2R—CHO+2H2O
有机反应中:
有机物“去氢”或“得氧”的反应称为氧化反应;
有机物“加氢”或“去氧”的反应称为还原反应。
1.下列醇分子中可以被氧化生成醛的是( )。
A.CH3OH B.(CH3)3C—OH C.CH3—O—CH3 D.
*随堂训练
A
A
2、
【思考】判断以下三种醇能否发生催化氧化反应?并总结规律
CH3
OH
C
O
H
H
C
O
H
H
H
H
CH
CH3
CH3
OH
C
OH
CH3
CH3
CH3
√
√
×
脱去2H
脱去2H
C
CH3
CH3
O H
H
C
O
CH3
CH3
规律:醇分子中与羟基相连碳上必须H,才能发生催化氧化反应,且氧化产物不一定是醛类。
乙醛
C
O
H
H
H
C
H
C2H4O
分子式:
结构式:
结构简式:
CH3CHO
乙醛分子中的-CHO叫做醛基,是醛类物质的官能团。
球棍模型
空间填充模型
注意:不能写成-COH
适当条件下,乙醛可以被氧气进一步氧化,最终生成乙酸。
2CH3CHO + O2 2CH3COOH
催化剂
3) 乙醇被强氧化剂氧化
CH3CH2OH CH3COOH
酸性KMnO4溶液
溶液褪色
现象
溶液由 橙色 变成 绿色
现象
Cr2O72-
Cr3+
酸性K2Cr2O7溶液
CH3CH2OH CH3COOH
酒后驾驶检测原理
酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色Cr3+。下列对乙醇的描述与此测定原理有关的是
①乙醇沸点低 ②乙醇密度比水小 ③乙醇有还原性
④乙醇是烃的含氧化合物
A.②④ B.②③ C.①③ D.①④
C
(1) 用作酒精灯、火锅、内燃机等的燃料。
(2) 用作化工原料、香料、化妆品、涂料等。
(3) 消毒剂,医疗上常用体积分数为75%的乙醇溶液作消毒剂。
四、乙醇的用途
生活中的化学
过量饮酒的危害
人们饮用的酒是由粮食或水果酸造而成。种酒都含有一定量的乙醇。酒中乙醇的体积分数,称为酒的度数:1°表示100mL酒中含有1ml乙醇。
乙醇进入人体内,一部分被小肠吸收,通过血液循环进入肝脏,在肝脏中被氧化成乙醛、乙酸,最终被氧化成二氧化碳和水,释放出能量。过量饮酒,人体肝脏一时无法使乙醇、乙醛和乙酸等全部转化,血液中高浓度的乙醇将减缓大脑中信使分子的有效传递,影响判断力。长期过量饮酒,会使人发胖,还会损伤肝脏。血液中高浓度的乙醛还能致癌,并容易导致心血管病急性发作。因此,青少年不应饮酒,机动车驾驶员严禁酒后驾车。
乙醇脱氢酶
乙醇
乙醛
乙醛脱氢酶
乙酸
CO2
P79
三、小结
乙醇
乙醛
乙酸
CO2+H2O
Cu/Ag,加热
O2
O2
KMnO4(H+)/K2Cr2O4(H+)
O2(点燃)
1.乙醇与钠反应
2.乙醇的氧化反应
条件控制在有机反应中的作用
与Na反应,断_____键
催化氧化,断______键
燃烧,断_________ _键
①
① ③
【课堂小结】
①② ③④⑤
小结
【课堂小结】
C—C—O—H
H
H
H
H
H
①
②
④
③
与金属钠反应时在何处断键( );发生催化氧化反应时在何处断键( )
A. ①
B. ③
C. ① ③
D. ② ③
A
C
把质量为mg的铜丝灼烧变黑,立即放入下列物质中,能使铜丝变红,而且质量仍为mg的是( )
A.稀硫酸
B. 酒精
C.稀硝酸
D.水
B
课堂练习
C
拓展练习
2.把质量为mg的铜丝灼烧变黑,立即放入下列物质中,能使铜丝变红,而且质量仍为mg的是( )
A.稀硫酸
B. 酒精
C.稀硝酸
D.水
B
谢谢观看
Small pure and fresh and teaching courseware
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
