【期末复习】05选择题(中档题)高一化学下册鲁科版期末真题知识点分类汇编
文档属性
| 名称 | 【期末复习】05选择题(中档题)高一化学下册鲁科版期末真题知识点分类汇编 |
|
|
| 格式 | doc | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-20 11:19:52 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
05选择题(中档题)
一.纯碱工业(侯氏制碱法)(共1小题)
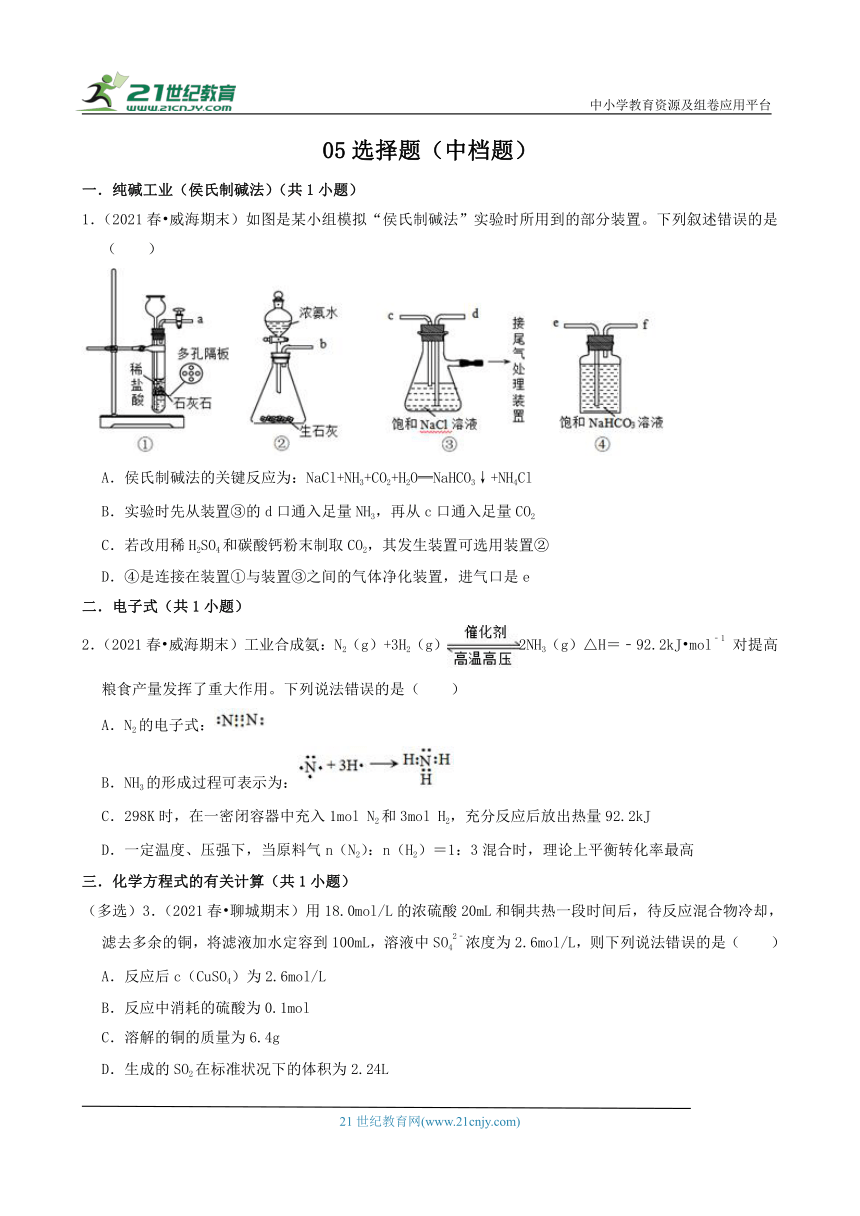
1.(2021春 威海期末)如图是某小组模拟“侯氏制碱法”实验时所用到的部分装置。下列叙述错误的是( )
A.侯氏制碱法的关键反应为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl
B.实验时先从装置③的d口通入足量NH3,再从c口通入足量CO2
C.若改用稀H2SO4和碳酸钙粉末制取CO2,其发生装置可选用装置②
D.④是连接在装置①与装置③之间的气体净化装置,进气口是e
二.电子式(共1小题)
2.(2021春 威海期末)工业合成氨:N2(g)+3H2(g)2NH3(g)△H=﹣92.2kJ mol﹣1 对提高粮食产量发挥了重大作用。下列说法错误的是( )
A.N2的电子式:
B.NH3的形成过程可表示为:
C.298K时,在一密闭容器中充入1mol N2和3mol H2,充分反应后放出热量92.2kJ
D.一定温度、压强下,当原料气n(N2):n(H2)=1:3混合时,理论上平衡转化率最高
三.化学方程式的有关计算(共1小题)
(多选)3.(2021春 聊城期末)用18.0mol/L的浓硫酸20mL和铜共热一段时间后,待反应混合物冷却,滤去多余的铜,将滤液加水定容到100mL,溶液中SO42﹣浓度为2.6mol/L,则下列说法错误的是( )
A.反应后c(CuSO4)为2.6mol/L
B.反应中消耗的硫酸为0.1mol
C.溶解的铜的质量为6.4g
D.生成的SO2在标准状况下的体积为2.24L
四.原子结构与元素周期律的关系(共3小题)
4.(2021春 青岛期末)短周期主族元素W、X、Y、Z原子序数依次增大,质子数之和为43。W的最高价氧化物的水化物与其简单氢化物能发生化合反应生成盐;X原子最外层电子数是内层电子数的3倍;Y元素形成的单质及其化合物焰色试验呈黄色。下列说法错误的是( )
A.W位于元素周期表第2周期第ⅤA族
B.简单氢化物稳定性:X>W
C.简单离子半径:Z>Y>W>X
D.Y与其它三种元素均可形成二元离子化合物
5.(2021春 济南期末)X、Y、Z、R、W为原子序数依次增大的短周期元素,Z、W为同族元素,R的原子半径是同周期主族元素中最大的,X、Y、Z、W形成的化合物可表示为[YX4]+[XWZ4]﹣。下列说法正确的是( )
A.元素的最高正化合价:Z>Y
B.气态氢化物的热稳定性:W>Z
C.化合物R2Z2与R2W中的阴、阳离子个数比都为1:2
D.X、Y、Z形成的化合物一定为共价化合物
(多选)6.(2021春 菏泽期末)随原子序数的递增,8种短周期元素(用字母x,y、z等字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。下列说法错误的是( )
A.y元素在周期表的位置是第2周期ⅣA族
B.元素简单离子半径d<f
C.x、z元素能组成一种四原子共价化合物,其电子式可以表示为
D.e、f、g元素的最高价氧化物对应的水化物两两之间可以相互反应
五.离子化合物的结构特征与性质(共1小题)
(多选)7.(2021春 济南期末)全氮类物质具有高密度、超高能量及爆轰产物无污染等优点。中国科学家成功合成全氮阴离子N5﹣,N5﹣是制备全氮类物质N5+N5﹣的重要中间体。下列说法中不正确的是( )
A.全氮类物质属于绿色能源
B.每个N5+中含有36个质子
C.N5+N5﹣属于离子化合物
D.N5+N5﹣结构中含有离子键和共价键
六.共价键的形成及共价键的主要类型(共1小题)
(多选)8.(2021春 枣庄期末)二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下,S2Cl2易与水反应,并产生能使品红褪色的气体。下列说法错误的是( )
A.S2Cl2是含有极性键和非极性键的离子化合物
B.S2Cl2的摩尔质量为135g
C.S2Cl2与水反应时S﹣S键和S﹣Cl键都断裂
D.S2Cl2分子中化学键通过共用电子对的相互作用形成
七.氧化还原反应(共2小题)
(多选)9.(2021春 临沂期末)氟气化学性质十分活泼,具有很强的氧化性,工业上氟气常用作火箭燃料的氧化剂、卤化氟的原料、冷冻剂等。已知2F2+Na2SO4 2NaF+SO2F2+O2,针对该反应的下列有关说法正确的有( )
A.SO2F2既是氧化产物又是还原产物
B.F2的氧化性强于O2
C.生成42g NaF时,该反应转移1mol电子
D.反应中既有极性键、非极性键的断裂,又有极性键、非极性键的形成
(多选)10.(2021春 日照期末)为防止废弃的硒单质(Se)造成环境污染,通常用浓硫酸将其转化成二氧化硒(SeO2),再用KI溶液处理后回收Se。发生的反应为:①Se+2H2SO4(浓)═2SO2↑+SeO2+2H2O;
②SeO2+4KI+4HNO3═4KNO3+Se+2I2+2H2O。
下列说法错误的是( )
A.反应①中Se被氧化
B.反应②中KI是还原剂,HNO3是氧化剂
C.反应②中,SeO2发生氧化反应
D.还原性由强到弱的顺序:I﹣>Se>SO2
八.反应热和焓变(共1小题)
(多选)11.(2021春 烟台期末)甲烷是一种清洁燃料,一定条件下可与NO2、NO发生如下反应:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=﹣574kJ mol﹣1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1160kJ mol﹣1
下列说法错误的是( )
A.若用标准状况下4.48L CH4还原NO2生成N2、CO2和液态水,放出的热量小于173.4kJ
B.利用以上反应可降低大气中的氮氧化合物的含量,有效减轻光化学烟雾
C.甲烷若设计成燃料电池,其能量利用率大于直接燃烧的能量利用率
D.反应②中当4.48L CH4反应完全时转移电子的物质的量为1.60mol
九.原电池和电解池的工作原理(共3小题)
12.(2021春 高青县期末)化学实现能量转化,造福人类。空间站以水为介质将不同形式的能量相互转化,原理如图所示,装置x电解水,装置y为燃料电池,下列有关说法不正确的是( )
A.太阳能电池实现了光能到电能的转化
B.该过程中,水可以循环使用
C.y工作时,转移2mol电子,消耗22.4L氢气
D.y工作时,氢气充入该装置的负极
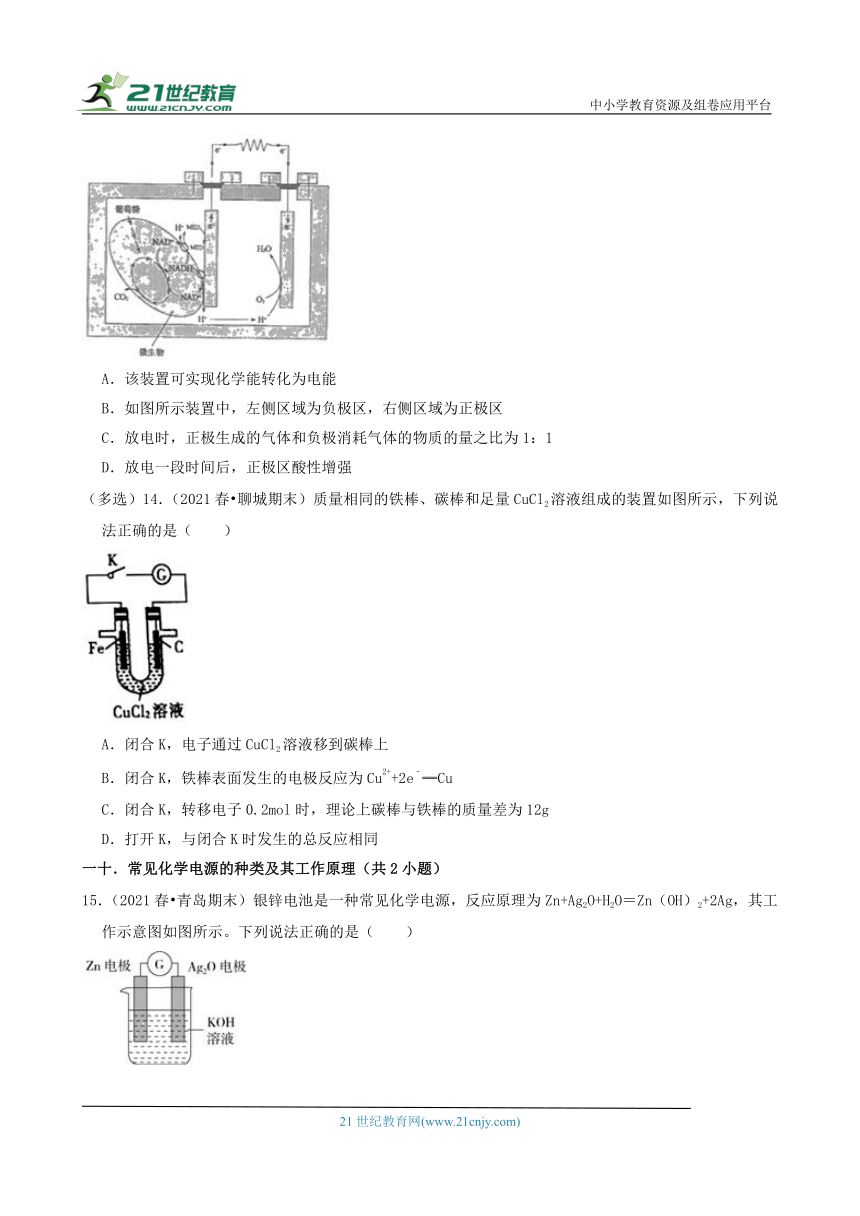
(多选)13.(2021春 滨州期末)微生物燃料电池是一种高效、经济的发电装置。一种双室微生物燃料电池的装置如图所示,其中负极反应为C6H12O6﹣24e﹣+6H2O═6CO2↑+24H+。下列说法错误的是( )
A.该装置可实现化学能转化为电能
B.如图所示装置中,左侧区域为负极区,右侧区域为正极区
C.放电时,正极生成的气体和负极消耗气体的物质的量之比为1:1
D.放电一段时间后,正极区酸性增强
(多选)14.(2021春 聊城期末)质量相同的铁棒、碳棒和足量CuCl2溶液组成的装置如图所示,下列说法正确的是( )
A.闭合K,电子通过CuCl2溶液移到碳棒上
B.闭合K,铁棒表面发生的电极反应为Cu2++2e﹣═Cu
C.闭合K,转移电子0.2mol时,理论上碳棒与铁棒的质量差为12g
D.打开K,与闭合K时发生的总反应相同
一十.常见化学电源的种类及其工作原理(共2小题)
15.(2021春 青岛期末)银锌电池是一种常见化学电源,反应原理为Zn+Ag2O+H2O=Zn(OH)2+2Ag,其工作示意图如图所示。下列说法正确的是( )
A.Zn为负极,电极反应式为Zn﹣2e﹣=Zn2+
B.电流从Zn电极经外电路流向Ag2O电极
C.理论上每转移1mol电子,Ag2O电极质量减少8g
D.KOH不参与电池反应,其溶液浓度始终保持不变
(多选)16.(2021春 烟台期末)磷酸铁锂电池应用广泛。该锂电池将锂嵌入碳材料,含Li+导电固体为电解质,电池反应为:LixC6+Li(1﹣x)FePO4LiFePO4+6C。下列说法正确的是( )
A.放电时,Li(1﹣x)FePO4作正极,发生还原反应
B.充电过程中,Li+由阴极区移向阳极区
C.充电时,与电源正极相连的电极反应为:LiFePO4﹣xe﹣→xLi++Li(1﹣x)FePO4
D.放电时,电子由负极经外电路移向正极,再经电解质移向负极
一十一.化学电源新型电池(共1小题)
(多选)17.(2021春 日照期末)K﹣O2电池结构如图所示,a和b为两个电极,其中之一为单质钾片。下列说法正确的是( )
A.隔膜允许K+通过,不允许O2通过
B.有机电解质2可用水溶液代替
C.放电时,a极的电极反应式为:K﹣e﹣═K+
D.放电时,电子由b电极沿导线流向a电极;充电时,b电极为阳极
一十二.化学平衡建立的过程(共1小题)
(多选)18.(2021春 枣庄期末)在一定温度下的密闭容器中,C(s)+H2O(g) CO(g)+H2(g)达到化学平衡状态。下列说法正确的是( )
A.平衡建立的过程中,断裂的化学键只有碳碳键和氢氧键
B.混合气体的平均相对分子质量不再变化,说明该反应已达到平衡状态
C.加入足量的碳,达到平衡时体系中不再含有H2O(g)
D.温度升高,原化学平衡状态被破坏
一十三.化学反应速率的影响因素(共3小题)
19.(2021春 聊城期末)下列措施不是为了改变化学反应速率的是( )
A.加工馒头时添加膨松剂
B.将食物存放在冰箱中
C.糕点包装袋内放置除氧剂
D.冶铁时将铁矿石粉碎
20.(2021春 济南期末)某化学小组欲测定酸性条件下KClO3溶液与NaHSO3溶液反应的化学反应速率,所用的试剂为10mL0.1mol.L﹣1 KClO3溶液和10mL0.3mol.L﹣1 NaHSO3溶液,所得c(Cl﹣)随时间变化的曲线如图所示。下列说法错误的是( )
A.该反应的离子方程式为ClO3﹣+3HSO3﹣=Cl﹣+3SO42﹣+3H+
B.该反应在0~4 min 的平均反应速率v(ClO3﹣)=2.5×10﹣3mol L﹣1 min﹣1
C.在反应过程中,该反应的化学反应速率变化趋势为先增大后减小
D.起初反应很慢,一段时间后反应速率明显增大,一定是反应放热温度升高的结果
(多选)21.(2021春 烟台期末)在1 L的密闭容器中,发生反应:A(s)+3B(g) 2C(g)+D(g),经2min C的浓度增加0.4mol L﹣1。下列关于该反应速率的说法正确的是( )
A.用A表示的反应速率是0.1mol L﹣1 min﹣1
B.用B、C、D分别表示反应的速率,其比值是3:2:1
C.在2min末用B表示的反应速率小于0.3mol L﹣1 min﹣1
D.在这2min内用B表示的反应速率逐渐减小,用D表示的反应速率逐渐增大
一十四.化学平衡的影响因素(共1小题)
22.(2021春 济南期末)将0.2mol L﹣1的KI溶液和0.01mol L﹣1Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实 验,能说明溶液中存在化学平衡“2Fe3++2I﹣ 2Fe2++I2”的是( )
实验编号 实验操作 实验现象
① 滴入KSCN溶液 溶液变红色
② 滴入AgNO3溶液 有黄色沉淀生成
③ 滴入K3[Fe(CN)6]溶液 有蓝色沉淀生成
④ 滴入淀粉溶液 溶液变蓝色
已知:3Fe2++2[Fe(CN)6]3﹣=Fe3[Fe(CN)6]2↓(蓝色沉淀)。
A.①和③ B.②和④ C.③和④ D.①和②
一十五.化学平衡状态的判断(共4小题)
23.(2021春 聊城期末)在一定条件下的恒容密闭容器中发生可逆反应2X(g) Y(g)+Z(s),下列不能说明该反应达到化学平衡状态的是( )
A.2v正(X)=v逆(Y)
B.反应容器中Y的质量分数不变
C.体系压强不再变化
D.混合气体的密度不再变化
24.(2021春 济南期末)一定温度下,恒容密闭容器中发生反应CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)。
下列说法能够判断该反应已达到化学平衡状态的是( )
A.N2与CO2的浓度相等
B.混合气体的压强不再变化
C.混合气体的密度不再变化
D.相同时间内,消耗2molNO2的同时产生1molN2
25.(2021春 济宁期末)某温度下,在恒容密闭容器中发生反应:2SO2(g)+O2(g)2SO3(g),当反应达到平衡时,下列有关说法正确的是( )
A.v正(O2)=2v逆(SO3)
B.升高温度能使正反应速率加快,逆反应速率减慢
C.使用催化剂可使O2全部转化为SO3
D.SO2的浓度不再发生变化
(多选)26.(2021春 临沂期末)在绝热的某刚性容器中置入1molF2和3mol ClF3,发生反应:F2(g)+ClF(g) ClF3(g)。下列说法中能够判断该反应一定处于平衡状态的有( )
A.F2(g)与ClF(g)体积之比恒定不变
B.F2(g)与ClF3(g)速率之比恒定不变
C.混合物中Cl元素质量分数恒定不变
D.容器中温度恒定不变
一十六.物质的量或浓度随时间的变化曲线(共2小题)
(多选)27.(2021春 日照期末)反应X═2Z经历两步:①X→Y;②Y→2Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法错误的是( )
A.曲线c为c(Y)随t的变化曲线
B.0~t1时间段内,反应速率v(X)=v(Y)=v(Z)
C.t2时,Y的消耗速率大于生成速率
D.t3后,c(Z)=2c0
(多选)28.(2021春 高青县期末)“理解与辩析能力”和“分析与推测能力”,都是化学四大关键能力之一。读图看表识数据,对关键能力的要求很高。一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应达到平衡状态),对该反应的推断正确的是( )
A.进行到1s时,v(A)=v(C)
B.化学方程式为3B+4C 6A+2D
C.进行到6s时,B的平均反应速率为0.05mol/(L s)
D.进行到6s时,B和D的物质的量浓度均为0.4mol L﹣1
一十七.化学平衡的计算(共2小题)
29.(2021春 菏泽期末)一定温度下,向2L的密闭容器中充入1molN2和3molH2发生反应N2(g)+3H2(g) 2NH3(g),5min时测得n(NH3)=1.2mol。下列说法正确的是( )
A.5min内,v(H2)=0.36mol L﹣1 min﹣1
B.适当升高温度可以使正反应速率和逆反应速率都加快
C.增大N2的浓度可以使H2完全反应
D.5min时反应物与生成物的物质的量比为1:2
30.(2021春 青岛期末)某温度下,在2L恒容密闭容器中充入一定量A,发生反应aA(g) B(g)+cC(g)。反应达平衡时,测得c(B)=0.2mol L﹣1,A、C的物质的量浓度随时间的变化如图所示。下列说法错误的是( )
A.a=2,c=3
B.M点时,A的消耗速率与C的生成速率相等
C.反应达平衡后,容器内A、B的物质的量之比为3:2
D.容器内气体的平均相对分子质量不再改变说明反应达平衡
参考答案与试题解析
一.纯碱工业(侯氏制碱法)(共1小题)
1.(2021春 威海期末)如图是某小组模拟“侯氏制碱法”实验时所用到的部分装置。下列叙述错误的是( )
A.侯氏制碱法的关键反应为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl
B.实验时先从装置③的d口通入足量NH3,再从c口通入足量CO2
C.若改用稀H2SO4和碳酸钙粉末制取CO2,其发生装置可选用装置②
D.④是连接在装置①与装置③之间的气体净化装置,进气口是e
【解答】解:A.③中发生NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl,可析出碳酸氢钠,为侯氏制碱法的关键反应,故A正确;
B.氨气极易溶于水,易发生倒吸,且碱性溶液可增大二氧化碳的溶解度,则实验时先从装置③的c口通入足量NH3,再从d口通入足量CO2,故B错误;
C.改用稀H2SO4和碳酸钙粉末制取CO2,为固液不加热反应,能选装置②,故C正确;
D.除杂时导管长进短出,则④可除去二氧化碳中的HCl,进气口是e,故D正确;
故选:B。
二.电子式(共1小题)
2.(2021春 威海期末)工业合成氨:N2(g)+3H2(g)2NH3(g)△H=﹣92.2kJ mol﹣1 对提高粮食产量发挥了重大作用。下列说法错误的是( )
A.N2的电子式:
B.NH3的形成过程可表示为:
C.298K时,在一密闭容器中充入1mol N2和3mol H2,充分反应后放出热量92.2kJ
D.一定温度、压强下,当原料气n(N2):n(H2)=1:3混合时,理论上平衡转化率最高
【解答】解:A.N2中N与N之间存在三个共用电子对,其电子式为,故A正确;
B.NH3属于共价化合物,N原子周围有8个电子,NH3的形成过程可表示为:,故B正确;
C.反应N2(g)+3H2(g)2NH3(g)△H=﹣92.2kJ mol﹣1 为可逆反应,反应不可能进行完全,298K时,在一密闭容器中充入1mol N2和3mol H2,充分反应后放出热量小于92.2kJ,故C错误;
D.按照方程式系数的比例关系投入原料转化率最高,一定温度、压强下,当原料气n(N2):n(H2)=1:3混合时,理论上平衡转化率最高,故D正确;
故选:C。
三.化学方程式的有关计算(共1小题)
(多选)3.(2021春 聊城期末)用18.0mol/L的浓硫酸20mL和铜共热一段时间后,待反应混合物冷却,滤去多余的铜,将滤液加水定容到100mL,溶液中SO42﹣浓度为2.6mol/L,则下列说法错误的是( )
A.反应后c(CuSO4)为2.6mol/L
B.反应中消耗的硫酸为0.1mol
C.溶解的铜的质量为6.4g
D.生成的SO2在标准状况下的体积为2.24L
【解答】解:浓硫酸中硫酸的物质的量n(H2SO4)=cV=0.02L×18.0mol/L=0.36mol,反应后溶液中n(SO42﹣)=cV=0.1L×2.6mol/L=0.26mol,根据S原子守恒可知生成SO2的物质的量n(SO2)=n(H2SO4)﹣n(SO42﹣)=0.36mol﹣0.26mol=0.1mol;
铜和浓硫酸反应的化学方程式为Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,则n(Cu)=n(CuSO4)=n(H2SO4)消耗=n(SO2)=0.1mol,n(H2SO4)消耗=0.2mol,
A.反应后c(CuSO4)为=1mol/L,故A错误;
B.反应中消耗的硫酸为0.2mol,故B错误;
C.溶解的铜m(Cu)=nM=0.1mol×64g/mol=6.4g,故C正确;
D.生成的SO2在标准状况下的体积为0.1mol×22.4L/mol=2.24L,故D正确;
故选:AB。
四.原子结构与元素周期律的关系(共3小题)
4.(2021春 青岛期末)短周期主族元素W、X、Y、Z原子序数依次增大,质子数之和为43。W的最高价氧化物的水化物与其简单氢化物能发生化合反应生成盐;X原子最外层电子数是内层电子数的3倍;Y元素形成的单质及其化合物焰色试验呈黄色。下列说法错误的是( )
A.W位于元素周期表第2周期第ⅤA族
B.简单氢化物稳定性:X>W
C.简单离子半径:Z>Y>W>X
D.Y与其它三种元素均可形成二元离子化合物
【解答】解:结合分析可知,W为N,X为O,Y为Na,Z为Cl元素,
A.W的原子序数为7,位于元素周期表第2周期第ⅤA族,故A正确;
B.非金属性O>N,则简单氢化物稳定性:X>W,故B正确;
C.电子层越多离子半径越大,电子层结构相同时,核电荷数越大离子半径越小,则简单离子半径:Z>W>X>Y,故C错误;
D.Na为活泼金属元素,则Na能够与N、O、Cl元素形成二元离子化合物,故D正确;
故选:C。
5.(2021春 济南期末)X、Y、Z、R、W为原子序数依次增大的短周期元素,Z、W为同族元素,R的原子半径是同周期主族元素中最大的,X、Y、Z、W形成的化合物可表示为[YX4]+[XWZ4]﹣。下列说法正确的是( )
A.元素的最高正化合价:Z>Y
B.气态氢化物的热稳定性:W>Z
C.化合物R2Z2与R2W中的阴、阳离子个数比都为1:2
D.X、Y、Z形成的化合物一定为共价化合物
【解答】解:由以上析可知,X为H,Y为N,Z为O,R为Na,W为S元素,
A.Z(O)的非金属性较强,不存在+6价,故A错误;
B.非金属性越强,简单气态氢化物的稳定性越强,非金属性S<O,则气态氢化物的热稳定性:W<Z,故B错误;
C.化合物Na2O2与Na2S中的阳离子均为钠离子,阴离子分别为过氧根离子、硫离子,则Na2O2与Na2S中阴、阳离子个数比都为1:2,故C正确;
D.X、Y、Z分别为H、N、O,H、N、O形成的化合物可能为离子化合物,如硝酸铵,故D错误;
故选:C。
(多选)6.(2021春 菏泽期末)随原子序数的递增,8种短周期元素(用字母x,y、z等字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。下列说法错误的是( )
A.y元素在周期表的位置是第2周期ⅣA族
B.元素简单离子半径d<f
C.x、z元素能组成一种四原子共价化合物,其电子式可以表示为
D.e、f、g元素的最高价氧化物对应的水化物两两之间可以相互反应
【解答】解:通过以上分析知,x、y、z、d、e、f、g、h分别是H、C、N、O、Na、Al、S、Cl元素;
A.y为C元素,C原子结构示意图为,则C元素位于第二周期第IVA族,故A正确;
B.电子层结构相同的离子,离子半径随着原子序数增大而减小,O2﹣、Al3+的电子层结构相同,且原子序数:d<f,所以离子半径r(O2﹣)>r(Al3+),故B错误;
C.x、z元素能组成一种四原子共价化合物为NH3,N原子和每个H原子共用1对电子对且N原子还有一对孤电子对,则氨气分子的电子式为,故C错误;
D.e、f、g元素的最高价氧化物的水化物分别是NaOH、Al(OH)3、H2SO4,Al(OH)3为两性氢氧化物,能和强碱NaOH、强酸硫酸反应生成盐和水,酸碱能发生中和反应,所以e、f、g元素的最高价氧化物对应的水化物两两之间可以相互反应,故D正确;
故选:BC。
五.离子化合物的结构特征与性质(共1小题)
(多选)7.(2021春 济南期末)全氮类物质具有高密度、超高能量及爆轰产物无污染等优点。中国科学家成功合成全氮阴离子N5﹣,N5﹣是制备全氮类物质N5+N5﹣的重要中间体。下列说法中不正确的是( )
A.全氮类物质属于绿色能源
B.每个N5+中含有36个质子
C.N5+N5﹣属于离子化合物
D.N5+N5﹣结构中含有离子键和共价键
【解答】解:A.全氮类物质爆轰产物无污染等优点,所以属于绿色能源,故A正确;
B.每个N5+中含有质子为7×5=35个,故B错误;
C.N5+ N5﹣中只含有N元素,只含有一种元素的纯净物属于单质,故C错误;
D.N5+和N5﹣离子间存在离子键,而离子内氮氮之间存在共价键,所以N5+N5﹣结构中含离子键和共价键,故D正确;
故选:BC。
六.共价键的形成及共价键的主要类型(共1小题)
(多选)8.(2021春 枣庄期末)二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下,S2Cl2易与水反应,并产生能使品红褪色的气体。下列说法错误的是( )
A.S2Cl2是含有极性键和非极性键的离子化合物
B.S2Cl2的摩尔质量为135g
C.S2Cl2与水反应时S﹣S键和S﹣Cl键都断裂
D.S2Cl2分子中化学键通过共用电子对的相互作用形成
【解答】解:A.S2Cl2的结构式为Cl﹣S﹣S﹣Cl,S2Cl2含有极性共价键和非极性共价键,不含离子键,所以不是离子化合物,故A错误;
B.摩尔质量的单位是g/mol,S2Cl2的摩尔质量为135g/mol,故B错误;
C.S2Cl2遇水易水解,并产生能使品红溶液褪色的气体,该气体为二氧化硫,在反应过程中硫元素一部分升高到+4价(生成SO2),一部分降低到0价(生成S),发生反应为2S2Cl2+2H2O=SO2↑+3S↓+4HCl,则S2Cl2中的Cl﹣S极性键和S﹣S非极性键均断裂,故C正确;
D.S2Cl2中只存在共价键,共价键是原子间通过共用电子对形成的相互作用,所以S2Cl2分子中化学键通过共用电子对的相互作用形成,故D正确;
故选:AB。
七.氧化还原反应(共2小题)
(多选)9.(2021春 临沂期末)氟气化学性质十分活泼,具有很强的氧化性,工业上氟气常用作火箭燃料的氧化剂、卤化氟的原料、冷冻剂等。已知2F2+Na2SO4 2NaF+SO2F2+O2,针对该反应的下列有关说法正确的有( )
A.SO2F2既是氧化产物又是还原产物
B.F2的氧化性强于O2
C.生成42g NaF时,该反应转移1mol电子
D.反应中既有极性键、非极性键的断裂,又有极性键、非极性键的形成
【解答】解:A.反应中,F元素的化合价降低被还原,O元素的化合价升高被氧化,则NaF和SO2F2是还原产物,O2是氧化产物,故A错误;
B.F2是氧化剂,O2是氧化产物,则F2的氧化性强于O2,故B正确;
C.42g NaF的物质的量为=1mol,由方程式可知,生成1molNaF,同时生成molO2,转移电子为mol×4=2mol,故C错误;
D.反应中有F﹣F非极性键,S﹣O极性键,生成物中有O=O非极性键和S﹣F极性键,所以反应中既有极性键、非极性键的断裂,又有极性键、非极性键的形成,故D正确;
故选:BD。
(多选)10.(2021春 日照期末)为防止废弃的硒单质(Se)造成环境污染,通常用浓硫酸将其转化成二氧化硒(SeO2),再用KI溶液处理后回收Se。发生的反应为:①Se+2H2SO4(浓)═2SO2↑+SeO2+2H2O;
②SeO2+4KI+4HNO3═4KNO3+Se+2I2+2H2O。
下列说法错误的是( )
A.反应①中Se被氧化
B.反应②中KI是还原剂,HNO3是氧化剂
C.反应②中,SeO2发生氧化反应
D.还原性由强到弱的顺序:I﹣>Se>SO2
【解答】解:A.①中S元素化合价由+6价变为+4价、Se元素化合价由0价变为+4价,则反应①中Se被氧化,故A正确;
B.②中Se元素化合价由+4价变为0价、I元素化合价由﹣1价变为0价,得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,则KI是还原剂,SeO2是氧化剂,故B错误;
C.反应②中,Se元素化合价降低,则SeO2得电子,发生还原反应,故C错误;
D.①中还原剂是Se、还原产物是SO2,则还原性:Se>SO2;②中还原剂是I﹣、还原产物是Se,则还原性:I﹣>Se,所以还原性由强到弱的顺序是:I﹣>Se>SO2,故D正确;
故选:BC。
八.反应热和焓变(共1小题)
(多选)11.(2021春 烟台期末)甲烷是一种清洁燃料,一定条件下可与NO2、NO发生如下反应:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=﹣574kJ mol﹣1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1160kJ mol﹣1
下列说法错误的是( )
A.若用标准状况下4.48L CH4还原NO2生成N2、CO2和液态水,放出的热量小于173.4kJ
B.利用以上反应可降低大气中的氮氧化合物的含量,有效减轻光化学烟雾
C.甲烷若设计成燃料电池,其能量利用率大于直接燃烧的能量利用率
D.反应②中当4.48L CH4反应完全时转移电子的物质的量为1.60mol
【解答】解:A.由上述分析可知,CH4还原NO2生成N2、CO2和气态水的热化学方程式为CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ mol﹣1,标准状况下4.48LCH4的物质的量为=0.2mol,则0.2molCH4还原NO2生成气态水时放出的热量为867kJ mol﹣1×0.2mol=173.4kJ,但气态水转化为液态水时放热,所以标准状况下4.48L CH4还原NO2生成N2、CO2和液态水,放出的热量大于173.4kJ,故A错误;
B.氮氧化物是引发光化学烟雾的主要因素,利用以上反应可降低大气中的NO、NO2等氮氧化合物的含量,可有效减轻光化学烟雾,故B正确;
C.甲烷燃烧时快速放出大量的热和光,能量利用率低,燃料电池中甲烷的反应相对缓慢,能量损耗少,能量利用率高得多,故C正确;
D.题干中没有已知气体的状况,4.48LCH4的物质的量不能计算,转移的电子更不能计算,故D错误;
故选:AD。
九.原电池和电解池的工作原理(共3小题)
12.(2021春 高青县期末)化学实现能量转化,造福人类。空间站以水为介质将不同形式的能量相互转化,原理如图所示,装置x电解水,装置y为燃料电池,下列有关说法不正确的是( )
A.太阳能电池实现了光能到电能的转化
B.该过程中,水可以循环使用
C.y工作时,转移2mol电子,消耗22.4L氢气
D.y工作时,氢气充入该装置的负极
【解答】解:A.太阳能电池将光能转化为电能,实现了光能到电能的转化,故A正确;
B.装置x消耗水,装置y中生成水,水可以循环使用,故B正确;
C.装置y为燃料电池,总反应为2H2+O2=2H2O,转移2mol电子,消耗1mol氢气,但题目未给标准状况,无法计算气体体积,故C错误;
D.装置y为燃料电池,总反应为2H2+O2=2H2O,氢元素由0价升高为+1价,氢气作负极,故D正确;
故选:C。
(多选)13.(2021春 滨州期末)微生物燃料电池是一种高效、经济的发电装置。一种双室微生物燃料电池的装置如图所示,其中负极反应为C6H12O6﹣24e﹣+6H2O═6CO2↑+24H+。下列说法错误的是( )
A.该装置可实现化学能转化为电能
B.如图所示装置中,左侧区域为负极区,右侧区域为正极区
C.放电时,正极生成的气体和负极消耗气体的物质的量之比为1:1
D.放电一段时间后,正极区酸性增强
【解答】解:A.该装置为原电池,可实现化学能转化为电能,故A正确;
B.左侧葡萄糖失电子为负极,右侧氧气得电子为正极,所以左侧区域为负极区,右侧区域为正极区,故B正确;
C.正极O2得电子,负极上生成CO2,所以正极消耗气体,负极生成气体,故C错误;
D.O2在正极上得电子,正极上的电极反应为O2+4e﹣+4H+=2H2O,正极区域氢离子浓度减小,所以正极区酸性减弱,故D错误;
故选:CD。
(多选)14.(2021春 聊城期末)质量相同的铁棒、碳棒和足量CuCl2溶液组成的装置如图所示,下列说法正确的是( )
A.闭合K,电子通过CuCl2溶液移到碳棒上
B.闭合K,铁棒表面发生的电极反应为Cu2++2e﹣═Cu
C.闭合K,转移电子0.2mol时,理论上碳棒与铁棒的质量差为12g
D.打开K,与闭合K时发生的总反应相同
【解答】解:A.“电子不下水,离子不上岸”,闭合K,电子由铁通过导线到达正极碳棒上,故A错误;
B.闭合K,该装置构成原电池,Fe易失电子作负极、C作正极,铁棒表面发生的电极反应为Fe﹣2e﹣═Fe2+,故B错误;
C.闭合K,该装置为原电池,当电路中转移电子0.2mol电子通过时,析出n(Cu)=×1mol=0.1mol,m(Cu)=0.1mol×64g/mol=6.4g,Fe电极上溶解的质量=56g/mol×0.1mol=5.6g,理论上碳棒与铁棒的质量差为6.4g+5.6g=12g,故C正确;
D.闭合K,该装置为原电池,电池的总反应为CuCl2+Fe=Cu+FeCl2,打开K反应为CuCl2+Fe=Cu+FeCl2,发生的总反应相同,故D正确;
故选:CD。
一十.常见化学电源的种类及其工作原理(共2小题)
15.(2021春 青岛期末)银锌电池是一种常见化学电源,反应原理为Zn+Ag2O+H2O=Zn(OH)2+2Ag,其工作示意图如图所示。下列说法正确的是( )
A.Zn为负极,电极反应式为Zn﹣2e﹣=Zn2+
B.电流从Zn电极经外电路流向Ag2O电极
C.理论上每转移1mol电子,Ag2O电极质量减少8g
D.KOH不参与电池反应,其溶液浓度始终保持不变
【解答】解:A.金属Zn的化合价升高,发生失去电子的氧化反应,为负极,负极反应为Zn+2OH﹣﹣2e﹣=Zn(OH)2,故A错误;
B.电流从Ag2O电极经外电路流向Zn电极,故B错误;
C.正极反应为Ag2O+H2O+2e﹣=2Ag+2OH﹣,放电前后,质量减轻,理论上每转移1mol电子,Ag2O电极质量减少mol×16g/mol=8g,故C正确;
D.氢氧根离子物质的量虽然不变,但水的量减少,KOH的浓度增大,pH增大,故D错误;
故选:C。
(多选)16.(2021春 烟台期末)磷酸铁锂电池应用广泛。该锂电池将锂嵌入碳材料,含Li+导电固体为电解质,电池反应为:LixC6+Li(1﹣x)FePO4LiFePO4+6C。下列说法正确的是( )
A.放电时,Li(1﹣x)FePO4作正极,发生还原反应
B.充电过程中,Li+由阴极区移向阳极区
C.充电时,与电源正极相连的电极反应为:LiFePO4﹣xe﹣→xLi++Li(1﹣x)FePO4
D.放电时,电子由负极经外电路移向正极,再经电解质移向负极
【解答】解:A.放电时,Li1﹣xFeO4为正极,反应式为Li1﹣xFeO4+xLi++xe﹣=LiFePO4,铁元素化合价降低发生还原反应,故A正确;
B.充电过程中为电解池,Li+由阳极区移向阴极区,故B错误;
C.充电时阳极与电源正极相连发生氧化反应,电极反应为:LiFePO4﹣xe﹣→xLi++Li(1﹣x)FePO4,故C正确;
D.电子不下水,电子不能通过电解质移向负极,故D错误;
故选:AC。
一十一.化学电源新型电池(共1小题)
(多选)17.(2021春 日照期末)K﹣O2电池结构如图所示,a和b为两个电极,其中之一为单质钾片。下列说法正确的是( )
A.隔膜允许K+通过,不允许O2通过
B.有机电解质2可用水溶液代替
C.放电时,a极的电极反应式为:K﹣e﹣═K+
D.放电时,电子由b电极沿导线流向a电极;充电时,b电极为阳极
【解答】解:A.由图可知,b极生成KO2,即a极上生成的K+通过隔膜移向b极,但O2氧化性强、K是活泼金属,防止电池损坏则隔膜不允许O2通过,故A正确;
B.KO2能与水反应,所以有机电解质2不能用水溶液代替,故B错误;
C.a极上K的化合价升高、发生失电子的氧化反应生成K+,负极反应为K﹣e﹣═K+,故C正确;
D.电子由负极流向正极,即电子由a电极沿导线流向b电极,充电时,b电极为阳极,故D错误;
故选:AC。
一十二.化学平衡建立的过程(共1小题)
(多选)18.(2021春 枣庄期末)在一定温度下的密闭容器中,C(s)+H2O(g) CO(g)+H2(g)达到化学平衡状态。下列说法正确的是( )
A.平衡建立的过程中,断裂的化学键只有碳碳键和氢氧键
B.混合气体的平均相对分子质量不再变化,说明该反应已达到平衡状态
C.加入足量的碳,达到平衡时体系中不再含有H2O(g)
D.温度升高,原化学平衡状态被破坏
【解答】解:A.该反应是可逆反应,平衡建立的过程中,断裂的化学键有碳碳键、氢氧键、碳氧键和氢氢键,故A错误;
B.该反应中C是固体,正向进行时混合气体的质量增大,气体总的物质的量增大,但不成正比,所以当混合气体的平均相对分子质量不再变化,说明该反应已达到平衡状态,故B正确;
C.C(s)+H2O(g) CO(g)+H2(g)是可逆反应,反应有限度,即使加入足量的碳,达到平衡时体系中仍有少量的H2O(g),故C错误;
D.温度升高,化学平衡向吸热的方向移动,所以温度升高,原化学平衡状态被破坏,故D正确;
故选:BD。
一十三.化学反应速率的影响因素(共3小题)
19.(2021春 聊城期末)下列措施不是为了改变化学反应速率的是( )
A.加工馒头时添加膨松剂
B.将食物存放在冰箱中
C.糕点包装袋内放置除氧剂
D.冶铁时将铁矿石粉碎
【解答】解:A.加工馒头时添加膨松剂,可使馒头疏松柔软,与改变反应速率无关,故A正确;
B.食物存放在冰箱中,可降低温度,减缓食物氧化速率,与减小反应速率有关,故B错误;
C.包装袋内放置除氧剂,可防止糕点被氧化,减缓食物氧化速率,与减小反应速率有关,故C错误;
D.将铁矿石粉碎,可增大接触面积,可加快反应速率,与增大反应速率有关,故D错误;
故选:A。
20.(2021春 济南期末)某化学小组欲测定酸性条件下KClO3溶液与NaHSO3溶液反应的化学反应速率,所用的试剂为10mL0.1mol.L﹣1 KClO3溶液和10mL0.3mol.L﹣1 NaHSO3溶液,所得c(Cl﹣)随时间变化的曲线如图所示。下列说法错误的是( )
A.该反应的离子方程式为ClO3﹣+3HSO3﹣=Cl﹣+3SO42﹣+3H+
B.该反应在0~4 min 的平均反应速率v(ClO3﹣)=2.5×10﹣3mol L﹣1 min﹣1
C.在反应过程中,该反应的化学反应速率变化趋势为先增大后减小
D.起初反应很慢,一段时间后反应速率明显增大,一定是反应放热温度升高的结果
【解答】解:A.发生氧化还原反应时Cl元素的化合价降低,S元素的化合价升高,由电子、电荷及原子守恒可知该反应的化学方程式是ClO3﹣+3HSO3﹣═Cl﹣+3SO42﹣+3H+,故A正确;
B.由实验数据可知,该反应在0~4min的平均反应速率v(Cl﹣)==2.5×10﹣3mol/(L min),且速率之比等于化学计量数之比,则在0~4 min 的平均反应速率v(ClO3﹣)=2.5×10﹣3mol L﹣1 min﹣1,故B正确;
C.反应放热,温度升高可加快反应速率,一段时间后反应物浓度减小导致速率减小,则该反应的化学反应速率变化趋势为先增大后减小,故C正确;
D.一段时间后反应速率明显增大,可能生成的氯离子或硫酸根离子作催化剂使反应速率加快,不一定是反应放热温度升高的结果,故D错误;
故选:D。
(多选)21.(2021春 烟台期末)在1 L的密闭容器中,发生反应:A(s)+3B(g) 2C(g)+D(g),经2min C的浓度增加0.4mol L﹣1。下列关于该反应速率的说法正确的是( )
A.用A表示的反应速率是0.1mol L﹣1 min﹣1
B.用B、C、D分别表示反应的速率,其比值是3:2:1
C.在2min末用B表示的反应速率小于0.3mol L﹣1 min﹣1
D.在这2min内用B表示的反应速率逐渐减小,用D表示的反应速率逐渐增大
【解答】解:A.A为固体,不能使用A的物质的量浓度变化表示反应速率,故A错误;
B.结合A(s)+3B(g) 2C(g)+D(g)可知,用B、C、D分别表示反应的速率之比等于其化学计量数之比=3:2:1,故B正确;
C.v(C)==0.2mol L﹣1 min﹣1,则2min内B的平均反应速率v(B)=v(C)=0.3mol L﹣1 min﹣1,由于浓度越小反应速率越小,则在2min末用B表示的反应速率小于0.3mol L﹣1 min﹣1,故C正确;
D.随反应进行反应物的浓度降低,反应速率减慢,生成物的浓度变化量逐渐减少,故2min内用B和C表示的反应速率都是逐渐减小,故D错误;
故选:BC。
一十四.化学平衡的影响因素(共1小题)
22.(2021春 济南期末)将0.2mol L﹣1的KI溶液和0.01mol L﹣1Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实 验,能说明溶液中存在化学平衡“2Fe3++2I﹣ 2Fe2++I2”的是( )
实验编号 实验操作 实验现象
① 滴入KSCN溶液 溶液变红色
② 滴入AgNO3溶液 有黄色沉淀生成
③ 滴入K3[Fe(CN)6]溶液 有蓝色沉淀生成
④ 滴入淀粉溶液 溶液变蓝色
已知:3Fe2++2[Fe(CN)6]3﹣=Fe3[Fe(CN)6]2↓(蓝色沉淀)。
A.①和③ B.②和④ C.③和④ D.①和②
【解答】解:说明溶液中存在化学平衡“2Fe3++2I﹣ 2Fe2++I2”,可使KI过量,且检验铁离子的存在,由0.2mol L﹣1的KI溶液和0.01mol L﹣1Fe2(SO4)3溶液等体积混合后,可知KI过量,①中可检验铁离子,③中可检验亚铁离子或④中检验碘单质,可知为可逆反应,符合的为①③或①④,
故选:A。
一十五.化学平衡状态的判断(共4小题)
23.(2021春 聊城期末)在一定条件下的恒容密闭容器中发生可逆反应2X(g) Y(g)+Z(s),下列不能说明该反应达到化学平衡状态的是( )
A.2v正(X)=v逆(Y)
B.反应容器中Y的质量分数不变
C.体系压强不再变化
D.混合气体的密度不再变化
【解答】解:A.2v正(X)=v逆(Y)不符合不同物质的正逆反应速率之比等于化学计量数之比,则不是平衡状态,故A正确;
B.反应容器中Y的质量分数不变,可知Y的物质的量不变,为平衡状态,故B错误;
C.反应为气体物质的量减小的反应,体系压强不再变化,可知气体的物质的量不变,为平衡状态,故C错误;
D.Z为固体,气体的质量为变量,体积不变,则混合气体的密度不再变化,为平衡状态,故D错误;
故选:A。
24.(2021春 济南期末)一定温度下,恒容密闭容器中发生反应CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)。
下列说法能够判断该反应已达到化学平衡状态的是( )
A.N2与CO2的浓度相等
B.混合气体的压强不再变化
C.混合气体的密度不再变化
D.相同时间内,消耗2molNO2的同时产生1molN2
【解答】解:A.N2与CO2的浓度相等,与起始量、转化率有关,不能判定平衡状态,故A错误;
B.体积不变,反应为气体物质的量增大的反应,混合气体的压强不再变化,可知气体的物质的量不变,达到平衡状态,故B正确;
C.反应中气体的质量不变,恒容密闭容器中气体的密度始终不变,不能判定平衡状态,故C错误;
D.相同时间内,消耗2molNO2的同时产生1molN2,只体现正反应速率关系,不能判定平衡状态,故D错误;
故选:B。
25.(2021春 济宁期末)某温度下,在恒容密闭容器中发生反应:2SO2(g)+O2(g)2SO3(g),当反应达到平衡时,下列有关说法正确的是( )
A.v正(O2)=2v逆(SO3)
B.升高温度能使正反应速率加快,逆反应速率减慢
C.使用催化剂可使O2全部转化为SO3
D.SO2的浓度不再发生变化
【解答】解:A.平衡时不同物质的正逆反应速率之比等于化学计量数之比,则平衡时2v正(O2)=v逆(SO3),故A错误;
B.升高温度正逆反应速率均增大,逆反应速率不会减慢,故B错误;
C.催化剂不影响平衡移动,为可逆反应,无论是否使用催化剂,均不能使O2全部转化为SO3,故C错误;
D.平衡时正逆反应速率相等,SO2的浓度不再发生变化,故D正确;
故选:D。
(多选)26.(2021春 临沂期末)在绝热的某刚性容器中置入1molF2和3mol ClF3,发生反应:F2(g)+ClF(g) ClF3(g)。下列说法中能够判断该反应一定处于平衡状态的有( )
A.F2(g)与ClF(g)体积之比恒定不变
B.F2(g)与ClF3(g)速率之比恒定不变
C.混合物中Cl元素质量分数恒定不变
D.容器中温度恒定不变
【解答】解:A.F2(g)与ClF(g)体积之比为变量,当F2(g)与ClF(g)体积之比恒定不变时,表明正逆反应速率相等,达到平衡状态,故A正确;
B.F2(g)与ClF3(g)速率之比等于化学计量数之比,该比值始终为1:1,不能根据F2(g)与ClF3(g)速率之比判断平衡状态,故B错误;
C.该反应尊重质量守恒定律,则混合物中Cl元素质量分数为定值,不能根据混合物中Cl元素质量分数判断平衡状态,故C错误;
D.在绝热容器内发生反应,则容器中温度为变量,当容器中温度不再变化时,表明达到平衡状态,故D正确;
故选:AD。
一十六.物质的量或浓度随时间的变化曲线(共2小题)
(多选)27.(2021春 日照期末)反应X═2Z经历两步:①X→Y;②Y→2Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法错误的是( )
A.曲线c为c(Y)随t的变化曲线
B.0~t1时间段内,反应速率v(X)=v(Y)=v(Z)
C.t2时,Y的消耗速率大于生成速率
D.t3后,c(Z)=2c0
【解答】解:A.Y先生成后消耗,故浓度先增大后减小,曲线c为c(Y)随t的变化曲线,故A正确;
B.曲线的斜率表示反应速率,根据图象可知,0~t1时间段内,反应速率v(Y)<v(Z),故B错误;
C.t2时,曲线c表示的Y的浓度逐渐减小,说明Y的消耗速率大于生成速率,故C正确;
D.根据图象,t3后仍存在Y,没有X,假设Y的剩余浓度为c(Y),由:①X→Y完全转化为Y时,Y的浓度为c0,根据②Y→2Z,生成的Z的浓度=2c0﹣c(Y),故D错误;
故选:BD。
(多选)28.(2021春 高青县期末)“理解与辩析能力”和“分析与推测能力”,都是化学四大关键能力之一。读图看表识数据,对关键能力的要求很高。一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应达到平衡状态),对该反应的推断正确的是( )
A.进行到1s时,v(A)=v(C)
B.化学方程式为3B+4C 6A+2D
C.进行到6s时,B的平均反应速率为0.05mol/(L s)
D.进行到6s时,B和D的物质的量浓度均为0.4mol L﹣1
【解答】解:A.由图可知进行到1s时,A增加0.6mol,C减少1.0mol﹣0.6mol=0.4mol,可知v(A)≠v(C),故A错误;
B.从开始至6s达到平衡时,B减少1.0mol﹣0.4mol=0.6mol,C减少1.0mol﹣0.2mol=0.8mol,A增加1.2mol,D增加0.4mol,且物质的量的变化量之比等于化学计量数之比,则反应为3B+4C 6A+2D,故B正确;
C.进行到6s时,B的平均反应速率为=0.05mol/(L s),故C正确;
D.容积为2L,进行到6s时,B和D的物质的量均为0.4mol,则浓度均为0.2mol L﹣1,故D错误;
故选:BC。
一十七.化学平衡的计算(共2小题)
29.(2021春 菏泽期末)一定温度下,向2L的密闭容器中充入1molN2和3molH2发生反应N2(g)+3H2(g) 2NH3(g),5min时测得n(NH3)=1.2mol。下列说法正确的是( )
A.5min内,v(H2)=0.36mol L﹣1 min﹣1
B.适当升高温度可以使正反应速率和逆反应速率都加快
C.增大N2的浓度可以使H2完全反应
D.5min时反应物与生成物的物质的量比为1:2
【解答】解:5min时测得n(NH3)=1.2mol,则
mol N2(g)+3H2(g) 2NH3(g)
开始 1 3 0
转化 0.6 1.8 1.2
5min 0.4 1.2 1.2
A.5min内,v(H2)==0.18mol L﹣1 min﹣1,故A错误;
B.升高温度可加快反应速率,可知适当升高温度可以使正反应速率和逆反应速率都加快,故B正确;
C.为可逆反应,不能完全转化,则增大N2的浓度也不能使H2完全反应,故C错误;
D.5min时反应物共1.6mol、生成物为1.2mol,则5min时反应物与生成物的物质的量比为4:3,故D错误;
故选:B。
30.(2021春 青岛期末)某温度下,在2L恒容密闭容器中充入一定量A,发生反应aA(g) B(g)+cC(g)。反应达平衡时,测得c(B)=0.2mol L﹣1,A、C的物质的量浓度随时间的变化如图所示。下列说法错误的是( )
A.a=2,c=3
B.M点时,A的消耗速率与C的生成速率相等
C.反应达平衡后,容器内A、B的物质的量之比为3:2
D.容器内气体的平均相对分子质量不再改变说明反应达平衡
【解答】解:反应达平衡时,测得 c(B)=0.2mol L﹣1,由图中转化可知,
mol/L aA(g) B(g)+cC(g)
开始 0.7 0 0
转化 0.2a 0.2 0.2c
平衡 0.3 0.2 0.6
A.0.7﹣0.2a=0.3,0.2c=0.6,解得a=2、c=3,故A正确;
B.M点平衡正向移动,且图中相同时间内消耗A的浓度与生成C的浓度不等,则M点时A的消耗速率与C的生成速率不相等,故B错误;
C.平衡时A、B的浓度分别为0.3mol/L、0.2mol/L,体积相同,则反应达平衡后,容器内A、B 的物质的量之比为3:2,故C正确;
D.气体的质量不变,反应正向进行时气体的物质的量增大,可知相对分子质量为变量,则容器内气体的平均相对分子质量不再改变说明反应达平衡,故D正确;
故选:B。
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
05选择题(中档题)
一.纯碱工业(侯氏制碱法)(共1小题)
1.(2021春 威海期末)如图是某小组模拟“侯氏制碱法”实验时所用到的部分装置。下列叙述错误的是( )
A.侯氏制碱法的关键反应为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl
B.实验时先从装置③的d口通入足量NH3,再从c口通入足量CO2
C.若改用稀H2SO4和碳酸钙粉末制取CO2,其发生装置可选用装置②
D.④是连接在装置①与装置③之间的气体净化装置,进气口是e
二.电子式(共1小题)
2.(2021春 威海期末)工业合成氨:N2(g)+3H2(g)2NH3(g)△H=﹣92.2kJ mol﹣1 对提高粮食产量发挥了重大作用。下列说法错误的是( )
A.N2的电子式:
B.NH3的形成过程可表示为:
C.298K时,在一密闭容器中充入1mol N2和3mol H2,充分反应后放出热量92.2kJ
D.一定温度、压强下,当原料气n(N2):n(H2)=1:3混合时,理论上平衡转化率最高
三.化学方程式的有关计算(共1小题)
(多选)3.(2021春 聊城期末)用18.0mol/L的浓硫酸20mL和铜共热一段时间后,待反应混合物冷却,滤去多余的铜,将滤液加水定容到100mL,溶液中SO42﹣浓度为2.6mol/L,则下列说法错误的是( )
A.反应后c(CuSO4)为2.6mol/L
B.反应中消耗的硫酸为0.1mol
C.溶解的铜的质量为6.4g
D.生成的SO2在标准状况下的体积为2.24L
四.原子结构与元素周期律的关系(共3小题)
4.(2021春 青岛期末)短周期主族元素W、X、Y、Z原子序数依次增大,质子数之和为43。W的最高价氧化物的水化物与其简单氢化物能发生化合反应生成盐;X原子最外层电子数是内层电子数的3倍;Y元素形成的单质及其化合物焰色试验呈黄色。下列说法错误的是( )
A.W位于元素周期表第2周期第ⅤA族
B.简单氢化物稳定性:X>W
C.简单离子半径:Z>Y>W>X
D.Y与其它三种元素均可形成二元离子化合物
5.(2021春 济南期末)X、Y、Z、R、W为原子序数依次增大的短周期元素,Z、W为同族元素,R的原子半径是同周期主族元素中最大的,X、Y、Z、W形成的化合物可表示为[YX4]+[XWZ4]﹣。下列说法正确的是( )
A.元素的最高正化合价:Z>Y
B.气态氢化物的热稳定性:W>Z
C.化合物R2Z2与R2W中的阴、阳离子个数比都为1:2
D.X、Y、Z形成的化合物一定为共价化合物
(多选)6.(2021春 菏泽期末)随原子序数的递增,8种短周期元素(用字母x,y、z等字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。下列说法错误的是( )
A.y元素在周期表的位置是第2周期ⅣA族
B.元素简单离子半径d<f
C.x、z元素能组成一种四原子共价化合物,其电子式可以表示为
D.e、f、g元素的最高价氧化物对应的水化物两两之间可以相互反应
五.离子化合物的结构特征与性质(共1小题)
(多选)7.(2021春 济南期末)全氮类物质具有高密度、超高能量及爆轰产物无污染等优点。中国科学家成功合成全氮阴离子N5﹣,N5﹣是制备全氮类物质N5+N5﹣的重要中间体。下列说法中不正确的是( )
A.全氮类物质属于绿色能源
B.每个N5+中含有36个质子
C.N5+N5﹣属于离子化合物
D.N5+N5﹣结构中含有离子键和共价键
六.共价键的形成及共价键的主要类型(共1小题)
(多选)8.(2021春 枣庄期末)二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下,S2Cl2易与水反应,并产生能使品红褪色的气体。下列说法错误的是( )
A.S2Cl2是含有极性键和非极性键的离子化合物
B.S2Cl2的摩尔质量为135g
C.S2Cl2与水反应时S﹣S键和S﹣Cl键都断裂
D.S2Cl2分子中化学键通过共用电子对的相互作用形成
七.氧化还原反应(共2小题)
(多选)9.(2021春 临沂期末)氟气化学性质十分活泼,具有很强的氧化性,工业上氟气常用作火箭燃料的氧化剂、卤化氟的原料、冷冻剂等。已知2F2+Na2SO4 2NaF+SO2F2+O2,针对该反应的下列有关说法正确的有( )
A.SO2F2既是氧化产物又是还原产物
B.F2的氧化性强于O2
C.生成42g NaF时,该反应转移1mol电子
D.反应中既有极性键、非极性键的断裂,又有极性键、非极性键的形成
(多选)10.(2021春 日照期末)为防止废弃的硒单质(Se)造成环境污染,通常用浓硫酸将其转化成二氧化硒(SeO2),再用KI溶液处理后回收Se。发生的反应为:①Se+2H2SO4(浓)═2SO2↑+SeO2+2H2O;
②SeO2+4KI+4HNO3═4KNO3+Se+2I2+2H2O。
下列说法错误的是( )
A.反应①中Se被氧化
B.反应②中KI是还原剂,HNO3是氧化剂
C.反应②中,SeO2发生氧化反应
D.还原性由强到弱的顺序:I﹣>Se>SO2
八.反应热和焓变(共1小题)
(多选)11.(2021春 烟台期末)甲烷是一种清洁燃料,一定条件下可与NO2、NO发生如下反应:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=﹣574kJ mol﹣1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1160kJ mol﹣1
下列说法错误的是( )
A.若用标准状况下4.48L CH4还原NO2生成N2、CO2和液态水,放出的热量小于173.4kJ
B.利用以上反应可降低大气中的氮氧化合物的含量,有效减轻光化学烟雾
C.甲烷若设计成燃料电池,其能量利用率大于直接燃烧的能量利用率
D.反应②中当4.48L CH4反应完全时转移电子的物质的量为1.60mol
九.原电池和电解池的工作原理(共3小题)
12.(2021春 高青县期末)化学实现能量转化,造福人类。空间站以水为介质将不同形式的能量相互转化,原理如图所示,装置x电解水,装置y为燃料电池,下列有关说法不正确的是( )
A.太阳能电池实现了光能到电能的转化
B.该过程中,水可以循环使用
C.y工作时,转移2mol电子,消耗22.4L氢气
D.y工作时,氢气充入该装置的负极
(多选)13.(2021春 滨州期末)微生物燃料电池是一种高效、经济的发电装置。一种双室微生物燃料电池的装置如图所示,其中负极反应为C6H12O6﹣24e﹣+6H2O═6CO2↑+24H+。下列说法错误的是( )
A.该装置可实现化学能转化为电能
B.如图所示装置中,左侧区域为负极区,右侧区域为正极区
C.放电时,正极生成的气体和负极消耗气体的物质的量之比为1:1
D.放电一段时间后,正极区酸性增强
(多选)14.(2021春 聊城期末)质量相同的铁棒、碳棒和足量CuCl2溶液组成的装置如图所示,下列说法正确的是( )
A.闭合K,电子通过CuCl2溶液移到碳棒上
B.闭合K,铁棒表面发生的电极反应为Cu2++2e﹣═Cu
C.闭合K,转移电子0.2mol时,理论上碳棒与铁棒的质量差为12g
D.打开K,与闭合K时发生的总反应相同
一十.常见化学电源的种类及其工作原理(共2小题)
15.(2021春 青岛期末)银锌电池是一种常见化学电源,反应原理为Zn+Ag2O+H2O=Zn(OH)2+2Ag,其工作示意图如图所示。下列说法正确的是( )
A.Zn为负极,电极反应式为Zn﹣2e﹣=Zn2+
B.电流从Zn电极经外电路流向Ag2O电极
C.理论上每转移1mol电子,Ag2O电极质量减少8g
D.KOH不参与电池反应,其溶液浓度始终保持不变
(多选)16.(2021春 烟台期末)磷酸铁锂电池应用广泛。该锂电池将锂嵌入碳材料,含Li+导电固体为电解质,电池反应为:LixC6+Li(1﹣x)FePO4LiFePO4+6C。下列说法正确的是( )
A.放电时,Li(1﹣x)FePO4作正极,发生还原反应
B.充电过程中,Li+由阴极区移向阳极区
C.充电时,与电源正极相连的电极反应为:LiFePO4﹣xe﹣→xLi++Li(1﹣x)FePO4
D.放电时,电子由负极经外电路移向正极,再经电解质移向负极
一十一.化学电源新型电池(共1小题)
(多选)17.(2021春 日照期末)K﹣O2电池结构如图所示,a和b为两个电极,其中之一为单质钾片。下列说法正确的是( )
A.隔膜允许K+通过,不允许O2通过
B.有机电解质2可用水溶液代替
C.放电时,a极的电极反应式为:K﹣e﹣═K+
D.放电时,电子由b电极沿导线流向a电极;充电时,b电极为阳极
一十二.化学平衡建立的过程(共1小题)
(多选)18.(2021春 枣庄期末)在一定温度下的密闭容器中,C(s)+H2O(g) CO(g)+H2(g)达到化学平衡状态。下列说法正确的是( )
A.平衡建立的过程中,断裂的化学键只有碳碳键和氢氧键
B.混合气体的平均相对分子质量不再变化,说明该反应已达到平衡状态
C.加入足量的碳,达到平衡时体系中不再含有H2O(g)
D.温度升高,原化学平衡状态被破坏
一十三.化学反应速率的影响因素(共3小题)
19.(2021春 聊城期末)下列措施不是为了改变化学反应速率的是( )
A.加工馒头时添加膨松剂
B.将食物存放在冰箱中
C.糕点包装袋内放置除氧剂
D.冶铁时将铁矿石粉碎
20.(2021春 济南期末)某化学小组欲测定酸性条件下KClO3溶液与NaHSO3溶液反应的化学反应速率,所用的试剂为10mL0.1mol.L﹣1 KClO3溶液和10mL0.3mol.L﹣1 NaHSO3溶液,所得c(Cl﹣)随时间变化的曲线如图所示。下列说法错误的是( )
A.该反应的离子方程式为ClO3﹣+3HSO3﹣=Cl﹣+3SO42﹣+3H+
B.该反应在0~4 min 的平均反应速率v(ClO3﹣)=2.5×10﹣3mol L﹣1 min﹣1
C.在反应过程中,该反应的化学反应速率变化趋势为先增大后减小
D.起初反应很慢,一段时间后反应速率明显增大,一定是反应放热温度升高的结果
(多选)21.(2021春 烟台期末)在1 L的密闭容器中,发生反应:A(s)+3B(g) 2C(g)+D(g),经2min C的浓度增加0.4mol L﹣1。下列关于该反应速率的说法正确的是( )
A.用A表示的反应速率是0.1mol L﹣1 min﹣1
B.用B、C、D分别表示反应的速率,其比值是3:2:1
C.在2min末用B表示的反应速率小于0.3mol L﹣1 min﹣1
D.在这2min内用B表示的反应速率逐渐减小,用D表示的反应速率逐渐增大
一十四.化学平衡的影响因素(共1小题)
22.(2021春 济南期末)将0.2mol L﹣1的KI溶液和0.01mol L﹣1Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实 验,能说明溶液中存在化学平衡“2Fe3++2I﹣ 2Fe2++I2”的是( )
实验编号 实验操作 实验现象
① 滴入KSCN溶液 溶液变红色
② 滴入AgNO3溶液 有黄色沉淀生成
③ 滴入K3[Fe(CN)6]溶液 有蓝色沉淀生成
④ 滴入淀粉溶液 溶液变蓝色
已知:3Fe2++2[Fe(CN)6]3﹣=Fe3[Fe(CN)6]2↓(蓝色沉淀)。
A.①和③ B.②和④ C.③和④ D.①和②
一十五.化学平衡状态的判断(共4小题)
23.(2021春 聊城期末)在一定条件下的恒容密闭容器中发生可逆反应2X(g) Y(g)+Z(s),下列不能说明该反应达到化学平衡状态的是( )
A.2v正(X)=v逆(Y)
B.反应容器中Y的质量分数不变
C.体系压强不再变化
D.混合气体的密度不再变化
24.(2021春 济南期末)一定温度下,恒容密闭容器中发生反应CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)。
下列说法能够判断该反应已达到化学平衡状态的是( )
A.N2与CO2的浓度相等
B.混合气体的压强不再变化
C.混合气体的密度不再变化
D.相同时间内,消耗2molNO2的同时产生1molN2
25.(2021春 济宁期末)某温度下,在恒容密闭容器中发生反应:2SO2(g)+O2(g)2SO3(g),当反应达到平衡时,下列有关说法正确的是( )
A.v正(O2)=2v逆(SO3)
B.升高温度能使正反应速率加快,逆反应速率减慢
C.使用催化剂可使O2全部转化为SO3
D.SO2的浓度不再发生变化
(多选)26.(2021春 临沂期末)在绝热的某刚性容器中置入1molF2和3mol ClF3,发生反应:F2(g)+ClF(g) ClF3(g)。下列说法中能够判断该反应一定处于平衡状态的有( )
A.F2(g)与ClF(g)体积之比恒定不变
B.F2(g)与ClF3(g)速率之比恒定不变
C.混合物中Cl元素质量分数恒定不变
D.容器中温度恒定不变
一十六.物质的量或浓度随时间的变化曲线(共2小题)
(多选)27.(2021春 日照期末)反应X═2Z经历两步:①X→Y;②Y→2Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法错误的是( )
A.曲线c为c(Y)随t的变化曲线
B.0~t1时间段内,反应速率v(X)=v(Y)=v(Z)
C.t2时,Y的消耗速率大于生成速率
D.t3后,c(Z)=2c0
(多选)28.(2021春 高青县期末)“理解与辩析能力”和“分析与推测能力”,都是化学四大关键能力之一。读图看表识数据,对关键能力的要求很高。一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应达到平衡状态),对该反应的推断正确的是( )
A.进行到1s时,v(A)=v(C)
B.化学方程式为3B+4C 6A+2D
C.进行到6s时,B的平均反应速率为0.05mol/(L s)
D.进行到6s时,B和D的物质的量浓度均为0.4mol L﹣1
一十七.化学平衡的计算(共2小题)
29.(2021春 菏泽期末)一定温度下,向2L的密闭容器中充入1molN2和3molH2发生反应N2(g)+3H2(g) 2NH3(g),5min时测得n(NH3)=1.2mol。下列说法正确的是( )
A.5min内,v(H2)=0.36mol L﹣1 min﹣1
B.适当升高温度可以使正反应速率和逆反应速率都加快
C.增大N2的浓度可以使H2完全反应
D.5min时反应物与生成物的物质的量比为1:2
30.(2021春 青岛期末)某温度下,在2L恒容密闭容器中充入一定量A,发生反应aA(g) B(g)+cC(g)。反应达平衡时,测得c(B)=0.2mol L﹣1,A、C的物质的量浓度随时间的变化如图所示。下列说法错误的是( )
A.a=2,c=3
B.M点时,A的消耗速率与C的生成速率相等
C.反应达平衡后,容器内A、B的物质的量之比为3:2
D.容器内气体的平均相对分子质量不再改变说明反应达平衡
参考答案与试题解析
一.纯碱工业(侯氏制碱法)(共1小题)
1.(2021春 威海期末)如图是某小组模拟“侯氏制碱法”实验时所用到的部分装置。下列叙述错误的是( )
A.侯氏制碱法的关键反应为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl
B.实验时先从装置③的d口通入足量NH3,再从c口通入足量CO2
C.若改用稀H2SO4和碳酸钙粉末制取CO2,其发生装置可选用装置②
D.④是连接在装置①与装置③之间的气体净化装置,进气口是e
【解答】解:A.③中发生NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl,可析出碳酸氢钠,为侯氏制碱法的关键反应,故A正确;
B.氨气极易溶于水,易发生倒吸,且碱性溶液可增大二氧化碳的溶解度,则实验时先从装置③的c口通入足量NH3,再从d口通入足量CO2,故B错误;
C.改用稀H2SO4和碳酸钙粉末制取CO2,为固液不加热反应,能选装置②,故C正确;
D.除杂时导管长进短出,则④可除去二氧化碳中的HCl,进气口是e,故D正确;
故选:B。
二.电子式(共1小题)
2.(2021春 威海期末)工业合成氨:N2(g)+3H2(g)2NH3(g)△H=﹣92.2kJ mol﹣1 对提高粮食产量发挥了重大作用。下列说法错误的是( )
A.N2的电子式:
B.NH3的形成过程可表示为:
C.298K时,在一密闭容器中充入1mol N2和3mol H2,充分反应后放出热量92.2kJ
D.一定温度、压强下,当原料气n(N2):n(H2)=1:3混合时,理论上平衡转化率最高
【解答】解:A.N2中N与N之间存在三个共用电子对,其电子式为,故A正确;
B.NH3属于共价化合物,N原子周围有8个电子,NH3的形成过程可表示为:,故B正确;
C.反应N2(g)+3H2(g)2NH3(g)△H=﹣92.2kJ mol﹣1 为可逆反应,反应不可能进行完全,298K时,在一密闭容器中充入1mol N2和3mol H2,充分反应后放出热量小于92.2kJ,故C错误;
D.按照方程式系数的比例关系投入原料转化率最高,一定温度、压强下,当原料气n(N2):n(H2)=1:3混合时,理论上平衡转化率最高,故D正确;
故选:C。
三.化学方程式的有关计算(共1小题)
(多选)3.(2021春 聊城期末)用18.0mol/L的浓硫酸20mL和铜共热一段时间后,待反应混合物冷却,滤去多余的铜,将滤液加水定容到100mL,溶液中SO42﹣浓度为2.6mol/L,则下列说法错误的是( )
A.反应后c(CuSO4)为2.6mol/L
B.反应中消耗的硫酸为0.1mol
C.溶解的铜的质量为6.4g
D.生成的SO2在标准状况下的体积为2.24L
【解答】解:浓硫酸中硫酸的物质的量n(H2SO4)=cV=0.02L×18.0mol/L=0.36mol,反应后溶液中n(SO42﹣)=cV=0.1L×2.6mol/L=0.26mol,根据S原子守恒可知生成SO2的物质的量n(SO2)=n(H2SO4)﹣n(SO42﹣)=0.36mol﹣0.26mol=0.1mol;
铜和浓硫酸反应的化学方程式为Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,则n(Cu)=n(CuSO4)=n(H2SO4)消耗=n(SO2)=0.1mol,n(H2SO4)消耗=0.2mol,
A.反应后c(CuSO4)为=1mol/L,故A错误;
B.反应中消耗的硫酸为0.2mol,故B错误;
C.溶解的铜m(Cu)=nM=0.1mol×64g/mol=6.4g,故C正确;
D.生成的SO2在标准状况下的体积为0.1mol×22.4L/mol=2.24L,故D正确;
故选:AB。
四.原子结构与元素周期律的关系(共3小题)
4.(2021春 青岛期末)短周期主族元素W、X、Y、Z原子序数依次增大,质子数之和为43。W的最高价氧化物的水化物与其简单氢化物能发生化合反应生成盐;X原子最外层电子数是内层电子数的3倍;Y元素形成的单质及其化合物焰色试验呈黄色。下列说法错误的是( )
A.W位于元素周期表第2周期第ⅤA族
B.简单氢化物稳定性:X>W
C.简单离子半径:Z>Y>W>X
D.Y与其它三种元素均可形成二元离子化合物
【解答】解:结合分析可知,W为N,X为O,Y为Na,Z为Cl元素,
A.W的原子序数为7,位于元素周期表第2周期第ⅤA族,故A正确;
B.非金属性O>N,则简单氢化物稳定性:X>W,故B正确;
C.电子层越多离子半径越大,电子层结构相同时,核电荷数越大离子半径越小,则简单离子半径:Z>W>X>Y,故C错误;
D.Na为活泼金属元素,则Na能够与N、O、Cl元素形成二元离子化合物,故D正确;
故选:C。
5.(2021春 济南期末)X、Y、Z、R、W为原子序数依次增大的短周期元素,Z、W为同族元素,R的原子半径是同周期主族元素中最大的,X、Y、Z、W形成的化合物可表示为[YX4]+[XWZ4]﹣。下列说法正确的是( )
A.元素的最高正化合价:Z>Y
B.气态氢化物的热稳定性:W>Z
C.化合物R2Z2与R2W中的阴、阳离子个数比都为1:2
D.X、Y、Z形成的化合物一定为共价化合物
【解答】解:由以上析可知,X为H,Y为N,Z为O,R为Na,W为S元素,
A.Z(O)的非金属性较强,不存在+6价,故A错误;
B.非金属性越强,简单气态氢化物的稳定性越强,非金属性S<O,则气态氢化物的热稳定性:W<Z,故B错误;
C.化合物Na2O2与Na2S中的阳离子均为钠离子,阴离子分别为过氧根离子、硫离子,则Na2O2与Na2S中阴、阳离子个数比都为1:2,故C正确;
D.X、Y、Z分别为H、N、O,H、N、O形成的化合物可能为离子化合物,如硝酸铵,故D错误;
故选:C。
(多选)6.(2021春 菏泽期末)随原子序数的递增,8种短周期元素(用字母x,y、z等字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。下列说法错误的是( )
A.y元素在周期表的位置是第2周期ⅣA族
B.元素简单离子半径d<f
C.x、z元素能组成一种四原子共价化合物,其电子式可以表示为
D.e、f、g元素的最高价氧化物对应的水化物两两之间可以相互反应
【解答】解:通过以上分析知,x、y、z、d、e、f、g、h分别是H、C、N、O、Na、Al、S、Cl元素;
A.y为C元素,C原子结构示意图为,则C元素位于第二周期第IVA族,故A正确;
B.电子层结构相同的离子,离子半径随着原子序数增大而减小,O2﹣、Al3+的电子层结构相同,且原子序数:d<f,所以离子半径r(O2﹣)>r(Al3+),故B错误;
C.x、z元素能组成一种四原子共价化合物为NH3,N原子和每个H原子共用1对电子对且N原子还有一对孤电子对,则氨气分子的电子式为,故C错误;
D.e、f、g元素的最高价氧化物的水化物分别是NaOH、Al(OH)3、H2SO4,Al(OH)3为两性氢氧化物,能和强碱NaOH、强酸硫酸反应生成盐和水,酸碱能发生中和反应,所以e、f、g元素的最高价氧化物对应的水化物两两之间可以相互反应,故D正确;
故选:BC。
五.离子化合物的结构特征与性质(共1小题)
(多选)7.(2021春 济南期末)全氮类物质具有高密度、超高能量及爆轰产物无污染等优点。中国科学家成功合成全氮阴离子N5﹣,N5﹣是制备全氮类物质N5+N5﹣的重要中间体。下列说法中不正确的是( )
A.全氮类物质属于绿色能源
B.每个N5+中含有36个质子
C.N5+N5﹣属于离子化合物
D.N5+N5﹣结构中含有离子键和共价键
【解答】解:A.全氮类物质爆轰产物无污染等优点,所以属于绿色能源,故A正确;
B.每个N5+中含有质子为7×5=35个,故B错误;
C.N5+ N5﹣中只含有N元素,只含有一种元素的纯净物属于单质,故C错误;
D.N5+和N5﹣离子间存在离子键,而离子内氮氮之间存在共价键,所以N5+N5﹣结构中含离子键和共价键,故D正确;
故选:BC。
六.共价键的形成及共价键的主要类型(共1小题)
(多选)8.(2021春 枣庄期末)二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下,S2Cl2易与水反应,并产生能使品红褪色的气体。下列说法错误的是( )
A.S2Cl2是含有极性键和非极性键的离子化合物
B.S2Cl2的摩尔质量为135g
C.S2Cl2与水反应时S﹣S键和S﹣Cl键都断裂
D.S2Cl2分子中化学键通过共用电子对的相互作用形成
【解答】解:A.S2Cl2的结构式为Cl﹣S﹣S﹣Cl,S2Cl2含有极性共价键和非极性共价键,不含离子键,所以不是离子化合物,故A错误;
B.摩尔质量的单位是g/mol,S2Cl2的摩尔质量为135g/mol,故B错误;
C.S2Cl2遇水易水解,并产生能使品红溶液褪色的气体,该气体为二氧化硫,在反应过程中硫元素一部分升高到+4价(生成SO2),一部分降低到0价(生成S),发生反应为2S2Cl2+2H2O=SO2↑+3S↓+4HCl,则S2Cl2中的Cl﹣S极性键和S﹣S非极性键均断裂,故C正确;
D.S2Cl2中只存在共价键,共价键是原子间通过共用电子对形成的相互作用,所以S2Cl2分子中化学键通过共用电子对的相互作用形成,故D正确;
故选:AB。
七.氧化还原反应(共2小题)
(多选)9.(2021春 临沂期末)氟气化学性质十分活泼,具有很强的氧化性,工业上氟气常用作火箭燃料的氧化剂、卤化氟的原料、冷冻剂等。已知2F2+Na2SO4 2NaF+SO2F2+O2,针对该反应的下列有关说法正确的有( )
A.SO2F2既是氧化产物又是还原产物
B.F2的氧化性强于O2
C.生成42g NaF时,该反应转移1mol电子
D.反应中既有极性键、非极性键的断裂,又有极性键、非极性键的形成
【解答】解:A.反应中,F元素的化合价降低被还原,O元素的化合价升高被氧化,则NaF和SO2F2是还原产物,O2是氧化产物,故A错误;
B.F2是氧化剂,O2是氧化产物,则F2的氧化性强于O2,故B正确;
C.42g NaF的物质的量为=1mol,由方程式可知,生成1molNaF,同时生成molO2,转移电子为mol×4=2mol,故C错误;
D.反应中有F﹣F非极性键,S﹣O极性键,生成物中有O=O非极性键和S﹣F极性键,所以反应中既有极性键、非极性键的断裂,又有极性键、非极性键的形成,故D正确;
故选:BD。
(多选)10.(2021春 日照期末)为防止废弃的硒单质(Se)造成环境污染,通常用浓硫酸将其转化成二氧化硒(SeO2),再用KI溶液处理后回收Se。发生的反应为:①Se+2H2SO4(浓)═2SO2↑+SeO2+2H2O;
②SeO2+4KI+4HNO3═4KNO3+Se+2I2+2H2O。
下列说法错误的是( )
A.反应①中Se被氧化
B.反应②中KI是还原剂,HNO3是氧化剂
C.反应②中,SeO2发生氧化反应
D.还原性由强到弱的顺序:I﹣>Se>SO2
【解答】解:A.①中S元素化合价由+6价变为+4价、Se元素化合价由0价变为+4价,则反应①中Se被氧化,故A正确;
B.②中Se元素化合价由+4价变为0价、I元素化合价由﹣1价变为0价,得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,则KI是还原剂,SeO2是氧化剂,故B错误;
C.反应②中,Se元素化合价降低,则SeO2得电子,发生还原反应,故C错误;
D.①中还原剂是Se、还原产物是SO2,则还原性:Se>SO2;②中还原剂是I﹣、还原产物是Se,则还原性:I﹣>Se,所以还原性由强到弱的顺序是:I﹣>Se>SO2,故D正确;
故选:BC。
八.反应热和焓变(共1小题)
(多选)11.(2021春 烟台期末)甲烷是一种清洁燃料,一定条件下可与NO2、NO发生如下反应:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=﹣574kJ mol﹣1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1160kJ mol﹣1
下列说法错误的是( )
A.若用标准状况下4.48L CH4还原NO2生成N2、CO2和液态水,放出的热量小于173.4kJ
B.利用以上反应可降低大气中的氮氧化合物的含量,有效减轻光化学烟雾
C.甲烷若设计成燃料电池,其能量利用率大于直接燃烧的能量利用率
D.反应②中当4.48L CH4反应完全时转移电子的物质的量为1.60mol
【解答】解:A.由上述分析可知,CH4还原NO2生成N2、CO2和气态水的热化学方程式为CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ mol﹣1,标准状况下4.48LCH4的物质的量为=0.2mol,则0.2molCH4还原NO2生成气态水时放出的热量为867kJ mol﹣1×0.2mol=173.4kJ,但气态水转化为液态水时放热,所以标准状况下4.48L CH4还原NO2生成N2、CO2和液态水,放出的热量大于173.4kJ,故A错误;
B.氮氧化物是引发光化学烟雾的主要因素,利用以上反应可降低大气中的NO、NO2等氮氧化合物的含量,可有效减轻光化学烟雾,故B正确;
C.甲烷燃烧时快速放出大量的热和光,能量利用率低,燃料电池中甲烷的反应相对缓慢,能量损耗少,能量利用率高得多,故C正确;
D.题干中没有已知气体的状况,4.48LCH4的物质的量不能计算,转移的电子更不能计算,故D错误;
故选:AD。
九.原电池和电解池的工作原理(共3小题)
12.(2021春 高青县期末)化学实现能量转化,造福人类。空间站以水为介质将不同形式的能量相互转化,原理如图所示,装置x电解水,装置y为燃料电池,下列有关说法不正确的是( )
A.太阳能电池实现了光能到电能的转化
B.该过程中,水可以循环使用
C.y工作时,转移2mol电子,消耗22.4L氢气
D.y工作时,氢气充入该装置的负极
【解答】解:A.太阳能电池将光能转化为电能,实现了光能到电能的转化,故A正确;
B.装置x消耗水,装置y中生成水,水可以循环使用,故B正确;
C.装置y为燃料电池,总反应为2H2+O2=2H2O,转移2mol电子,消耗1mol氢气,但题目未给标准状况,无法计算气体体积,故C错误;
D.装置y为燃料电池,总反应为2H2+O2=2H2O,氢元素由0价升高为+1价,氢气作负极,故D正确;
故选:C。
(多选)13.(2021春 滨州期末)微生物燃料电池是一种高效、经济的发电装置。一种双室微生物燃料电池的装置如图所示,其中负极反应为C6H12O6﹣24e﹣+6H2O═6CO2↑+24H+。下列说法错误的是( )
A.该装置可实现化学能转化为电能
B.如图所示装置中,左侧区域为负极区,右侧区域为正极区
C.放电时,正极生成的气体和负极消耗气体的物质的量之比为1:1
D.放电一段时间后,正极区酸性增强
【解答】解:A.该装置为原电池,可实现化学能转化为电能,故A正确;
B.左侧葡萄糖失电子为负极,右侧氧气得电子为正极,所以左侧区域为负极区,右侧区域为正极区,故B正确;
C.正极O2得电子,负极上生成CO2,所以正极消耗气体,负极生成气体,故C错误;
D.O2在正极上得电子,正极上的电极反应为O2+4e﹣+4H+=2H2O,正极区域氢离子浓度减小,所以正极区酸性减弱,故D错误;
故选:CD。
(多选)14.(2021春 聊城期末)质量相同的铁棒、碳棒和足量CuCl2溶液组成的装置如图所示,下列说法正确的是( )
A.闭合K,电子通过CuCl2溶液移到碳棒上
B.闭合K,铁棒表面发生的电极反应为Cu2++2e﹣═Cu
C.闭合K,转移电子0.2mol时,理论上碳棒与铁棒的质量差为12g
D.打开K,与闭合K时发生的总反应相同
【解答】解:A.“电子不下水,离子不上岸”,闭合K,电子由铁通过导线到达正极碳棒上,故A错误;
B.闭合K,该装置构成原电池,Fe易失电子作负极、C作正极,铁棒表面发生的电极反应为Fe﹣2e﹣═Fe2+,故B错误;
C.闭合K,该装置为原电池,当电路中转移电子0.2mol电子通过时,析出n(Cu)=×1mol=0.1mol,m(Cu)=0.1mol×64g/mol=6.4g,Fe电极上溶解的质量=56g/mol×0.1mol=5.6g,理论上碳棒与铁棒的质量差为6.4g+5.6g=12g,故C正确;
D.闭合K,该装置为原电池,电池的总反应为CuCl2+Fe=Cu+FeCl2,打开K反应为CuCl2+Fe=Cu+FeCl2,发生的总反应相同,故D正确;
故选:CD。
一十.常见化学电源的种类及其工作原理(共2小题)
15.(2021春 青岛期末)银锌电池是一种常见化学电源,反应原理为Zn+Ag2O+H2O=Zn(OH)2+2Ag,其工作示意图如图所示。下列说法正确的是( )
A.Zn为负极,电极反应式为Zn﹣2e﹣=Zn2+
B.电流从Zn电极经外电路流向Ag2O电极
C.理论上每转移1mol电子,Ag2O电极质量减少8g
D.KOH不参与电池反应,其溶液浓度始终保持不变
【解答】解:A.金属Zn的化合价升高,发生失去电子的氧化反应,为负极,负极反应为Zn+2OH﹣﹣2e﹣=Zn(OH)2,故A错误;
B.电流从Ag2O电极经外电路流向Zn电极,故B错误;
C.正极反应为Ag2O+H2O+2e﹣=2Ag+2OH﹣,放电前后,质量减轻,理论上每转移1mol电子,Ag2O电极质量减少mol×16g/mol=8g,故C正确;
D.氢氧根离子物质的量虽然不变,但水的量减少,KOH的浓度增大,pH增大,故D错误;
故选:C。
(多选)16.(2021春 烟台期末)磷酸铁锂电池应用广泛。该锂电池将锂嵌入碳材料,含Li+导电固体为电解质,电池反应为:LixC6+Li(1﹣x)FePO4LiFePO4+6C。下列说法正确的是( )
A.放电时,Li(1﹣x)FePO4作正极,发生还原反应
B.充电过程中,Li+由阴极区移向阳极区
C.充电时,与电源正极相连的电极反应为:LiFePO4﹣xe﹣→xLi++Li(1﹣x)FePO4
D.放电时,电子由负极经外电路移向正极,再经电解质移向负极
【解答】解:A.放电时,Li1﹣xFeO4为正极,反应式为Li1﹣xFeO4+xLi++xe﹣=LiFePO4,铁元素化合价降低发生还原反应,故A正确;
B.充电过程中为电解池,Li+由阳极区移向阴极区,故B错误;
C.充电时阳极与电源正极相连发生氧化反应,电极反应为:LiFePO4﹣xe﹣→xLi++Li(1﹣x)FePO4,故C正确;
D.电子不下水,电子不能通过电解质移向负极,故D错误;
故选:AC。
一十一.化学电源新型电池(共1小题)
(多选)17.(2021春 日照期末)K﹣O2电池结构如图所示,a和b为两个电极,其中之一为单质钾片。下列说法正确的是( )
A.隔膜允许K+通过,不允许O2通过
B.有机电解质2可用水溶液代替
C.放电时,a极的电极反应式为:K﹣e﹣═K+
D.放电时,电子由b电极沿导线流向a电极;充电时,b电极为阳极
【解答】解:A.由图可知,b极生成KO2,即a极上生成的K+通过隔膜移向b极,但O2氧化性强、K是活泼金属,防止电池损坏则隔膜不允许O2通过,故A正确;
B.KO2能与水反应,所以有机电解质2不能用水溶液代替,故B错误;
C.a极上K的化合价升高、发生失电子的氧化反应生成K+,负极反应为K﹣e﹣═K+,故C正确;
D.电子由负极流向正极,即电子由a电极沿导线流向b电极,充电时,b电极为阳极,故D错误;
故选:AC。
一十二.化学平衡建立的过程(共1小题)
(多选)18.(2021春 枣庄期末)在一定温度下的密闭容器中,C(s)+H2O(g) CO(g)+H2(g)达到化学平衡状态。下列说法正确的是( )
A.平衡建立的过程中,断裂的化学键只有碳碳键和氢氧键
B.混合气体的平均相对分子质量不再变化,说明该反应已达到平衡状态
C.加入足量的碳,达到平衡时体系中不再含有H2O(g)
D.温度升高,原化学平衡状态被破坏
【解答】解:A.该反应是可逆反应,平衡建立的过程中,断裂的化学键有碳碳键、氢氧键、碳氧键和氢氢键,故A错误;
B.该反应中C是固体,正向进行时混合气体的质量增大,气体总的物质的量增大,但不成正比,所以当混合气体的平均相对分子质量不再变化,说明该反应已达到平衡状态,故B正确;
C.C(s)+H2O(g) CO(g)+H2(g)是可逆反应,反应有限度,即使加入足量的碳,达到平衡时体系中仍有少量的H2O(g),故C错误;
D.温度升高,化学平衡向吸热的方向移动,所以温度升高,原化学平衡状态被破坏,故D正确;
故选:BD。
一十三.化学反应速率的影响因素(共3小题)
19.(2021春 聊城期末)下列措施不是为了改变化学反应速率的是( )
A.加工馒头时添加膨松剂
B.将食物存放在冰箱中
C.糕点包装袋内放置除氧剂
D.冶铁时将铁矿石粉碎
【解答】解:A.加工馒头时添加膨松剂,可使馒头疏松柔软,与改变反应速率无关,故A正确;
B.食物存放在冰箱中,可降低温度,减缓食物氧化速率,与减小反应速率有关,故B错误;
C.包装袋内放置除氧剂,可防止糕点被氧化,减缓食物氧化速率,与减小反应速率有关,故C错误;
D.将铁矿石粉碎,可增大接触面积,可加快反应速率,与增大反应速率有关,故D错误;
故选:A。
20.(2021春 济南期末)某化学小组欲测定酸性条件下KClO3溶液与NaHSO3溶液反应的化学反应速率,所用的试剂为10mL0.1mol.L﹣1 KClO3溶液和10mL0.3mol.L﹣1 NaHSO3溶液,所得c(Cl﹣)随时间变化的曲线如图所示。下列说法错误的是( )
A.该反应的离子方程式为ClO3﹣+3HSO3﹣=Cl﹣+3SO42﹣+3H+
B.该反应在0~4 min 的平均反应速率v(ClO3﹣)=2.5×10﹣3mol L﹣1 min﹣1
C.在反应过程中,该反应的化学反应速率变化趋势为先增大后减小
D.起初反应很慢,一段时间后反应速率明显增大,一定是反应放热温度升高的结果
【解答】解:A.发生氧化还原反应时Cl元素的化合价降低,S元素的化合价升高,由电子、电荷及原子守恒可知该反应的化学方程式是ClO3﹣+3HSO3﹣═Cl﹣+3SO42﹣+3H+,故A正确;
B.由实验数据可知,该反应在0~4min的平均反应速率v(Cl﹣)==2.5×10﹣3mol/(L min),且速率之比等于化学计量数之比,则在0~4 min 的平均反应速率v(ClO3﹣)=2.5×10﹣3mol L﹣1 min﹣1,故B正确;
C.反应放热,温度升高可加快反应速率,一段时间后反应物浓度减小导致速率减小,则该反应的化学反应速率变化趋势为先增大后减小,故C正确;
D.一段时间后反应速率明显增大,可能生成的氯离子或硫酸根离子作催化剂使反应速率加快,不一定是反应放热温度升高的结果,故D错误;
故选:D。
(多选)21.(2021春 烟台期末)在1 L的密闭容器中,发生反应:A(s)+3B(g) 2C(g)+D(g),经2min C的浓度增加0.4mol L﹣1。下列关于该反应速率的说法正确的是( )
A.用A表示的反应速率是0.1mol L﹣1 min﹣1
B.用B、C、D分别表示反应的速率,其比值是3:2:1
C.在2min末用B表示的反应速率小于0.3mol L﹣1 min﹣1
D.在这2min内用B表示的反应速率逐渐减小,用D表示的反应速率逐渐增大
【解答】解:A.A为固体,不能使用A的物质的量浓度变化表示反应速率,故A错误;
B.结合A(s)+3B(g) 2C(g)+D(g)可知,用B、C、D分别表示反应的速率之比等于其化学计量数之比=3:2:1,故B正确;
C.v(C)==0.2mol L﹣1 min﹣1,则2min内B的平均反应速率v(B)=v(C)=0.3mol L﹣1 min﹣1,由于浓度越小反应速率越小,则在2min末用B表示的反应速率小于0.3mol L﹣1 min﹣1,故C正确;
D.随反应进行反应物的浓度降低,反应速率减慢,生成物的浓度变化量逐渐减少,故2min内用B和C表示的反应速率都是逐渐减小,故D错误;
故选:BC。
一十四.化学平衡的影响因素(共1小题)
22.(2021春 济南期末)将0.2mol L﹣1的KI溶液和0.01mol L﹣1Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实 验,能说明溶液中存在化学平衡“2Fe3++2I﹣ 2Fe2++I2”的是( )
实验编号 实验操作 实验现象
① 滴入KSCN溶液 溶液变红色
② 滴入AgNO3溶液 有黄色沉淀生成
③ 滴入K3[Fe(CN)6]溶液 有蓝色沉淀生成
④ 滴入淀粉溶液 溶液变蓝色
已知:3Fe2++2[Fe(CN)6]3﹣=Fe3[Fe(CN)6]2↓(蓝色沉淀)。
A.①和③ B.②和④ C.③和④ D.①和②
【解答】解:说明溶液中存在化学平衡“2Fe3++2I﹣ 2Fe2++I2”,可使KI过量,且检验铁离子的存在,由0.2mol L﹣1的KI溶液和0.01mol L﹣1Fe2(SO4)3溶液等体积混合后,可知KI过量,①中可检验铁离子,③中可检验亚铁离子或④中检验碘单质,可知为可逆反应,符合的为①③或①④,
故选:A。
一十五.化学平衡状态的判断(共4小题)
23.(2021春 聊城期末)在一定条件下的恒容密闭容器中发生可逆反应2X(g) Y(g)+Z(s),下列不能说明该反应达到化学平衡状态的是( )
A.2v正(X)=v逆(Y)
B.反应容器中Y的质量分数不变
C.体系压强不再变化
D.混合气体的密度不再变化
【解答】解:A.2v正(X)=v逆(Y)不符合不同物质的正逆反应速率之比等于化学计量数之比,则不是平衡状态,故A正确;
B.反应容器中Y的质量分数不变,可知Y的物质的量不变,为平衡状态,故B错误;
C.反应为气体物质的量减小的反应,体系压强不再变化,可知气体的物质的量不变,为平衡状态,故C错误;
D.Z为固体,气体的质量为变量,体积不变,则混合气体的密度不再变化,为平衡状态,故D错误;
故选:A。
24.(2021春 济南期末)一定温度下,恒容密闭容器中发生反应CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)。
下列说法能够判断该反应已达到化学平衡状态的是( )
A.N2与CO2的浓度相等
B.混合气体的压强不再变化
C.混合气体的密度不再变化
D.相同时间内,消耗2molNO2的同时产生1molN2
【解答】解:A.N2与CO2的浓度相等,与起始量、转化率有关,不能判定平衡状态,故A错误;
B.体积不变,反应为气体物质的量增大的反应,混合气体的压强不再变化,可知气体的物质的量不变,达到平衡状态,故B正确;
C.反应中气体的质量不变,恒容密闭容器中气体的密度始终不变,不能判定平衡状态,故C错误;
D.相同时间内,消耗2molNO2的同时产生1molN2,只体现正反应速率关系,不能判定平衡状态,故D错误;
故选:B。
25.(2021春 济宁期末)某温度下,在恒容密闭容器中发生反应:2SO2(g)+O2(g)2SO3(g),当反应达到平衡时,下列有关说法正确的是( )
A.v正(O2)=2v逆(SO3)
B.升高温度能使正反应速率加快,逆反应速率减慢
C.使用催化剂可使O2全部转化为SO3
D.SO2的浓度不再发生变化
【解答】解:A.平衡时不同物质的正逆反应速率之比等于化学计量数之比,则平衡时2v正(O2)=v逆(SO3),故A错误;
B.升高温度正逆反应速率均增大,逆反应速率不会减慢,故B错误;
C.催化剂不影响平衡移动,为可逆反应,无论是否使用催化剂,均不能使O2全部转化为SO3,故C错误;
D.平衡时正逆反应速率相等,SO2的浓度不再发生变化,故D正确;
故选:D。
(多选)26.(2021春 临沂期末)在绝热的某刚性容器中置入1molF2和3mol ClF3,发生反应:F2(g)+ClF(g) ClF3(g)。下列说法中能够判断该反应一定处于平衡状态的有( )
A.F2(g)与ClF(g)体积之比恒定不变
B.F2(g)与ClF3(g)速率之比恒定不变
C.混合物中Cl元素质量分数恒定不变
D.容器中温度恒定不变
【解答】解:A.F2(g)与ClF(g)体积之比为变量,当F2(g)与ClF(g)体积之比恒定不变时,表明正逆反应速率相等,达到平衡状态,故A正确;
B.F2(g)与ClF3(g)速率之比等于化学计量数之比,该比值始终为1:1,不能根据F2(g)与ClF3(g)速率之比判断平衡状态,故B错误;
C.该反应尊重质量守恒定律,则混合物中Cl元素质量分数为定值,不能根据混合物中Cl元素质量分数判断平衡状态,故C错误;
D.在绝热容器内发生反应,则容器中温度为变量,当容器中温度不再变化时,表明达到平衡状态,故D正确;
故选:AD。
一十六.物质的量或浓度随时间的变化曲线(共2小题)
(多选)27.(2021春 日照期末)反应X═2Z经历两步:①X→Y;②Y→2Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法错误的是( )
A.曲线c为c(Y)随t的变化曲线
B.0~t1时间段内,反应速率v(X)=v(Y)=v(Z)
C.t2时,Y的消耗速率大于生成速率
D.t3后,c(Z)=2c0
【解答】解:A.Y先生成后消耗,故浓度先增大后减小,曲线c为c(Y)随t的变化曲线,故A正确;
B.曲线的斜率表示反应速率,根据图象可知,0~t1时间段内,反应速率v(Y)<v(Z),故B错误;
C.t2时,曲线c表示的Y的浓度逐渐减小,说明Y的消耗速率大于生成速率,故C正确;
D.根据图象,t3后仍存在Y,没有X,假设Y的剩余浓度为c(Y),由:①X→Y完全转化为Y时,Y的浓度为c0,根据②Y→2Z,生成的Z的浓度=2c0﹣c(Y),故D错误;
故选:BD。
(多选)28.(2021春 高青县期末)“理解与辩析能力”和“分析与推测能力”,都是化学四大关键能力之一。读图看表识数据,对关键能力的要求很高。一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应达到平衡状态),对该反应的推断正确的是( )
A.进行到1s时,v(A)=v(C)
B.化学方程式为3B+4C 6A+2D
C.进行到6s时,B的平均反应速率为0.05mol/(L s)
D.进行到6s时,B和D的物质的量浓度均为0.4mol L﹣1
【解答】解:A.由图可知进行到1s时,A增加0.6mol,C减少1.0mol﹣0.6mol=0.4mol,可知v(A)≠v(C),故A错误;
B.从开始至6s达到平衡时,B减少1.0mol﹣0.4mol=0.6mol,C减少1.0mol﹣0.2mol=0.8mol,A增加1.2mol,D增加0.4mol,且物质的量的变化量之比等于化学计量数之比,则反应为3B+4C 6A+2D,故B正确;
C.进行到6s时,B的平均反应速率为=0.05mol/(L s),故C正确;
D.容积为2L,进行到6s时,B和D的物质的量均为0.4mol,则浓度均为0.2mol L﹣1,故D错误;
故选:BC。
一十七.化学平衡的计算(共2小题)
29.(2021春 菏泽期末)一定温度下,向2L的密闭容器中充入1molN2和3molH2发生反应N2(g)+3H2(g) 2NH3(g),5min时测得n(NH3)=1.2mol。下列说法正确的是( )
A.5min内,v(H2)=0.36mol L﹣1 min﹣1
B.适当升高温度可以使正反应速率和逆反应速率都加快
C.增大N2的浓度可以使H2完全反应
D.5min时反应物与生成物的物质的量比为1:2
【解答】解:5min时测得n(NH3)=1.2mol,则
mol N2(g)+3H2(g) 2NH3(g)
开始 1 3 0
转化 0.6 1.8 1.2
5min 0.4 1.2 1.2
A.5min内,v(H2)==0.18mol L﹣1 min﹣1,故A错误;
B.升高温度可加快反应速率,可知适当升高温度可以使正反应速率和逆反应速率都加快,故B正确;
C.为可逆反应,不能完全转化,则增大N2的浓度也不能使H2完全反应,故C错误;
D.5min时反应物共1.6mol、生成物为1.2mol,则5min时反应物与生成物的物质的量比为4:3,故D错误;
故选:B。
30.(2021春 青岛期末)某温度下,在2L恒容密闭容器中充入一定量A,发生反应aA(g) B(g)+cC(g)。反应达平衡时,测得c(B)=0.2mol L﹣1,A、C的物质的量浓度随时间的变化如图所示。下列说法错误的是( )
A.a=2,c=3
B.M点时,A的消耗速率与C的生成速率相等
C.反应达平衡后,容器内A、B的物质的量之比为3:2
D.容器内气体的平均相对分子质量不再改变说明反应达平衡
【解答】解:反应达平衡时,测得 c(B)=0.2mol L﹣1,由图中转化可知,
mol/L aA(g) B(g)+cC(g)
开始 0.7 0 0
转化 0.2a 0.2 0.2c
平衡 0.3 0.2 0.6
A.0.7﹣0.2a=0.3,0.2c=0.6,解得a=2、c=3,故A正确;
B.M点平衡正向移动,且图中相同时间内消耗A的浓度与生成C的浓度不等,则M点时A的消耗速率与C的生成速率不相等,故B错误;
C.平衡时A、B的浓度分别为0.3mol/L、0.2mol/L,体积相同,则反应达平衡后,容器内A、B 的物质的量之比为3:2,故C正确;
D.气体的质量不变,反应正向进行时气体的物质的量增大,可知相对分子质量为变量,则容器内气体的平均相对分子质量不再改变说明反应达平衡,故D正确;
故选:B。
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
