【期末复习】06选择题(中档题)高一化学下册鲁科版期末真题知识点分类汇编
文档属性
| 名称 | 【期末复习】06选择题(中档题)高一化学下册鲁科版期末真题知识点分类汇编 |
|
|
| 格式 | docx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-20 11:21:00 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
06选择题(中档题)
一十八.弱电解质在水溶液中的电离平衡(共1小题)
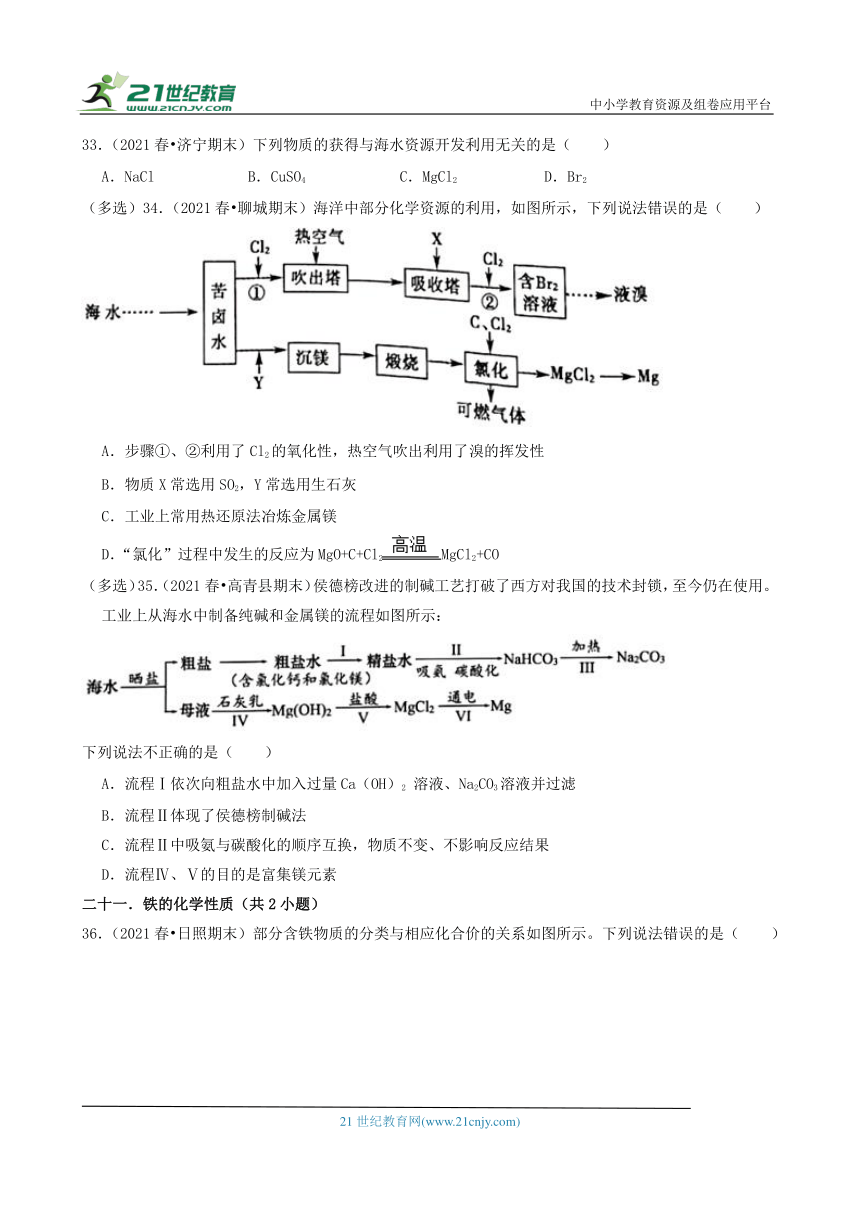
(多选)31.(2021春 威海期末)室温下,在0.1mol L﹣1三元弱酸H3A溶液中,微粒H3A、H2A﹣、HA2﹣、A3﹣的物质的量分数δ(X)随pH的变化如图所示。下列叙述错误的是[已知:δ(X)=]( )
A.反应A3﹣+H2A﹣ 2HA2﹣的平衡常数的值为105.2
B.将KOH溶液逐滴加入到H3A溶液中,反应H2A﹣+OH﹣═HA2﹣+H2O发生的pH范围是4.7~9.8
C.欲用H3A和K2HA配制pH=7.2的缓冲溶液(KH2A和K2HA的混合溶液),则需n(H3A):n(K2HA)=1:2
D.物质的量浓度均为0.1mol L﹣1的KH2A、K2HA混合溶液中:c(K+)>c(HA2﹣)>c(H2A﹣)>c(H+)>c(A3﹣)>c(OH﹣)
一十九.难溶电解质的溶解平衡及沉淀转化的本质(共1小题)
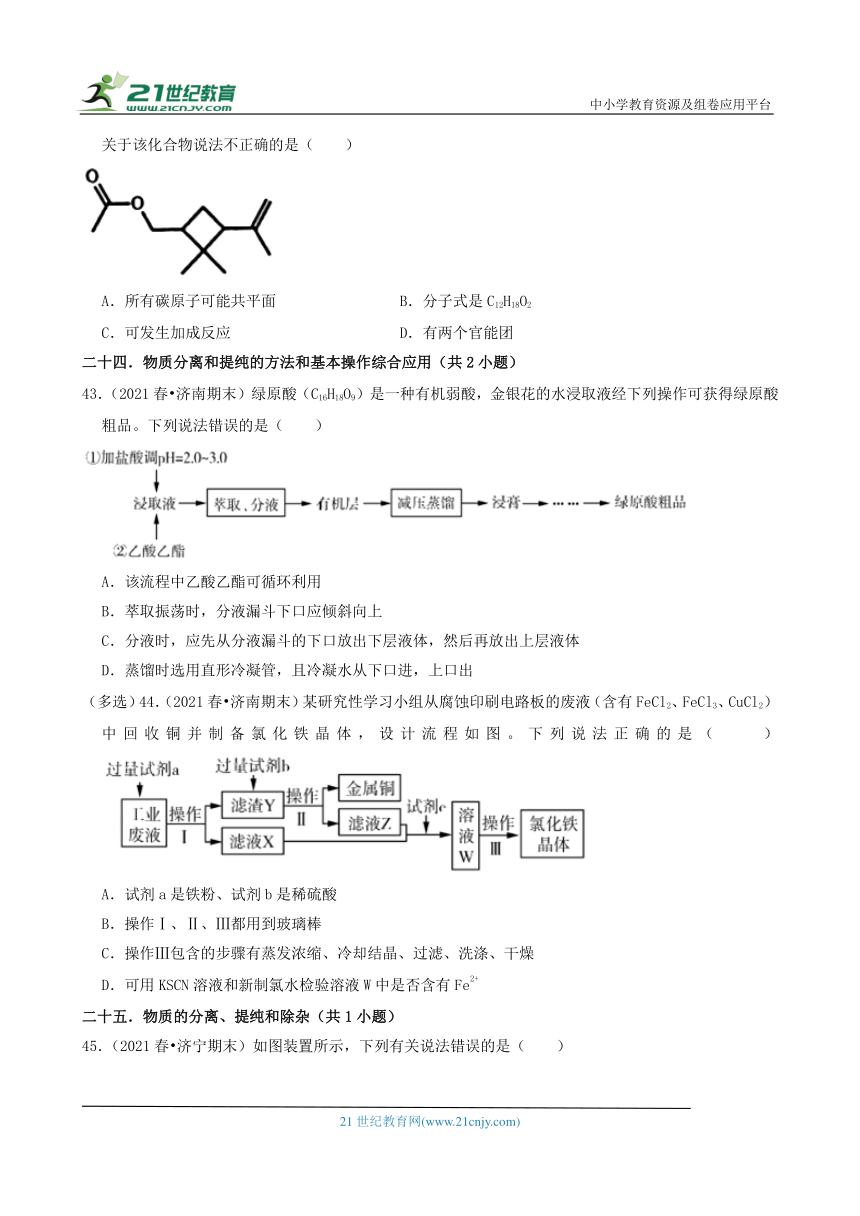
32.(2021春 威海期末)一定温度下,BaSO4(s) Ba2+(aq)+SO42﹣(aq)平衡体系中,c(Ba2+)和c(SO42﹣)的关系如图所示。下列说法正确的是( )
A.a、b、c三点对应的KW不相等
B.a、b、c三点对应c(Ba2+) c(SO42﹣)的数值,a点最大
C.BaSO4在水中形成的饱和溶液,c(Ba2+)=c(SO42﹣)
D.a点对应的溶液中加入BaSO4固体,c(Ba2+)沿曲线向b、c点方向变化
二十.海水资源及其综合利用(共3小题)
33.(2021春 济宁期末)下列物质的获得与海水资源开发利用无关的是( )
A.NaCl B.CuSO4 C.MgCl2 D.Br2
(多选)34.(2021春 聊城期末)海洋中部分化学资源的利用,如图所示,下列说法错误的是( )
A.步骤①、②利用了Cl2的氧化性,热空气吹出利用了溴的挥发性
B.物质X常选用SO2,Y常选用生石灰
C.工业上常用热还原法冶炼金属镁
D.“氯化”过程中发生的反应为MgO+C+Cl2MgCl2+CO
(多选)35.(2021春 高青县期末)侯德榜改进的制碱工艺打破了西方对我国的技术封锁,至今仍在使用。工业上从海水中制备纯碱和金属镁的流程如图所示:
下列说法不正确的是( )
A.流程Ⅰ依次向粗盐水中加入过量Ca(OH)2 溶液、Na2CO3溶液并过滤
B.流程Ⅱ体现了侯德榜制碱法
C.流程Ⅱ中吸氨与碳酸化的顺序互换,物质不变、不影响反应结果
D.流程Ⅳ、Ⅴ的目的是富集镁元素
二十一.铁的化学性质(共2小题)
36.(2021春 日照期末)部分含铁物质的分类与相应化合价的关系如图所示。下列说法错误的是( )
A.a可与e反应生成b
B.c在空气中可转化为d
C.可用KSCN溶液鉴别b、e
D.可存在a→e→d→c→b→a的循环转化关系
37.(2021春 青岛期末)如表各组物质中,物质之间不可能实现如图所示转化的是( )
选项 X Y Z M
A NH3 NO NO2 O2
B NaOH Na2CO3 NaHCO3 CO2
C Fe FeCl2 FeCl3 Cl2
D C CO CO2 H2O
A.A B.B C.C D.D
二十二.有机物的推断(共1小题)
(多选)38.(2021春 菏泽期末)乙酸乙酯有四种常见的合成方法。已知A是一种单糖,广泛存在于带甜味的水果中,B是一种生活中常见的含氧有机物且相对分子质量为46,E是一种石油裂解产物,能作水果的催熟剂。它们之间的转化关系如图所示。下列说法正确的是( )
A.有机物A能使碘水变蓝
B.反应④和⑥的反应类型为加成反应
C.B、D和乙酸乙酯都是挥发性无色液体,可以通过气味不同进行区别
D.反应②的化学方程式为2CH3CH2OHCH3COOCH2CH3+2H2O
二十三.有机物的结构和性质(共4小题)
39.(2021春 菏泽期末)某有机物的结构简式如图所示。下列说法错误的是( )
A.分子式是C12H14O4
B.能使酸性KMnO4溶液褪色
C.能与乙醇或乙酸发生酯化反应
D.与1mol该有机物最多能反应的Na和NaHCO3的物质的量之比为2:1
40.(2021春 济南期末)阿司匹林是影响人类历史进程和走向的化学药品,其化学名称为乙酰水杨酸(结构如图),下列关于乙酰水杨酸的说法正确的是( )
A.分子式为C9H10O4
B.能与乙醇发生酯化反应
C.分子中含有3种官能团
D.1mol乙酰水杨酸与足量的Na反应生成11.2LH2
(多选)41.(2021春 菏泽期末)已知异丁醇和叔丁醇的结构简式如图,下列说法错误的是( )
A.两种醇互为同分异构体
B.叔丁醇中所有的碳原子一定不在同一个平面上
C.两种醇与乙酸发生酯化反应后得到的酯相同
D.100mL 0.1mol L﹣1异丁醇溶液与足量Na反应生成112mL H2(标况)
(多选)42.(2021春 高青县期末)“结构决定性质”是重要的化学观念。昆虫信息素是昆虫之间传递信号的化学物质。人工合成信息素可用于诱捕害虫、测报虫情等。一种信息素的分子结构简式如图所示,关于该化合物说法不正确的是( )
A.所有碳原子可能共平面 B.分子式是C12H18O2
C.可发生加成反应 D.有两个官能团
二十四.物质分离和提纯的方法和基本操作综合应用(共2小题)
43.(2021春 济南期末)绿原酸(C16H18O9)是一种有机弱酸,金银花的水浸取液经下列操作可获得绿原酸粗品。下列说法错误的是( )
A.该流程中乙酸乙酯可循环利用
B.萃取振荡时,分液漏斗下口应倾斜向上
C.分液时,应先从分液漏斗的下口放出下层液体,然后再放出上层液体
D.蒸馏时选用直形冷凝管,且冷凝水从下口进,上口出
(多选)44.(2021春 济南期末)某研究性学习小组从腐蚀印刷电路板的废液(含有FeCl2、FeCl3、CuCl2)中回收铜并制备氯化铁晶体,设计流程如图。下列说法正确的是( )
A.试剂a是铁粉、试剂b是稀硫酸
B.操作Ⅰ、Ⅱ、Ⅲ都用到玻璃棒
C.操作Ⅲ包含的步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D.可用KSCN溶液和新制氯水检验溶液W中是否含有Fe2+
二十五.物质的分离、提纯和除杂(共1小题)
45.(2021春 济宁期末)如图装置所示,下列有关说法错误的是( )
A.若X溶液为溴水可除去SO2气体中少量的CO2
B.若X溶液为饱和食盐水可除去氯气中少量的氯化氢
C.若X溶液为氢氧化钠溶液可除去氮气中少量的二氧化氮
D.若X溶液为酸性高锰酸钾可鉴别丙烷和丙烯
二十六.实验装置综合(共1小题)
46.(2021春 高青县期末)喷泉实验装置如图所示。下列说法不正确的是( )
A.CO2和NaOH溶液组合也能形成喷泉现象
B.NO2、HCl 跟水形成喷泉后所得溶液的浓度相同
C.此装置形成喷泉的前提是让气体与水或溶液充分接触
D.无胶头滴管则无法引发喷泉实验
二十七.中和滴定(共1小题)
(多选)47.(2021春 威海期末)实验室用0.01mol L﹣1 KOH标准溶液测定一元弱酸叠氮酸(HN3)的浓度。下列叙述错误的是( )
A.可选用酚酞做指示剂
B.开始平视,滴定终点仰视,测定结果偏低
C.KN3溶液呈碱性,其原因是:N3﹣+H2O HN3+OH﹣
D.滴定终点的溶液中:c(K+ )=c(N3﹣)+c(HN3)﹣c(H+)
二十八.探究影响化学反应速率的因素(共1小题)
(多选)48.(2021春 滨州期末)Fenton法常用于处理含难降解有机物p﹣CP的工业废水,在调节好pH和Fe2+浓度的废水中加入H2O2,使产生的羟基自由基氧化降解污染物p﹣CP。控制p﹣CP的初始浓度相同,其余实验条件见下表,探究有关因素对该降解反应速率的影响。下列说法正确的是( )
实验编号 H2O2溶液 Fe2+溶液 蒸馏水 pH 温度
c/(10﹣3mol L﹣1) V/mL c/(10﹣3mol L﹣1) V/mL V/mL T/K
① 6.0 1.5 0.30 3.5 10 3 298
② 6.0 1.5 0.30 3.5 10 3 313
③ 6.0 3.5 0.30 3.5 x 3 298
④ 6.0 1.5 0.30 4.5 9 3 298
⑤ 6.0 1.5 0.30 3.5 10 10 298
A.实验①、⑤的目的是探究pH对p﹣CP降解速率的影响
B.实验②、④探究的是其它条件不变时,温度对p﹣CP降解速率的影响
C.实验③中,x=10
D.实验测得温度过高时,降解反应速率减小,可能的原因是H2O2受热分解
二十九.乙酸乙酯的制取(共1小题)
49.(2021春 济南期末)在实验室制备并获得乙酸乙酯粗产品的实验过程中,下列操作未涉及的是( )
A. B.
C. D.
三十.乙醇的催化氧化实验(共1小题)
(多选)50.(2021春 滨州期末)某课外活动小组用如图装置探究乙醇还原性并获得乙醛(夹持装置略),已知乙醛沸点20.8℃。下列叙述错误的是( )
A.甲、丙两装置均采取热水浴
B.实验过程中观察到铜网出现红色和黑色交替的现象
C.实验结束后,丙中试管收集的物质只有乙醛和水
D.若用氧气代替空气时,应适当降低气体的通入速率
三十一.化学实验方案的评价(共7小题)
51.(2021春 日照期末)下列实验操作或做法正确且能达到相应目的的是
选项 操作或做法 目的
A 向NaI溶液中滴入少量氯水和CCl4,振荡、静置 探究I﹣与Cl﹣的还原性
B 向Al2(SO4)3溶液中滴加过量Ba(OH)2溶液 验证Al(OH)3不溶于Ba(OH)2溶液
C 将铝条分别插入稀硫酸和浓硫酸中 探究浓度对反应速率的影响
D 实验结束,将剩余NaCl固体放回原试剂瓶 节约试剂
( )
A.A B.B C.C D.D
52.(2021春 日照期末)下列由实验现象所得结论错误的是( )
A.向浓HNO3中插入红热的炭,产生红棕色气体,证明炭可与浓HNO3反应生成NO2
B.向Na2S溶液中滴加氯水,产生淡黄色沉淀,证明Cl的非金属性强于S
C.向鸡蛋清溶液中加入CuSO4溶液,鸡蛋清凝固,加水不溶解,证明CuSO4能使蛋白质变性
D.向溴的四氯化碳溶液中滴入苯,无明显变化,证明苯分子结构中无碳碳双键
53.(2021秋 南通期末)下列制取并提纯乙酸乙酯的实验操作及装置正确的是( )
A.混合乙醇、乙酸和浓硫酸
B.制取乙酸乙酯
C.分离乙酸乙酯和水溶液
D.分离乙酸乙酯和乙醇
54.(2021春 威海期末)下列实验操作和现象及实验结论均正确的是( )
选项 实验操作和现象 实验结论
A 向浓度均为0.1 mol L﹣1的KCl和KI的混合溶液中滴加少量AgNO3溶液,先出现黄色沉淀 Ksp(AgCl)>Ksp(AgI)
B 向两支盛有2mL不同浓度Na2SO3溶液的试管中同时加入1mL 2%双氧水,观察实验现象 探究浓度对化学反应速率的影响
C 将Na2S2O3溶液与硫酸两种溶液混合后再用水浴加热,观察出现浑浊所用的时间 探究温度对化学反应速率的影响
D 室温用pH试纸测同浓度的NaClO和CH3COONa溶液的pH,pH(NaClO)>pH(CH3COONa) 酸性:HClO>CH3COOH
A.A B.B C.C D.D
(多选)55.(2021春 临沂期末)下列有关实验装置进行的相应实验,能达到实验目的是( )
A.用图1所示装置除去HCl中含有的少量Cl2
B.用图2所示装置验证在光照条件下甲烷与氯气的反应
C.用图3所示装置验证浓硫酸具有脱水性、强氧化性,SO2具有漂白性、还原性
D.用图4所示装置制取并收集干燥纯净的NH3
(多选)56.(2021春 聊城期末)实验探究是化学发展的必要路径。下列各实验的现象及结论都正确的是( )
选项 实验 现象 结论
A 浓硫酸滴入蔗糖中 蔗糖变黑、体积膨胀 浓硫酸具有脱水性
B 铜粉加入稀硫酸中,再加入少量硝酸钾固体 开始无明显现象,加入硝酸钾固体后溶液变蓝 硝酸钾起催化作用
C 向待测液中滴加浓氢氧化钠溶液并加热 产生使湿润蓝色石蕊试纸变红的气体 待测液中含有NH4+
D 向待测溶液中先加入淀粉溶液,再加入过氧化氢溶液 开始无明显现象,加入过氧化氢溶液后溶液变蓝 待测溶液中含有I﹣
A.A B.B C.C D.D
(多选)57.(2021春 高青县期末)“探究与创新能力”是化学的关键能力。下列各项中“操作或现象”能达到预期“实验目的”的是( )
选项 实验目的 操作或现象
A 制作简单原电池 将铁钉和铜丝连接插入食醋中即可形成原电池
B 验证碳能与浓硝酸反应 向浓硝酸中插入红热的碳,产生红棕色气体
C 鉴别溴蒸气和NO2 分别通入AgNO3溶液中,产生浅黄色沉淀的是溴蒸气
D 除去乙酸乙酯中的少量乙酸 加入足量饱和氢氧化钠溶液,充分混合后分液
A.A B.B C.C D.D
中小学教育资源及组卷应用平台
21世纪教育网(www.21cnjy.com)
参考答案与试题解析
一十八.弱电解质在水溶液中的电离平衡(共1小题)
(多选)31.(2021春 威海期末)室温下,在0.1mol L﹣1三元弱酸H3A溶液中,微粒H3A、H2A﹣、HA2﹣、A3﹣的物质的量分数δ(X)随pH的变化如图所示。下列叙述错误的是[已知:δ(X)=]( )
A.反应A3﹣+H2A﹣ 2HA2﹣的平衡常数的值为105.2
B.将KOH溶液逐滴加入到H3A溶液中,反应H2A﹣+OH﹣═HA2﹣+H2O发生的pH范围是4.7~9.8
C.欲用H3A和K2HA配制pH=7.2的缓冲溶液(KH2A和K2HA的混合溶液),则需n(H3A):n(K2HA)=1:2
D.物质的量浓度均为0.1mol L﹣1的KH2A、K2HA混合溶液中:c(K+)>c(HA2﹣)>c(H2A﹣)>c(H+)>c(A3﹣)>c(OH﹣)
【解答】解:H3A的电离平衡常数Ka1=,由图可知,pH=2.2时c(H2A﹣)=c(H3A),此时Ka1=c(H+)=10﹣pH=10﹣2.2,同理可得Ka2=10﹣7.2,Ka3=10﹣12.4,H2A﹣的水解平衡常数Kh3===10﹣11.8<Ka1,则H2A﹣的电离程度大于其水解程度,HA2﹣的水解平衡常数Kh2===10﹣6.8>Ka2,则HA2﹣的电离程度小于其水解程度,所以KH2A溶液呈酸性,K2HA溶液呈碱性,
A.反应A3﹣+H2A﹣ 2HA2﹣的平衡常数K==×===105.2,故A正确;
B.由图可知,pH范围在4.7~9.8之间时,c(H2A﹣)逐渐减小,c(HA2﹣)逐渐增加,即发生H2A﹣+OH﹣═HA2﹣+H2O的反应,故B正确;
C.KH2A溶液呈酸性,K2HA溶液呈碱性,由图可知,物质的量浓度相等的KH2A、K2HA混合溶液中pH=7.2,呈碱性,则HA2﹣水解程度大于H2A﹣的电离程度,若将等物质的量的KH2A、K2HA混合后形成溶液时,因HA2﹣水解程度大于H2A﹣的电离程度,而使n(K2HA)减小、n(KH2A)增加,要使H3A和K2HA配制的缓冲溶液pH=7.2,则n(K2HA)应略大于n(KH2A),H3A+K2HA=2KH2A,即n(H3A):n(K2HA)<1:2,故C错误;
D.H2A﹣的电离常数Ka2=10﹣7.2,HA2﹣的水解平衡常数Kh2=10﹣6.8>Ka2,则HA2﹣水解程度大于H2A﹣的电离程度,即物质的量浓度均为0.1mol L﹣1的KH2A、K2HA混合溶液中c (HA2﹣)减小、c(H2A﹣)增加,溶液呈碱性,c(OH﹣)>c(H+),所以溶液中有:c(K+)>c(H2A﹣)>c(HA2﹣)>c(OH﹣)>c(H+)>c(A3﹣),故D错误;
故选:CD。
一十九.难溶电解质的溶解平衡及沉淀转化的本质(共1小题)
32.(2021春 威海期末)一定温度下,BaSO4(s) Ba2+(aq)+SO42﹣(aq)平衡体系中,c(Ba2+)和c(SO42﹣)的关系如图所示。下列说法正确的是( )
A.a、b、c三点对应的KW不相等
B.a、b、c三点对应c(Ba2+) c(SO42﹣)的数值,a点最大
C.BaSO4在水中形成的饱和溶液,c(Ba2+)=c(SO42﹣)
D.a点对应的溶液中加入BaSO4固体,c(Ba2+)沿曲线向b、c点方向变化
【解答】解:A.水的离子积与温度有关,温度不变,则a、b、c三点对应的KW相等,故A错误;
B.曲线上点均为溶解平衡点,温度相同,且Ksp=c(Ba2+) c(SO42﹣),则a、b、c三点对应c(Ba2+) c(SO42﹣)的数值相等,故B错误;
C.BaSO4在水中形成的饱和溶液,存在BaSO4(s) Ba2+(aq)+SO42﹣(aq),可知c(Ba2+)=c(SO42﹣),故C正确;
D.a点为溶解平衡点,a点对应的溶液中加入BaSO4固体,溶解平衡不移动,则c(Ba2+)不变,不能沿着曲线变化,故D错误;
故选:C。
二十.海水资源及其综合利用(共3小题)
33.(2021春 济宁期末)下列物质的获得与海水资源开发利用无关的是( )
A.NaCl B.CuSO4 C.MgCl2 D.Br2
【解答】解:A.海水中含大量NaCl,海水晒盐后可提纯分离出NaCl,故A正确;
B.海水中不能获得CuSO4,故B错误;
C.海水中含镁离子,可沉淀后,盐酸溶解得到氯化镁,故C正确;
D.海水中含溴离子,可浓缩、氧化后萃取分离出溴,故D正确;
故选:B。
(多选)34.(2021春 聊城期末)海洋中部分化学资源的利用,如图所示,下列说法错误的是( )
A.步骤①、②利用了Cl2的氧化性,热空气吹出利用了溴的挥发性
B.物质X常选用SO2,Y常选用生石灰
C.工业上常用热还原法冶炼金属镁
D.“氯化”过程中发生的反应为MgO+C+Cl2MgCl2+CO
【解答】A.步骤①、②利用氯气的氧化性,氧化溴离子生成溴单质,利用溴易挥发的性质,可用热空气吹出,故A正确;
B.一般选用二氧化硫溶液,可将溴单质还原为溴离子富集溴,因此Y常选用二氧化硫,可增大溴单质的吸收量,氢氧化钙可与镁离子反应生成氢氧化镁沉淀,石灰乳来源广且价格便宜,因而沉镁过程一般选用石灰乳,故B错误;
C.金属镁化学性质比较活泼,工业上一般使用电解法电解熔融状态下的氯化镁来制备镁单质,故C错误;
D.氯化过程氧化镁、碳、氯气发生反应生成氯化镁和一氧化碳,化学方程式为:MgO+C+Cl2MgCl2+CO,故D正确;
故选:BC。
(多选)35.(2021春 高青县期末)侯德榜改进的制碱工艺打破了西方对我国的技术封锁,至今仍在使用。工业上从海水中制备纯碱和金属镁的流程如图所示:
下列说法不正确的是( )
A.流程Ⅰ依次向粗盐水中加入过量Ca(OH)2 溶液、Na2CO3溶液并过滤
B.流程Ⅱ体现了侯德榜制碱法
C.流程Ⅱ中吸氨与碳酸化的顺序互换,物质不变、不影响反应结果
D.流程Ⅳ、Ⅴ的目的是富集镁元素
【解答】解:A.流程Ⅰ依次向粗盐水中加入过量Ca(OH)2溶液、Na2CO3溶液并过滤,且碳酸钠可除去过量的氢氧化钙,故A正确;
B.二氧化碳在水中溶解度不大,则流程Ⅱ吸氨是使溶液呈碱性,有利于吸收二氧化碳,流程Ⅱ、流程Ⅲ体现了侯德榜制碱法,故B错误;
C.流程Ⅱ中吸氨与碳酸化的顺序互换,二氧化碳在水中溶解度不大,生成碳酸氢钠的量减少,影响反应结果,故C错误;
D.通过流程Ⅳ、Ⅴ的反应,增大氯化镁的浓度,可富集镁元素,故D正确;
故选:BC。
二十一.铁的化学性质(共2小题)
36.(2021春 日照期末)部分含铁物质的分类与相应化合价的关系如图所示。下列说法错误的是( )
A.a可与e反应生成b
B.c在空气中可转化为d
C.可用KSCN溶液鉴别b、e
D.可存在a→e→d→c→b→a的循环转化关系
【解答】解:A.若b为氯化亚铁,e为氯化铁,Fe与氯化铁反应生成氯化亚铁,故A正确;
B.氢氧化亚铁、氧气、水反应生成氢氧化铁,故B正确;
C.铁离子遇KSCN变为血红色,则可用KSCN溶液鉴别b、e,故C正确;
D.d→c的转化不能实现,故D错误;
故选:D。
37.(2021春 青岛期末)如表各组物质中,物质之间不可能实现如图所示转化的是( )
选项 X Y Z M
A NH3 NO NO2 O2
B NaOH Na2CO3 NaHCO3 CO2
C Fe FeCl2 FeCl3 Cl2
D C CO CO2 H2O
A.A B.B C.C D.D
【解答】解:A.氨气与氧气反应生成NO,NO与氧气反应生成二氧化氮,符合图中转化,故A正确;
B.NaOH与少量二氧化碳反应生成碳酸钠,碳酸钠与二氧化碳反应生成碳酸氢钠,符合图中转化,故B正确;
C.M为氯气时,都生成三氯化铁,反应与量无关,不符合图中转化,故C错误;
D.碳和水高温生成一氧化碳,一氧化碳与水高温生成二氧化碳,可实现转化,故D正确;
故选:C。
二十二.有机物的推断(共1小题)
(多选)38.(2021春 菏泽期末)乙酸乙酯有四种常见的合成方法。已知A是一种单糖,广泛存在于带甜味的水果中,B是一种生活中常见的含氧有机物且相对分子质量为46,E是一种石油裂解产物,能作水果的催熟剂。它们之间的转化关系如图所示。下列说法正确的是( )
A.有机物A能使碘水变蓝
B.反应④和⑥的反应类型为加成反应
C.B、D和乙酸乙酯都是挥发性无色液体,可以通过气味不同进行区别
D.反应②的化学方程式为2CH3CH2OHCH3COOCH2CH3+2H2O
【解答】解:A.通过以上分析知,A为葡萄糖,淀粉遇碘水变蓝色,葡萄糖遇碘水不变蓝色,故A错误;
B.乙醛和乙醛发生加成反应生成乙酸乙酯、乙酸和乙烯发生加成反应生成乙酸乙酯,所以反应④和⑥的反应类型为加成反应,故B正确;
C.B是乙醇、D是乙酸,乙醇是无色、有特殊香味的液体,乙酸是有强烈刺激性气味的无色液体,乙酸乙酯具有果香味,所以可以通过气味不同进行区别,故C正确;
D.根据原子守恒知,反应②的化学方程式为2CH3CH2OHCH3COOCH2CH3+2H2,故D错误;
故选:BC。
二十三.有机物的结构和性质(共4小题)
39.(2021春 菏泽期末)某有机物的结构简式如图所示。下列说法错误的是( )
A.分子式是C12H14O4
B.能使酸性KMnO4溶液褪色
C.能与乙醇或乙酸发生酯化反应
D.与1mol该有机物最多能反应的Na和NaHCO3的物质的量之比为2:1
【解答】解:A.由结构可知分子式是C12H14O4,故A正确;
B.含碳碳双键、羟基,均能使酸性KMnO4溶液褪色,故B正确;
C.含羟基可与乙酸发生酯化反应,含羧酸可与乙醇发生酯化反应,故C正确;
D.Na与羟基、羧基反应,只有羧基与碳酸氢钠反应,则与1mol该有机物最多能反应的Na和NaHCO3的物质的量之比为3:1,故D错误;
故选:D。
40.(2021春 济南期末)阿司匹林是影响人类历史进程和走向的化学药品,其化学名称为乙酰水杨酸(结构如图),下列关于乙酰水杨酸的说法正确的是( )
A.分子式为C9H10O4
B.能与乙醇发生酯化反应
C.分子中含有3种官能团
D.1mol乙酰水杨酸与足量的Na反应生成11.2LH2
【解答】解:A.由结构可知分子式为C9H8O4,故A错误;
B.含羧基,能与乙醇发生酯化反应,故B正确;
C.含羧基、酯基,共2种官能团,故C错误;
D.只有﹣COOH与Na反应,则1mol乙酰水杨酸与足量的Na反应生成0.5molH2,状况未知,不能计算其体积,故D错误;
故选:B。
(多选)41.(2021春 菏泽期末)已知异丁醇和叔丁醇的结构简式如图,下列说法错误的是( )
A.两种醇互为同分异构体
B.叔丁醇中所有的碳原子一定不在同一个平面上
C.两种醇与乙酸发生酯化反应后得到的酯相同
D.100mL 0.1mol L﹣1异丁醇溶液与足量Na反应生成112mL H2(标况)
【解答】解:A.异丁醇和叔丁醇的分子式相同,但羟基位置不同,二者互为同分异构体,故A正确;
B.连接羟基、3个甲基的碳原子处于四面体内部,叔丁醇中所有的碳原子一定不在同一个平面上,故B错误;
C.异丁醇和叔丁醇互为同分异构体,两种醇与乙酸发生酯化反应后得到的酯不相同,故C错误;
D.溶液中水也Na反应生成氢气,故D错误。
故选:CD。
(多选)42.(2021春 高青县期末)“结构决定性质”是重要的化学观念。昆虫信息素是昆虫之间传递信号的化学物质。人工合成信息素可用于诱捕害虫、测报虫情等。一种信息素的分子结构简式如图所示,关于该化合物说法不正确的是( )
A.所有碳原子可能共平面 B.分子式是C12H18O2
C.可发生加成反应 D.有两个官能团
【解答】解:A.含有多个饱和碳原子,具有甲烷的结构特征,则所有的碳原子不可能共平面,故A错误;
B.由结构简式可知有机物分子式是C12H20O2,故B错误;
C.含有碳碳双键,具有烯烃的性质,可发生加成反应,故C正确;
D.含有碳碳双键和酯基,则含有两个官能团,故D正确;
故选:AB。
二十四.物质分离和提纯的方法和基本操作综合应用(共2小题)
43.(2021春 济南期末)绿原酸(C16H18O9)是一种有机弱酸,金银花的水浸取液经下列操作可获得绿原酸粗品。下列说法错误的是( )
A.该流程中乙酸乙酯可循环利用
B.萃取振荡时,分液漏斗下口应倾斜向上
C.分液时,应先从分液漏斗的下口放出下层液体,然后再放出上层液体
D.蒸馏时选用直形冷凝管,且冷凝水从下口进,上口出
【解答】解:A.有机层减压蒸馏分离出乙酸乙酯可用于萃取,可循环使用,故A正确;
B.萃取振荡时,分液漏斗下口应倾斜向上,便于放气,充分混合萃取,故B正确;
C.乙酸乙酯的密度小于水,萃取分液时,水层在下方,则分液时,应先打开分液漏斗顶塞,再打开旋塞,使水层从分液漏斗下口放出,然后从上口倒出有机层,故C错误;
D.蒸馏时选用直形冷凝管,不残留馏分,且冷凝水从下口进上口出可充满冷凝管,冷凝效果好,故D正确;
故选:C。
(多选)44.(2021春 济南期末)某研究性学习小组从腐蚀印刷电路板的废液(含有FeCl2、FeCl3、CuCl2)中回收铜并制备氯化铁晶体,设计流程如图。下列说法正确的是( )
A.试剂a是铁粉、试剂b是稀硫酸
B.操作Ⅰ、Ⅱ、Ⅲ都用到玻璃棒
C.操作Ⅲ包含的步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D.可用KSCN溶液和新制氯水检验溶液W中是否含有Fe2+
【解答】解:A.由分析知试剂b为HCl,若用硫酸,则会引入杂质,故A错误;
B.操作Ⅰ、Ⅱ为过滤,需用玻璃棒引流液体,操作Ⅲ涉及蒸发操作,需用玻璃棒搅拌,防止液体飞溅,故B正确;
C.由氯化铁溶液得到氯化铁晶体,可知操作Ⅲ包含的步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故C正确;
D.溶液W中含Fe3+,干扰亚铁离子的检验,则用KSCN溶液和新制氯水不能检验溶液W 中是否含有Fe2+,故D错误;
故选:BC。
二十五.物质的分离、提纯和除杂(共1小题)
45.(2021春 济宁期末)如图装置所示,下列有关说法错误的是( )
A.若X溶液为溴水可除去SO2气体中少量的CO2
B.若X溶液为饱和食盐水可除去氯气中少量的氯化氢
C.若X溶液为氢氧化钠溶液可除去氮气中少量的二氧化氮
D.若X溶液为酸性高锰酸钾可鉴别丙烷和丙烯
【解答】解:A.二氧化硫与溴水反应,将原物质除去,不能除杂,故A错误;
B.HCl极易溶于水,食盐水可抑制氯气的溶解,洗气可分离,故B正确;
C.二氧化氮与NaOH溶液反应,氮气不能,洗气可分离,故C正确;
D.丙烯可被酸性高锰酸钾氧化,丙烷不能,现象不同,可鉴别,故D正确;
故选:A。
二十六.实验装置综合(共1小题)
46.(2021春 高青县期末)喷泉实验装置如图所示。下列说法不正确的是( )
A.CO2和NaOH溶液组合也能形成喷泉现象
B.NO2、HCl 跟水形成喷泉后所得溶液的浓度相同
C.此装置形成喷泉的前提是让气体与水或溶液充分接触
D.无胶头滴管则无法引发喷泉实验
【解答】解:A.二氧化碳被氢氧化钠溶液吸收,圆底烧瓶中气体压强减小,形成喷泉,故A正确;
B.HCl 跟水形成喷泉后,设烧瓶的体积是VL,标准状况下n(HCl)==mol,c===mol/L,NO2跟水形成喷泉后3NO2+H2O=2HNO3+NO,从方程式可以看出,有1/3的NO生成,体积上升2/3,n(HNO3)=×=×mol,c===mol/L,故NO2、HCl 跟水形成喷泉后所得溶液的浓度相同,故B正确;
C.让气体与水或溶液充分接触,烧瓶中气体压强减小,外界大气压将烧杯中液体压入圆底烧瓶形成喷泉,故C正确;
D.无胶头滴管,可以通过热毛巾捂住圆底烧瓶,圆底烧瓶内气体压强增大,与烧杯中水或溶液接触引发喷泉,故D错误;
故选:D。
二十七.中和滴定(共1小题)
(多选)47.(2021春 威海期末)实验室用0.01mol L﹣1 KOH标准溶液测定一元弱酸叠氮酸(HN3)的浓度。下列叙述错误的是( )
A.可选用酚酞做指示剂
B.开始平视,滴定终点仰视,测定结果偏低
C.KN3溶液呈碱性,其原因是:N3﹣+H2O HN3+OH﹣
D.滴定终点的溶液中:c(K+ )=c(N3﹣)+c(HN3)﹣c(H+)
【解答】解:A.KOH标准溶液滴定叠氮酸溶液,达到滴定终点时生成弱酸强碱盐KN3,溶液呈碱性,应该选择酚酞作指示剂,故A正确;
B.开始平视,滴定终点仰视,导致标准液的体积读数偏大,由c(待测)=可知,c(待测)偏高,故B错误;
C.KN3是弱酸强碱盐,N3﹣水解使溶液呈碱性,水解方程式为N3﹣+H2O HN3+OH﹣,故C正确;
D.滴定终点生成KN3,物料守恒关系为c(K+ )=c(N3﹣)+c(HN3),则(K+ )>c(N3﹣)+c(HN3)﹣c(H+),故D错误;
故选:BD。
二十八.探究影响化学反应速率的因素(共1小题)
(多选)48.(2021春 滨州期末)Fenton法常用于处理含难降解有机物p﹣CP的工业废水,在调节好pH和Fe2+浓度的废水中加入H2O2,使产生的羟基自由基氧化降解污染物p﹣CP。控制p﹣CP的初始浓度相同,其余实验条件见下表,探究有关因素对该降解反应速率的影响。下列说法正确的是( )
实验编号 H2O2溶液 Fe2+溶液 蒸馏水 pH 温度
c/(10﹣3mol L﹣1) V/mL c/(10﹣3mol L﹣1) V/mL V/mL T/K
① 6.0 1.5 0.30 3.5 10 3 298
② 6.0 1.5 0.30 3.5 10 3 313
③ 6.0 3.5 0.30 3.5 x 3 298
④ 6.0 1.5 0.30 4.5 9 3 298
⑤ 6.0 1.5 0.30 3.5 10 10 298
A.实验①、⑤的目的是探究pH对p﹣CP降解速率的影响
B.实验②、④探究的是其它条件不变时,温度对p﹣CP降解速率的影响
C.实验③中,x=10
D.实验测得温度过高时,降解反应速率减小,可能的原因是H2O2受热分解
【解答】解:A.实验①、⑤只有溶液的pH不同,其他数值均相同,则实验①、⑤的目的是探究pH对p﹣CP降解速率的影响,故A正确;
B.实验②、④中有两个变量:温度不同、Fe2+溶液浓度不同,不能探究温度对p﹣CP降解速率的影响,探究温度对p﹣CP降解速率影响的是实验①、②,故B错误;
C.实验①、③的目的是探究H2O2溶液浓度对p﹣CP降解速率的影响,溶液的总体积为15mL,则x=15﹣3.5﹣3.5=8,故C错误;
D.H2O2不稳定、受热易发生分解,所以实验测得温度过高时,降解反应速率减小,故D正确;
故选:AD。
二十九.乙酸乙酯的制取(共1小题)
49.(2021春 济南期末)在实验室制备并获得乙酸乙酯粗产品的实验过程中,下列操作未涉及的是( )
A. B.
C. D.
【解答】解:A.乙醇、乙酸发生酯化反应生成乙酸乙酯,需浓硫酸作催化剂、吸水剂,图中加热装置可制备乙酸乙酯,故A正确;
B.饱和碳酸钠可吸收乙醇、除去乙酸、降低酯的溶解度,图中饱和碳酸钠溶液可用于提纯,故B正确;
C.乙酸乙酯与水溶液分层,可选图中装置分离出乙酸乙酯,故C正确;
D.图中为过滤装置,乙酸乙酯的制备、提纯中不涉及过滤操作,故D错误;
故选:D。
三十.乙醇的催化氧化实验(共1小题)
(多选)50.(2021春 滨州期末)某课外活动小组用如图装置探究乙醇还原性并获得乙醛(夹持装置略),已知乙醛沸点20.8℃。下列叙述错误的是( )
A.甲、丙两装置均采取热水浴
B.实验过程中观察到铜网出现红色和黑色交替的现象
C.实验结束后,丙中试管收集的物质只有乙醛和水
D.若用氧气代替空气时,应适当降低气体的通入速率
【解答】解:A.甲的烧杯中的水起加热乙醇的作用,使乙醇形成蒸气挥发,丙的烧杯中的水有冷凝乙醛作用,使乙醛蒸气冷却,则甲烧杯中盛装热水,丙烧杯中盛装冷水,故A错误;
B.反应中铜被氧化生成氧化铜,颜色由红变黑,氧化铜与乙醇反应生成铜,颜色由黑变红,即实验过程中铜丝出现红、黑颜色交替变化的现象,故B正确;
C.乙醛还可能被氧化为乙酸,所以丙中试管中收集到的液体中有乙醇、乙醛、水和乙酸,故C错误;
D.乙醛易被氧化为乙酸,为防止生成的乙醛被氧化成乙酸,适当降低纯氧的通入速率,故D正确;
故选:AC。
三十一.化学实验方案的评价(共7小题)
51.(2021春 日照期末)下列实验操作或做法正确且能达到相应目的的是
选项 操作或做法 目的
A 向NaI溶液中滴入少量氯水和CCl4,振荡、静置 探究I﹣与Cl﹣的还原性
B 向Al2(SO4)3溶液中滴加过量Ba(OH)2溶液 验证Al(OH)3不溶于Ba(OH)2溶液
C 将铝条分别插入稀硫酸和浓硫酸中 探究浓度对反应速率的影响
D 实验结束,将剩余NaCl固体放回原试剂瓶 节约试剂
( )
A.A B.B C.C D.D
【解答】解:A.氯气与NaI反应生成碘,碘易溶于四氯化碳,由操作和现象可探究I﹣与Cl﹣的还原性,故A正确;
B.Al2(SO4)3溶液中滴加过量Ba(OH)2溶液,生成硫酸钡白色沉淀,而Al(OH)3溶于Ba(OH)2溶液,故B错误;
C.常温变Al遇浓硫酸发生钝化,由操作和现象不能探究浓度对速率的影响,故C错误;
D.一般剩余的试剂不能放回原瓶,防止试剂污染,则剩余NaCl固体不能放回原试剂瓶,故D错误;
故选:A。
52.(2021春 日照期末)下列由实验现象所得结论错误的是( )
A.向浓HNO3中插入红热的炭,产生红棕色气体,证明炭可与浓HNO3反应生成NO2
B.向Na2S溶液中滴加氯水,产生淡黄色沉淀,证明Cl的非金属性强于S
C.向鸡蛋清溶液中加入CuSO4溶液,鸡蛋清凝固,加水不溶解,证明CuSO4能使蛋白质变性
D.向溴的四氯化碳溶液中滴入苯,无明显变化,证明苯分子结构中无碳碳双键
【解答】解:A.浓硝酸受热分解生成二氧化氮,则向浓HNO3中插入红热的炭,产生红棕色气体,不能证明炭可与浓HNO3反应生成NO2,故A错误;
B.氯水与硫化钠反应生成S,则产生淡黄色沉淀,证明Cl的非金属性强于S,故B正确;
C.鸡蛋清溶液中加入CuSO4溶液,发生变性,则鸡蛋清凝固,加水不溶解,故C正确;
D.苯与溴不能发生加成反应,则向溴的四氯化碳溶液中滴入苯,无明显变化,证明苯分子结构中无碳碳双键,故D正确;
故选:A。
53.(2021秋 南通期末)下列制取并提纯乙酸乙酯的实验操作及装置正确的是( )
A.混合乙醇、乙酸和浓硫酸
B.制取乙酸乙酯
C.分离乙酸乙酯和水溶液
D.分离乙酸乙酯和乙醇
【解答】解:A.混合乙醇、乙酸和浓硫酸的方法是:先加乙醇再加浓硫酸最后加乙酸,图示操作方法不合理,故A错误;
B.收集乙酸乙酯的导管不能插入饱和碳酸钠溶液,否则易发生倒吸现象,图示装置不合理,故B错误;
C.乙酸乙酯与水分层,有机层在上层,水在下层,图示实验操作及装置均合理,故C正确;
D.温度计用于测量馏分温度,应该放在蒸馏烧瓶的支管口处,图示温度计的水银球位置不合理,故D错误;
故选:C。
54.(2021春 威海期末)下列实验操作和现象及实验结论均正确的是( )
选项 实验操作和现象 实验结论
A 向浓度均为0.1 mol L﹣1的KCl和KI的混合溶液中滴加少量AgNO3溶液,先出现黄色沉淀 Ksp(AgCl)>Ksp(AgI)
B 向两支盛有2mL不同浓度Na2SO3溶液的试管中同时加入1mL 2%双氧水,观察实验现象 探究浓度对化学反应速率的影响
C 将Na2S2O3溶液与硫酸两种溶液混合后再用水浴加热,观察出现浑浊所用的时间 探究温度对化学反应速率的影响
D 室温用pH试纸测同浓度的NaClO和CH3COONa溶液的pH,pH(NaClO)>pH(CH3COONa) 酸性:HClO>CH3COOH
A.A B.B C.C D.D
【解答】解:A.浓度均为0.1 mol L﹣1的KCl和KI的混合溶液中滴加少量AgNO3溶液,Ksp小的先沉淀,先出现黄色沉淀,可知Ksp(AgCl)>Ksp(AgI),故A正确;
B.过氧化氢与亚硫酸钠反应生成硫酸钠、水,无明显现象,不能探究浓度对速率的影响,故B错误;
C.混合后再用水浴加热,温度相同,应将混合物分别在热水、冷水中反应来探究温度对反应速率的影响,故C错误;
D.NaClO溶液可使pH试纸褪色,应选pH计测定等浓度盐溶液的pH来比较对应酸的酸性,故D错误;
故选:A。
(多选)55.(2021春 临沂期末)下列有关实验装置进行的相应实验,能达到实验目的是( )
A.用图1所示装置除去HCl中含有的少量Cl2
B.用图2所示装置验证在光照条件下甲烷与氯气的反应
C.用图3所示装置验证浓硫酸具有脱水性、强氧化性,SO2具有漂白性、还原性
D.用图4所示装置制取并收集干燥纯净的NH3
【解答】解:A.HCl极易溶于水,食盐水抑制氯气的溶解,将原物质除去,不能除杂,故A错误;
B.光照下发生取代反应生成HCl,HCl极易溶于水,观察黄绿色气体消失、液面上升可证明,故B正确;
C.浓硫酸使蔗糖脱水后,C与浓硫酸反应生成二氧化碳、二氧化硫,二氧化硫可使品红褪色、可被酸性高锰酸钾氧化,可验证浓硫酸具有脱水性、强氧化性,SO2具有漂白性、还原性,故C正确;
D.氨气的密度比空气密度小,图中收集方法不合理,故D错误;
故选:BC。
(多选)56.(2021春 聊城期末)实验探究是化学发展的必要路径。下列各实验的现象及结论都正确的是( )
选项 实验 现象 结论
A 浓硫酸滴入蔗糖中 蔗糖变黑、体积膨胀 浓硫酸具有脱水性
B 铜粉加入稀硫酸中,再加入少量硝酸钾固体 开始无明显现象,加入硝酸钾固体后溶液变蓝 硝酸钾起催化作用
C 向待测液中滴加浓氢氧化钠溶液并加热 产生使湿润蓝色石蕊试纸变红的气体 待测液中含有NH4+
D 向待测溶液中先加入淀粉溶液,再加入过氧化氢溶液 开始无明显现象,加入过氧化氢溶液后溶液变蓝 待测溶液中含有I﹣
A.A B.B C.C D.D
【解答】解:A.蔗糖变黑与浓硫酸的脱水性有关,体积膨胀,说明生成气体,浓硫酸与碳反应生成二氧化碳、二氧化硫等气体,与浓硫酸的强氧化性有关,故A错误;
B.酸性条件下,硝酸根离子具有强氧化性,可氧化铜生成铜离子,溶液变蓝色,反应中硝酸钾起到氧化剂的作用,故B错误;
C.能使湿润蓝色石蕊试纸变红的气体为氨气,则向待测液中滴加浓氢氧化钠溶液并加热,产生使湿润蓝色石蕊试纸变红的气体,可说明待测液中含有NH4+,故C正确;
D.加入淀粉,溶液变蓝色,应生成碘单质,则可说明待测溶液中含有I﹣,故D正确;
故选:CD。
(多选)57.(2021春 高青县期末)“探究与创新能力”是化学的关键能力。下列各项中“操作或现象”能达到预期“实验目的”的是( )
选项 实验目的 操作或现象
A 制作简单原电池 将铁钉和铜丝连接插入食醋中即可形成原电池
B 验证碳能与浓硝酸反应 向浓硝酸中插入红热的碳,产生红棕色气体
C 鉴别溴蒸气和NO2 分别通入AgNO3溶液中,产生浅黄色沉淀的是溴蒸气
D 除去乙酸乙酯中的少量乙酸 加入足量饱和氢氧化钠溶液,充分混合后分液
A.A B.B C.C D.D
【解答】解:A.将铁钉和铜丝连接插入食醋中,铁为负极,铜为正极,乙酸为电解质,可形成原电池,故A正确;
B.浓硝酸受热分解生成二氧化氮,则向浓HNO3中插入红热的炭,产生红棕色气体,不能证明炭可与浓HNO3反应生成NO2,故B错误;
C.溴与硝酸银反应生成淡黄色沉淀,二氧化氮与水反应后溶液为无色,现象不同可鉴别,故C正确;
D.乙酸乙酯溶于氢氧化钠溶液,不能用氢氧化钠溶液除去乙酸乙酯中的少量乙酸,应该选用饱和碳酸钠溶液,故D错误;
中小学教育资源及组卷应用平台
故选:AC。21世纪教育网(www.21cnjy.com)
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
06选择题(中档题)
一十八.弱电解质在水溶液中的电离平衡(共1小题)
(多选)31.(2021春 威海期末)室温下,在0.1mol L﹣1三元弱酸H3A溶液中,微粒H3A、H2A﹣、HA2﹣、A3﹣的物质的量分数δ(X)随pH的变化如图所示。下列叙述错误的是[已知:δ(X)=]( )
A.反应A3﹣+H2A﹣ 2HA2﹣的平衡常数的值为105.2
B.将KOH溶液逐滴加入到H3A溶液中,反应H2A﹣+OH﹣═HA2﹣+H2O发生的pH范围是4.7~9.8
C.欲用H3A和K2HA配制pH=7.2的缓冲溶液(KH2A和K2HA的混合溶液),则需n(H3A):n(K2HA)=1:2
D.物质的量浓度均为0.1mol L﹣1的KH2A、K2HA混合溶液中:c(K+)>c(HA2﹣)>c(H2A﹣)>c(H+)>c(A3﹣)>c(OH﹣)
一十九.难溶电解质的溶解平衡及沉淀转化的本质(共1小题)
32.(2021春 威海期末)一定温度下,BaSO4(s) Ba2+(aq)+SO42﹣(aq)平衡体系中,c(Ba2+)和c(SO42﹣)的关系如图所示。下列说法正确的是( )
A.a、b、c三点对应的KW不相等
B.a、b、c三点对应c(Ba2+) c(SO42﹣)的数值,a点最大
C.BaSO4在水中形成的饱和溶液,c(Ba2+)=c(SO42﹣)
D.a点对应的溶液中加入BaSO4固体,c(Ba2+)沿曲线向b、c点方向变化
二十.海水资源及其综合利用(共3小题)
33.(2021春 济宁期末)下列物质的获得与海水资源开发利用无关的是( )
A.NaCl B.CuSO4 C.MgCl2 D.Br2
(多选)34.(2021春 聊城期末)海洋中部分化学资源的利用,如图所示,下列说法错误的是( )
A.步骤①、②利用了Cl2的氧化性,热空气吹出利用了溴的挥发性
B.物质X常选用SO2,Y常选用生石灰
C.工业上常用热还原法冶炼金属镁
D.“氯化”过程中发生的反应为MgO+C+Cl2MgCl2+CO
(多选)35.(2021春 高青县期末)侯德榜改进的制碱工艺打破了西方对我国的技术封锁,至今仍在使用。工业上从海水中制备纯碱和金属镁的流程如图所示:
下列说法不正确的是( )
A.流程Ⅰ依次向粗盐水中加入过量Ca(OH)2 溶液、Na2CO3溶液并过滤
B.流程Ⅱ体现了侯德榜制碱法
C.流程Ⅱ中吸氨与碳酸化的顺序互换,物质不变、不影响反应结果
D.流程Ⅳ、Ⅴ的目的是富集镁元素
二十一.铁的化学性质(共2小题)
36.(2021春 日照期末)部分含铁物质的分类与相应化合价的关系如图所示。下列说法错误的是( )
A.a可与e反应生成b
B.c在空气中可转化为d
C.可用KSCN溶液鉴别b、e
D.可存在a→e→d→c→b→a的循环转化关系
37.(2021春 青岛期末)如表各组物质中,物质之间不可能实现如图所示转化的是( )
选项 X Y Z M
A NH3 NO NO2 O2
B NaOH Na2CO3 NaHCO3 CO2
C Fe FeCl2 FeCl3 Cl2
D C CO CO2 H2O
A.A B.B C.C D.D
二十二.有机物的推断(共1小题)
(多选)38.(2021春 菏泽期末)乙酸乙酯有四种常见的合成方法。已知A是一种单糖,广泛存在于带甜味的水果中,B是一种生活中常见的含氧有机物且相对分子质量为46,E是一种石油裂解产物,能作水果的催熟剂。它们之间的转化关系如图所示。下列说法正确的是( )
A.有机物A能使碘水变蓝
B.反应④和⑥的反应类型为加成反应
C.B、D和乙酸乙酯都是挥发性无色液体,可以通过气味不同进行区别
D.反应②的化学方程式为2CH3CH2OHCH3COOCH2CH3+2H2O
二十三.有机物的结构和性质(共4小题)
39.(2021春 菏泽期末)某有机物的结构简式如图所示。下列说法错误的是( )
A.分子式是C12H14O4
B.能使酸性KMnO4溶液褪色
C.能与乙醇或乙酸发生酯化反应
D.与1mol该有机物最多能反应的Na和NaHCO3的物质的量之比为2:1
40.(2021春 济南期末)阿司匹林是影响人类历史进程和走向的化学药品,其化学名称为乙酰水杨酸(结构如图),下列关于乙酰水杨酸的说法正确的是( )
A.分子式为C9H10O4
B.能与乙醇发生酯化反应
C.分子中含有3种官能团
D.1mol乙酰水杨酸与足量的Na反应生成11.2LH2
(多选)41.(2021春 菏泽期末)已知异丁醇和叔丁醇的结构简式如图,下列说法错误的是( )
A.两种醇互为同分异构体
B.叔丁醇中所有的碳原子一定不在同一个平面上
C.两种醇与乙酸发生酯化反应后得到的酯相同
D.100mL 0.1mol L﹣1异丁醇溶液与足量Na反应生成112mL H2(标况)
(多选)42.(2021春 高青县期末)“结构决定性质”是重要的化学观念。昆虫信息素是昆虫之间传递信号的化学物质。人工合成信息素可用于诱捕害虫、测报虫情等。一种信息素的分子结构简式如图所示,关于该化合物说法不正确的是( )
A.所有碳原子可能共平面 B.分子式是C12H18O2
C.可发生加成反应 D.有两个官能团
二十四.物质分离和提纯的方法和基本操作综合应用(共2小题)
43.(2021春 济南期末)绿原酸(C16H18O9)是一种有机弱酸,金银花的水浸取液经下列操作可获得绿原酸粗品。下列说法错误的是( )
A.该流程中乙酸乙酯可循环利用
B.萃取振荡时,分液漏斗下口应倾斜向上
C.分液时,应先从分液漏斗的下口放出下层液体,然后再放出上层液体
D.蒸馏时选用直形冷凝管,且冷凝水从下口进,上口出
(多选)44.(2021春 济南期末)某研究性学习小组从腐蚀印刷电路板的废液(含有FeCl2、FeCl3、CuCl2)中回收铜并制备氯化铁晶体,设计流程如图。下列说法正确的是( )
A.试剂a是铁粉、试剂b是稀硫酸
B.操作Ⅰ、Ⅱ、Ⅲ都用到玻璃棒
C.操作Ⅲ包含的步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D.可用KSCN溶液和新制氯水检验溶液W中是否含有Fe2+
二十五.物质的分离、提纯和除杂(共1小题)
45.(2021春 济宁期末)如图装置所示,下列有关说法错误的是( )
A.若X溶液为溴水可除去SO2气体中少量的CO2
B.若X溶液为饱和食盐水可除去氯气中少量的氯化氢
C.若X溶液为氢氧化钠溶液可除去氮气中少量的二氧化氮
D.若X溶液为酸性高锰酸钾可鉴别丙烷和丙烯
二十六.实验装置综合(共1小题)
46.(2021春 高青县期末)喷泉实验装置如图所示。下列说法不正确的是( )
A.CO2和NaOH溶液组合也能形成喷泉现象
B.NO2、HCl 跟水形成喷泉后所得溶液的浓度相同
C.此装置形成喷泉的前提是让气体与水或溶液充分接触
D.无胶头滴管则无法引发喷泉实验
二十七.中和滴定(共1小题)
(多选)47.(2021春 威海期末)实验室用0.01mol L﹣1 KOH标准溶液测定一元弱酸叠氮酸(HN3)的浓度。下列叙述错误的是( )
A.可选用酚酞做指示剂
B.开始平视,滴定终点仰视,测定结果偏低
C.KN3溶液呈碱性,其原因是:N3﹣+H2O HN3+OH﹣
D.滴定终点的溶液中:c(K+ )=c(N3﹣)+c(HN3)﹣c(H+)
二十八.探究影响化学反应速率的因素(共1小题)
(多选)48.(2021春 滨州期末)Fenton法常用于处理含难降解有机物p﹣CP的工业废水,在调节好pH和Fe2+浓度的废水中加入H2O2,使产生的羟基自由基氧化降解污染物p﹣CP。控制p﹣CP的初始浓度相同,其余实验条件见下表,探究有关因素对该降解反应速率的影响。下列说法正确的是( )
实验编号 H2O2溶液 Fe2+溶液 蒸馏水 pH 温度
c/(10﹣3mol L﹣1) V/mL c/(10﹣3mol L﹣1) V/mL V/mL T/K
① 6.0 1.5 0.30 3.5 10 3 298
② 6.0 1.5 0.30 3.5 10 3 313
③ 6.0 3.5 0.30 3.5 x 3 298
④ 6.0 1.5 0.30 4.5 9 3 298
⑤ 6.0 1.5 0.30 3.5 10 10 298
A.实验①、⑤的目的是探究pH对p﹣CP降解速率的影响
B.实验②、④探究的是其它条件不变时,温度对p﹣CP降解速率的影响
C.实验③中,x=10
D.实验测得温度过高时,降解反应速率减小,可能的原因是H2O2受热分解
二十九.乙酸乙酯的制取(共1小题)
49.(2021春 济南期末)在实验室制备并获得乙酸乙酯粗产品的实验过程中,下列操作未涉及的是( )
A. B.
C. D.
三十.乙醇的催化氧化实验(共1小题)
(多选)50.(2021春 滨州期末)某课外活动小组用如图装置探究乙醇还原性并获得乙醛(夹持装置略),已知乙醛沸点20.8℃。下列叙述错误的是( )
A.甲、丙两装置均采取热水浴
B.实验过程中观察到铜网出现红色和黑色交替的现象
C.实验结束后,丙中试管收集的物质只有乙醛和水
D.若用氧气代替空气时,应适当降低气体的通入速率
三十一.化学实验方案的评价(共7小题)
51.(2021春 日照期末)下列实验操作或做法正确且能达到相应目的的是
选项 操作或做法 目的
A 向NaI溶液中滴入少量氯水和CCl4,振荡、静置 探究I﹣与Cl﹣的还原性
B 向Al2(SO4)3溶液中滴加过量Ba(OH)2溶液 验证Al(OH)3不溶于Ba(OH)2溶液
C 将铝条分别插入稀硫酸和浓硫酸中 探究浓度对反应速率的影响
D 实验结束,将剩余NaCl固体放回原试剂瓶 节约试剂
( )
A.A B.B C.C D.D
52.(2021春 日照期末)下列由实验现象所得结论错误的是( )
A.向浓HNO3中插入红热的炭,产生红棕色气体,证明炭可与浓HNO3反应生成NO2
B.向Na2S溶液中滴加氯水,产生淡黄色沉淀,证明Cl的非金属性强于S
C.向鸡蛋清溶液中加入CuSO4溶液,鸡蛋清凝固,加水不溶解,证明CuSO4能使蛋白质变性
D.向溴的四氯化碳溶液中滴入苯,无明显变化,证明苯分子结构中无碳碳双键
53.(2021秋 南通期末)下列制取并提纯乙酸乙酯的实验操作及装置正确的是( )
A.混合乙醇、乙酸和浓硫酸
B.制取乙酸乙酯
C.分离乙酸乙酯和水溶液
D.分离乙酸乙酯和乙醇
54.(2021春 威海期末)下列实验操作和现象及实验结论均正确的是( )
选项 实验操作和现象 实验结论
A 向浓度均为0.1 mol L﹣1的KCl和KI的混合溶液中滴加少量AgNO3溶液,先出现黄色沉淀 Ksp(AgCl)>Ksp(AgI)
B 向两支盛有2mL不同浓度Na2SO3溶液的试管中同时加入1mL 2%双氧水,观察实验现象 探究浓度对化学反应速率的影响
C 将Na2S2O3溶液与硫酸两种溶液混合后再用水浴加热,观察出现浑浊所用的时间 探究温度对化学反应速率的影响
D 室温用pH试纸测同浓度的NaClO和CH3COONa溶液的pH,pH(NaClO)>pH(CH3COONa) 酸性:HClO>CH3COOH
A.A B.B C.C D.D
(多选)55.(2021春 临沂期末)下列有关实验装置进行的相应实验,能达到实验目的是( )
A.用图1所示装置除去HCl中含有的少量Cl2
B.用图2所示装置验证在光照条件下甲烷与氯气的反应
C.用图3所示装置验证浓硫酸具有脱水性、强氧化性,SO2具有漂白性、还原性
D.用图4所示装置制取并收集干燥纯净的NH3
(多选)56.(2021春 聊城期末)实验探究是化学发展的必要路径。下列各实验的现象及结论都正确的是( )
选项 实验 现象 结论
A 浓硫酸滴入蔗糖中 蔗糖变黑、体积膨胀 浓硫酸具有脱水性
B 铜粉加入稀硫酸中,再加入少量硝酸钾固体 开始无明显现象,加入硝酸钾固体后溶液变蓝 硝酸钾起催化作用
C 向待测液中滴加浓氢氧化钠溶液并加热 产生使湿润蓝色石蕊试纸变红的气体 待测液中含有NH4+
D 向待测溶液中先加入淀粉溶液,再加入过氧化氢溶液 开始无明显现象,加入过氧化氢溶液后溶液变蓝 待测溶液中含有I﹣
A.A B.B C.C D.D
(多选)57.(2021春 高青县期末)“探究与创新能力”是化学的关键能力。下列各项中“操作或现象”能达到预期“实验目的”的是( )
选项 实验目的 操作或现象
A 制作简单原电池 将铁钉和铜丝连接插入食醋中即可形成原电池
B 验证碳能与浓硝酸反应 向浓硝酸中插入红热的碳,产生红棕色气体
C 鉴别溴蒸气和NO2 分别通入AgNO3溶液中,产生浅黄色沉淀的是溴蒸气
D 除去乙酸乙酯中的少量乙酸 加入足量饱和氢氧化钠溶液,充分混合后分液
A.A B.B C.C D.D
中小学教育资源及组卷应用平台
21世纪教育网(www.21cnjy.com)
参考答案与试题解析
一十八.弱电解质在水溶液中的电离平衡(共1小题)
(多选)31.(2021春 威海期末)室温下,在0.1mol L﹣1三元弱酸H3A溶液中,微粒H3A、H2A﹣、HA2﹣、A3﹣的物质的量分数δ(X)随pH的变化如图所示。下列叙述错误的是[已知:δ(X)=]( )
A.反应A3﹣+H2A﹣ 2HA2﹣的平衡常数的值为105.2
B.将KOH溶液逐滴加入到H3A溶液中,反应H2A﹣+OH﹣═HA2﹣+H2O发生的pH范围是4.7~9.8
C.欲用H3A和K2HA配制pH=7.2的缓冲溶液(KH2A和K2HA的混合溶液),则需n(H3A):n(K2HA)=1:2
D.物质的量浓度均为0.1mol L﹣1的KH2A、K2HA混合溶液中:c(K+)>c(HA2﹣)>c(H2A﹣)>c(H+)>c(A3﹣)>c(OH﹣)
【解答】解:H3A的电离平衡常数Ka1=,由图可知,pH=2.2时c(H2A﹣)=c(H3A),此时Ka1=c(H+)=10﹣pH=10﹣2.2,同理可得Ka2=10﹣7.2,Ka3=10﹣12.4,H2A﹣的水解平衡常数Kh3===10﹣11.8<Ka1,则H2A﹣的电离程度大于其水解程度,HA2﹣的水解平衡常数Kh2===10﹣6.8>Ka2,则HA2﹣的电离程度小于其水解程度,所以KH2A溶液呈酸性,K2HA溶液呈碱性,
A.反应A3﹣+H2A﹣ 2HA2﹣的平衡常数K==×===105.2,故A正确;
B.由图可知,pH范围在4.7~9.8之间时,c(H2A﹣)逐渐减小,c(HA2﹣)逐渐增加,即发生H2A﹣+OH﹣═HA2﹣+H2O的反应,故B正确;
C.KH2A溶液呈酸性,K2HA溶液呈碱性,由图可知,物质的量浓度相等的KH2A、K2HA混合溶液中pH=7.2,呈碱性,则HA2﹣水解程度大于H2A﹣的电离程度,若将等物质的量的KH2A、K2HA混合后形成溶液时,因HA2﹣水解程度大于H2A﹣的电离程度,而使n(K2HA)减小、n(KH2A)增加,要使H3A和K2HA配制的缓冲溶液pH=7.2,则n(K2HA)应略大于n(KH2A),H3A+K2HA=2KH2A,即n(H3A):n(K2HA)<1:2,故C错误;
D.H2A﹣的电离常数Ka2=10﹣7.2,HA2﹣的水解平衡常数Kh2=10﹣6.8>Ka2,则HA2﹣水解程度大于H2A﹣的电离程度,即物质的量浓度均为0.1mol L﹣1的KH2A、K2HA混合溶液中c (HA2﹣)减小、c(H2A﹣)增加,溶液呈碱性,c(OH﹣)>c(H+),所以溶液中有:c(K+)>c(H2A﹣)>c(HA2﹣)>c(OH﹣)>c(H+)>c(A3﹣),故D错误;
故选:CD。
一十九.难溶电解质的溶解平衡及沉淀转化的本质(共1小题)
32.(2021春 威海期末)一定温度下,BaSO4(s) Ba2+(aq)+SO42﹣(aq)平衡体系中,c(Ba2+)和c(SO42﹣)的关系如图所示。下列说法正确的是( )
A.a、b、c三点对应的KW不相等
B.a、b、c三点对应c(Ba2+) c(SO42﹣)的数值,a点最大
C.BaSO4在水中形成的饱和溶液,c(Ba2+)=c(SO42﹣)
D.a点对应的溶液中加入BaSO4固体,c(Ba2+)沿曲线向b、c点方向变化
【解答】解:A.水的离子积与温度有关,温度不变,则a、b、c三点对应的KW相等,故A错误;
B.曲线上点均为溶解平衡点,温度相同,且Ksp=c(Ba2+) c(SO42﹣),则a、b、c三点对应c(Ba2+) c(SO42﹣)的数值相等,故B错误;
C.BaSO4在水中形成的饱和溶液,存在BaSO4(s) Ba2+(aq)+SO42﹣(aq),可知c(Ba2+)=c(SO42﹣),故C正确;
D.a点为溶解平衡点,a点对应的溶液中加入BaSO4固体,溶解平衡不移动,则c(Ba2+)不变,不能沿着曲线变化,故D错误;
故选:C。
二十.海水资源及其综合利用(共3小题)
33.(2021春 济宁期末)下列物质的获得与海水资源开发利用无关的是( )
A.NaCl B.CuSO4 C.MgCl2 D.Br2
【解答】解:A.海水中含大量NaCl,海水晒盐后可提纯分离出NaCl,故A正确;
B.海水中不能获得CuSO4,故B错误;
C.海水中含镁离子,可沉淀后,盐酸溶解得到氯化镁,故C正确;
D.海水中含溴离子,可浓缩、氧化后萃取分离出溴,故D正确;
故选:B。
(多选)34.(2021春 聊城期末)海洋中部分化学资源的利用,如图所示,下列说法错误的是( )
A.步骤①、②利用了Cl2的氧化性,热空气吹出利用了溴的挥发性
B.物质X常选用SO2,Y常选用生石灰
C.工业上常用热还原法冶炼金属镁
D.“氯化”过程中发生的反应为MgO+C+Cl2MgCl2+CO
【解答】A.步骤①、②利用氯气的氧化性,氧化溴离子生成溴单质,利用溴易挥发的性质,可用热空气吹出,故A正确;
B.一般选用二氧化硫溶液,可将溴单质还原为溴离子富集溴,因此Y常选用二氧化硫,可增大溴单质的吸收量,氢氧化钙可与镁离子反应生成氢氧化镁沉淀,石灰乳来源广且价格便宜,因而沉镁过程一般选用石灰乳,故B错误;
C.金属镁化学性质比较活泼,工业上一般使用电解法电解熔融状态下的氯化镁来制备镁单质,故C错误;
D.氯化过程氧化镁、碳、氯气发生反应生成氯化镁和一氧化碳,化学方程式为:MgO+C+Cl2MgCl2+CO,故D正确;
故选:BC。
(多选)35.(2021春 高青县期末)侯德榜改进的制碱工艺打破了西方对我国的技术封锁,至今仍在使用。工业上从海水中制备纯碱和金属镁的流程如图所示:
下列说法不正确的是( )
A.流程Ⅰ依次向粗盐水中加入过量Ca(OH)2 溶液、Na2CO3溶液并过滤
B.流程Ⅱ体现了侯德榜制碱法
C.流程Ⅱ中吸氨与碳酸化的顺序互换,物质不变、不影响反应结果
D.流程Ⅳ、Ⅴ的目的是富集镁元素
【解答】解:A.流程Ⅰ依次向粗盐水中加入过量Ca(OH)2溶液、Na2CO3溶液并过滤,且碳酸钠可除去过量的氢氧化钙,故A正确;
B.二氧化碳在水中溶解度不大,则流程Ⅱ吸氨是使溶液呈碱性,有利于吸收二氧化碳,流程Ⅱ、流程Ⅲ体现了侯德榜制碱法,故B错误;
C.流程Ⅱ中吸氨与碳酸化的顺序互换,二氧化碳在水中溶解度不大,生成碳酸氢钠的量减少,影响反应结果,故C错误;
D.通过流程Ⅳ、Ⅴ的反应,增大氯化镁的浓度,可富集镁元素,故D正确;
故选:BC。
二十一.铁的化学性质(共2小题)
36.(2021春 日照期末)部分含铁物质的分类与相应化合价的关系如图所示。下列说法错误的是( )
A.a可与e反应生成b
B.c在空气中可转化为d
C.可用KSCN溶液鉴别b、e
D.可存在a→e→d→c→b→a的循环转化关系
【解答】解:A.若b为氯化亚铁,e为氯化铁,Fe与氯化铁反应生成氯化亚铁,故A正确;
B.氢氧化亚铁、氧气、水反应生成氢氧化铁,故B正确;
C.铁离子遇KSCN变为血红色,则可用KSCN溶液鉴别b、e,故C正确;
D.d→c的转化不能实现,故D错误;
故选:D。
37.(2021春 青岛期末)如表各组物质中,物质之间不可能实现如图所示转化的是( )
选项 X Y Z M
A NH3 NO NO2 O2
B NaOH Na2CO3 NaHCO3 CO2
C Fe FeCl2 FeCl3 Cl2
D C CO CO2 H2O
A.A B.B C.C D.D
【解答】解:A.氨气与氧气反应生成NO,NO与氧气反应生成二氧化氮,符合图中转化,故A正确;
B.NaOH与少量二氧化碳反应生成碳酸钠,碳酸钠与二氧化碳反应生成碳酸氢钠,符合图中转化,故B正确;
C.M为氯气时,都生成三氯化铁,反应与量无关,不符合图中转化,故C错误;
D.碳和水高温生成一氧化碳,一氧化碳与水高温生成二氧化碳,可实现转化,故D正确;
故选:C。
二十二.有机物的推断(共1小题)
(多选)38.(2021春 菏泽期末)乙酸乙酯有四种常见的合成方法。已知A是一种单糖,广泛存在于带甜味的水果中,B是一种生活中常见的含氧有机物且相对分子质量为46,E是一种石油裂解产物,能作水果的催熟剂。它们之间的转化关系如图所示。下列说法正确的是( )
A.有机物A能使碘水变蓝
B.反应④和⑥的反应类型为加成反应
C.B、D和乙酸乙酯都是挥发性无色液体,可以通过气味不同进行区别
D.反应②的化学方程式为2CH3CH2OHCH3COOCH2CH3+2H2O
【解答】解:A.通过以上分析知,A为葡萄糖,淀粉遇碘水变蓝色,葡萄糖遇碘水不变蓝色,故A错误;
B.乙醛和乙醛发生加成反应生成乙酸乙酯、乙酸和乙烯发生加成反应生成乙酸乙酯,所以反应④和⑥的反应类型为加成反应,故B正确;
C.B是乙醇、D是乙酸,乙醇是无色、有特殊香味的液体,乙酸是有强烈刺激性气味的无色液体,乙酸乙酯具有果香味,所以可以通过气味不同进行区别,故C正确;
D.根据原子守恒知,反应②的化学方程式为2CH3CH2OHCH3COOCH2CH3+2H2,故D错误;
故选:BC。
二十三.有机物的结构和性质(共4小题)
39.(2021春 菏泽期末)某有机物的结构简式如图所示。下列说法错误的是( )
A.分子式是C12H14O4
B.能使酸性KMnO4溶液褪色
C.能与乙醇或乙酸发生酯化反应
D.与1mol该有机物最多能反应的Na和NaHCO3的物质的量之比为2:1
【解答】解:A.由结构可知分子式是C12H14O4,故A正确;
B.含碳碳双键、羟基,均能使酸性KMnO4溶液褪色,故B正确;
C.含羟基可与乙酸发生酯化反应,含羧酸可与乙醇发生酯化反应,故C正确;
D.Na与羟基、羧基反应,只有羧基与碳酸氢钠反应,则与1mol该有机物最多能反应的Na和NaHCO3的物质的量之比为3:1,故D错误;
故选:D。
40.(2021春 济南期末)阿司匹林是影响人类历史进程和走向的化学药品,其化学名称为乙酰水杨酸(结构如图),下列关于乙酰水杨酸的说法正确的是( )
A.分子式为C9H10O4
B.能与乙醇发生酯化反应
C.分子中含有3种官能团
D.1mol乙酰水杨酸与足量的Na反应生成11.2LH2
【解答】解:A.由结构可知分子式为C9H8O4,故A错误;
B.含羧基,能与乙醇发生酯化反应,故B正确;
C.含羧基、酯基,共2种官能团,故C错误;
D.只有﹣COOH与Na反应,则1mol乙酰水杨酸与足量的Na反应生成0.5molH2,状况未知,不能计算其体积,故D错误;
故选:B。
(多选)41.(2021春 菏泽期末)已知异丁醇和叔丁醇的结构简式如图,下列说法错误的是( )
A.两种醇互为同分异构体
B.叔丁醇中所有的碳原子一定不在同一个平面上
C.两种醇与乙酸发生酯化反应后得到的酯相同
D.100mL 0.1mol L﹣1异丁醇溶液与足量Na反应生成112mL H2(标况)
【解答】解:A.异丁醇和叔丁醇的分子式相同,但羟基位置不同,二者互为同分异构体,故A正确;
B.连接羟基、3个甲基的碳原子处于四面体内部,叔丁醇中所有的碳原子一定不在同一个平面上,故B错误;
C.异丁醇和叔丁醇互为同分异构体,两种醇与乙酸发生酯化反应后得到的酯不相同,故C错误;
D.溶液中水也Na反应生成氢气,故D错误。
故选:CD。
(多选)42.(2021春 高青县期末)“结构决定性质”是重要的化学观念。昆虫信息素是昆虫之间传递信号的化学物质。人工合成信息素可用于诱捕害虫、测报虫情等。一种信息素的分子结构简式如图所示,关于该化合物说法不正确的是( )
A.所有碳原子可能共平面 B.分子式是C12H18O2
C.可发生加成反应 D.有两个官能团
【解答】解:A.含有多个饱和碳原子,具有甲烷的结构特征,则所有的碳原子不可能共平面,故A错误;
B.由结构简式可知有机物分子式是C12H20O2,故B错误;
C.含有碳碳双键,具有烯烃的性质,可发生加成反应,故C正确;
D.含有碳碳双键和酯基,则含有两个官能团,故D正确;
故选:AB。
二十四.物质分离和提纯的方法和基本操作综合应用(共2小题)
43.(2021春 济南期末)绿原酸(C16H18O9)是一种有机弱酸,金银花的水浸取液经下列操作可获得绿原酸粗品。下列说法错误的是( )
A.该流程中乙酸乙酯可循环利用
B.萃取振荡时,分液漏斗下口应倾斜向上
C.分液时,应先从分液漏斗的下口放出下层液体,然后再放出上层液体
D.蒸馏时选用直形冷凝管,且冷凝水从下口进,上口出
【解答】解:A.有机层减压蒸馏分离出乙酸乙酯可用于萃取,可循环使用,故A正确;
B.萃取振荡时,分液漏斗下口应倾斜向上,便于放气,充分混合萃取,故B正确;
C.乙酸乙酯的密度小于水,萃取分液时,水层在下方,则分液时,应先打开分液漏斗顶塞,再打开旋塞,使水层从分液漏斗下口放出,然后从上口倒出有机层,故C错误;
D.蒸馏时选用直形冷凝管,不残留馏分,且冷凝水从下口进上口出可充满冷凝管,冷凝效果好,故D正确;
故选:C。
(多选)44.(2021春 济南期末)某研究性学习小组从腐蚀印刷电路板的废液(含有FeCl2、FeCl3、CuCl2)中回收铜并制备氯化铁晶体,设计流程如图。下列说法正确的是( )
A.试剂a是铁粉、试剂b是稀硫酸
B.操作Ⅰ、Ⅱ、Ⅲ都用到玻璃棒
C.操作Ⅲ包含的步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D.可用KSCN溶液和新制氯水检验溶液W中是否含有Fe2+
【解答】解:A.由分析知试剂b为HCl,若用硫酸,则会引入杂质,故A错误;
B.操作Ⅰ、Ⅱ为过滤,需用玻璃棒引流液体,操作Ⅲ涉及蒸发操作,需用玻璃棒搅拌,防止液体飞溅,故B正确;
C.由氯化铁溶液得到氯化铁晶体,可知操作Ⅲ包含的步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故C正确;
D.溶液W中含Fe3+,干扰亚铁离子的检验,则用KSCN溶液和新制氯水不能检验溶液W 中是否含有Fe2+,故D错误;
故选:BC。
二十五.物质的分离、提纯和除杂(共1小题)
45.(2021春 济宁期末)如图装置所示,下列有关说法错误的是( )
A.若X溶液为溴水可除去SO2气体中少量的CO2
B.若X溶液为饱和食盐水可除去氯气中少量的氯化氢
C.若X溶液为氢氧化钠溶液可除去氮气中少量的二氧化氮
D.若X溶液为酸性高锰酸钾可鉴别丙烷和丙烯
【解答】解:A.二氧化硫与溴水反应,将原物质除去,不能除杂,故A错误;
B.HCl极易溶于水,食盐水可抑制氯气的溶解,洗气可分离,故B正确;
C.二氧化氮与NaOH溶液反应,氮气不能,洗气可分离,故C正确;
D.丙烯可被酸性高锰酸钾氧化,丙烷不能,现象不同,可鉴别,故D正确;
故选:A。
二十六.实验装置综合(共1小题)
46.(2021春 高青县期末)喷泉实验装置如图所示。下列说法不正确的是( )
A.CO2和NaOH溶液组合也能形成喷泉现象
B.NO2、HCl 跟水形成喷泉后所得溶液的浓度相同
C.此装置形成喷泉的前提是让气体与水或溶液充分接触
D.无胶头滴管则无法引发喷泉实验
【解答】解:A.二氧化碳被氢氧化钠溶液吸收,圆底烧瓶中气体压强减小,形成喷泉,故A正确;
B.HCl 跟水形成喷泉后,设烧瓶的体积是VL,标准状况下n(HCl)==mol,c===mol/L,NO2跟水形成喷泉后3NO2+H2O=2HNO3+NO,从方程式可以看出,有1/3的NO生成,体积上升2/3,n(HNO3)=×=×mol,c===mol/L,故NO2、HCl 跟水形成喷泉后所得溶液的浓度相同,故B正确;
C.让气体与水或溶液充分接触,烧瓶中气体压强减小,外界大气压将烧杯中液体压入圆底烧瓶形成喷泉,故C正确;
D.无胶头滴管,可以通过热毛巾捂住圆底烧瓶,圆底烧瓶内气体压强增大,与烧杯中水或溶液接触引发喷泉,故D错误;
故选:D。
二十七.中和滴定(共1小题)
(多选)47.(2021春 威海期末)实验室用0.01mol L﹣1 KOH标准溶液测定一元弱酸叠氮酸(HN3)的浓度。下列叙述错误的是( )
A.可选用酚酞做指示剂
B.开始平视,滴定终点仰视,测定结果偏低
C.KN3溶液呈碱性,其原因是:N3﹣+H2O HN3+OH﹣
D.滴定终点的溶液中:c(K+ )=c(N3﹣)+c(HN3)﹣c(H+)
【解答】解:A.KOH标准溶液滴定叠氮酸溶液,达到滴定终点时生成弱酸强碱盐KN3,溶液呈碱性,应该选择酚酞作指示剂,故A正确;
B.开始平视,滴定终点仰视,导致标准液的体积读数偏大,由c(待测)=可知,c(待测)偏高,故B错误;
C.KN3是弱酸强碱盐,N3﹣水解使溶液呈碱性,水解方程式为N3﹣+H2O HN3+OH﹣,故C正确;
D.滴定终点生成KN3,物料守恒关系为c(K+ )=c(N3﹣)+c(HN3),则(K+ )>c(N3﹣)+c(HN3)﹣c(H+),故D错误;
故选:BD。
二十八.探究影响化学反应速率的因素(共1小题)
(多选)48.(2021春 滨州期末)Fenton法常用于处理含难降解有机物p﹣CP的工业废水,在调节好pH和Fe2+浓度的废水中加入H2O2,使产生的羟基自由基氧化降解污染物p﹣CP。控制p﹣CP的初始浓度相同,其余实验条件见下表,探究有关因素对该降解反应速率的影响。下列说法正确的是( )
实验编号 H2O2溶液 Fe2+溶液 蒸馏水 pH 温度
c/(10﹣3mol L﹣1) V/mL c/(10﹣3mol L﹣1) V/mL V/mL T/K
① 6.0 1.5 0.30 3.5 10 3 298
② 6.0 1.5 0.30 3.5 10 3 313
③ 6.0 3.5 0.30 3.5 x 3 298
④ 6.0 1.5 0.30 4.5 9 3 298
⑤ 6.0 1.5 0.30 3.5 10 10 298
A.实验①、⑤的目的是探究pH对p﹣CP降解速率的影响
B.实验②、④探究的是其它条件不变时,温度对p﹣CP降解速率的影响
C.实验③中,x=10
D.实验测得温度过高时,降解反应速率减小,可能的原因是H2O2受热分解
【解答】解:A.实验①、⑤只有溶液的pH不同,其他数值均相同,则实验①、⑤的目的是探究pH对p﹣CP降解速率的影响,故A正确;
B.实验②、④中有两个变量:温度不同、Fe2+溶液浓度不同,不能探究温度对p﹣CP降解速率的影响,探究温度对p﹣CP降解速率影响的是实验①、②,故B错误;
C.实验①、③的目的是探究H2O2溶液浓度对p﹣CP降解速率的影响,溶液的总体积为15mL,则x=15﹣3.5﹣3.5=8,故C错误;
D.H2O2不稳定、受热易发生分解,所以实验测得温度过高时,降解反应速率减小,故D正确;
故选:AD。
二十九.乙酸乙酯的制取(共1小题)
49.(2021春 济南期末)在实验室制备并获得乙酸乙酯粗产品的实验过程中,下列操作未涉及的是( )
A. B.
C. D.
【解答】解:A.乙醇、乙酸发生酯化反应生成乙酸乙酯,需浓硫酸作催化剂、吸水剂,图中加热装置可制备乙酸乙酯,故A正确;
B.饱和碳酸钠可吸收乙醇、除去乙酸、降低酯的溶解度,图中饱和碳酸钠溶液可用于提纯,故B正确;
C.乙酸乙酯与水溶液分层,可选图中装置分离出乙酸乙酯,故C正确;
D.图中为过滤装置,乙酸乙酯的制备、提纯中不涉及过滤操作,故D错误;
故选:D。
三十.乙醇的催化氧化实验(共1小题)
(多选)50.(2021春 滨州期末)某课外活动小组用如图装置探究乙醇还原性并获得乙醛(夹持装置略),已知乙醛沸点20.8℃。下列叙述错误的是( )
A.甲、丙两装置均采取热水浴
B.实验过程中观察到铜网出现红色和黑色交替的现象
C.实验结束后,丙中试管收集的物质只有乙醛和水
D.若用氧气代替空气时,应适当降低气体的通入速率
【解答】解:A.甲的烧杯中的水起加热乙醇的作用,使乙醇形成蒸气挥发,丙的烧杯中的水有冷凝乙醛作用,使乙醛蒸气冷却,则甲烧杯中盛装热水,丙烧杯中盛装冷水,故A错误;
B.反应中铜被氧化生成氧化铜,颜色由红变黑,氧化铜与乙醇反应生成铜,颜色由黑变红,即实验过程中铜丝出现红、黑颜色交替变化的现象,故B正确;
C.乙醛还可能被氧化为乙酸,所以丙中试管中收集到的液体中有乙醇、乙醛、水和乙酸,故C错误;
D.乙醛易被氧化为乙酸,为防止生成的乙醛被氧化成乙酸,适当降低纯氧的通入速率,故D正确;
故选:AC。
三十一.化学实验方案的评价(共7小题)
51.(2021春 日照期末)下列实验操作或做法正确且能达到相应目的的是
选项 操作或做法 目的
A 向NaI溶液中滴入少量氯水和CCl4,振荡、静置 探究I﹣与Cl﹣的还原性
B 向Al2(SO4)3溶液中滴加过量Ba(OH)2溶液 验证Al(OH)3不溶于Ba(OH)2溶液
C 将铝条分别插入稀硫酸和浓硫酸中 探究浓度对反应速率的影响
D 实验结束,将剩余NaCl固体放回原试剂瓶 节约试剂
( )
A.A B.B C.C D.D
【解答】解:A.氯气与NaI反应生成碘,碘易溶于四氯化碳,由操作和现象可探究I﹣与Cl﹣的还原性,故A正确;
B.Al2(SO4)3溶液中滴加过量Ba(OH)2溶液,生成硫酸钡白色沉淀,而Al(OH)3溶于Ba(OH)2溶液,故B错误;
C.常温变Al遇浓硫酸发生钝化,由操作和现象不能探究浓度对速率的影响,故C错误;
D.一般剩余的试剂不能放回原瓶,防止试剂污染,则剩余NaCl固体不能放回原试剂瓶,故D错误;
故选:A。
52.(2021春 日照期末)下列由实验现象所得结论错误的是( )
A.向浓HNO3中插入红热的炭,产生红棕色气体,证明炭可与浓HNO3反应生成NO2
B.向Na2S溶液中滴加氯水,产生淡黄色沉淀,证明Cl的非金属性强于S
C.向鸡蛋清溶液中加入CuSO4溶液,鸡蛋清凝固,加水不溶解,证明CuSO4能使蛋白质变性
D.向溴的四氯化碳溶液中滴入苯,无明显变化,证明苯分子结构中无碳碳双键
【解答】解:A.浓硝酸受热分解生成二氧化氮,则向浓HNO3中插入红热的炭,产生红棕色气体,不能证明炭可与浓HNO3反应生成NO2,故A错误;
B.氯水与硫化钠反应生成S,则产生淡黄色沉淀,证明Cl的非金属性强于S,故B正确;
C.鸡蛋清溶液中加入CuSO4溶液,发生变性,则鸡蛋清凝固,加水不溶解,故C正确;
D.苯与溴不能发生加成反应,则向溴的四氯化碳溶液中滴入苯,无明显变化,证明苯分子结构中无碳碳双键,故D正确;
故选:A。
53.(2021秋 南通期末)下列制取并提纯乙酸乙酯的实验操作及装置正确的是( )
A.混合乙醇、乙酸和浓硫酸
B.制取乙酸乙酯
C.分离乙酸乙酯和水溶液
D.分离乙酸乙酯和乙醇
【解答】解:A.混合乙醇、乙酸和浓硫酸的方法是:先加乙醇再加浓硫酸最后加乙酸,图示操作方法不合理,故A错误;
B.收集乙酸乙酯的导管不能插入饱和碳酸钠溶液,否则易发生倒吸现象,图示装置不合理,故B错误;
C.乙酸乙酯与水分层,有机层在上层,水在下层,图示实验操作及装置均合理,故C正确;
D.温度计用于测量馏分温度,应该放在蒸馏烧瓶的支管口处,图示温度计的水银球位置不合理,故D错误;
故选:C。
54.(2021春 威海期末)下列实验操作和现象及实验结论均正确的是( )
选项 实验操作和现象 实验结论
A 向浓度均为0.1 mol L﹣1的KCl和KI的混合溶液中滴加少量AgNO3溶液,先出现黄色沉淀 Ksp(AgCl)>Ksp(AgI)
B 向两支盛有2mL不同浓度Na2SO3溶液的试管中同时加入1mL 2%双氧水,观察实验现象 探究浓度对化学反应速率的影响
C 将Na2S2O3溶液与硫酸两种溶液混合后再用水浴加热,观察出现浑浊所用的时间 探究温度对化学反应速率的影响
D 室温用pH试纸测同浓度的NaClO和CH3COONa溶液的pH,pH(NaClO)>pH(CH3COONa) 酸性:HClO>CH3COOH
A.A B.B C.C D.D
【解答】解:A.浓度均为0.1 mol L﹣1的KCl和KI的混合溶液中滴加少量AgNO3溶液,Ksp小的先沉淀,先出现黄色沉淀,可知Ksp(AgCl)>Ksp(AgI),故A正确;
B.过氧化氢与亚硫酸钠反应生成硫酸钠、水,无明显现象,不能探究浓度对速率的影响,故B错误;
C.混合后再用水浴加热,温度相同,应将混合物分别在热水、冷水中反应来探究温度对反应速率的影响,故C错误;
D.NaClO溶液可使pH试纸褪色,应选pH计测定等浓度盐溶液的pH来比较对应酸的酸性,故D错误;
故选:A。
(多选)55.(2021春 临沂期末)下列有关实验装置进行的相应实验,能达到实验目的是( )
A.用图1所示装置除去HCl中含有的少量Cl2
B.用图2所示装置验证在光照条件下甲烷与氯气的反应
C.用图3所示装置验证浓硫酸具有脱水性、强氧化性,SO2具有漂白性、还原性
D.用图4所示装置制取并收集干燥纯净的NH3
【解答】解:A.HCl极易溶于水,食盐水抑制氯气的溶解,将原物质除去,不能除杂,故A错误;
B.光照下发生取代反应生成HCl,HCl极易溶于水,观察黄绿色气体消失、液面上升可证明,故B正确;
C.浓硫酸使蔗糖脱水后,C与浓硫酸反应生成二氧化碳、二氧化硫,二氧化硫可使品红褪色、可被酸性高锰酸钾氧化,可验证浓硫酸具有脱水性、强氧化性,SO2具有漂白性、还原性,故C正确;
D.氨气的密度比空气密度小,图中收集方法不合理,故D错误;
故选:BC。
(多选)56.(2021春 聊城期末)实验探究是化学发展的必要路径。下列各实验的现象及结论都正确的是( )
选项 实验 现象 结论
A 浓硫酸滴入蔗糖中 蔗糖变黑、体积膨胀 浓硫酸具有脱水性
B 铜粉加入稀硫酸中,再加入少量硝酸钾固体 开始无明显现象,加入硝酸钾固体后溶液变蓝 硝酸钾起催化作用
C 向待测液中滴加浓氢氧化钠溶液并加热 产生使湿润蓝色石蕊试纸变红的气体 待测液中含有NH4+
D 向待测溶液中先加入淀粉溶液,再加入过氧化氢溶液 开始无明显现象,加入过氧化氢溶液后溶液变蓝 待测溶液中含有I﹣
A.A B.B C.C D.D
【解答】解:A.蔗糖变黑与浓硫酸的脱水性有关,体积膨胀,说明生成气体,浓硫酸与碳反应生成二氧化碳、二氧化硫等气体,与浓硫酸的强氧化性有关,故A错误;
B.酸性条件下,硝酸根离子具有强氧化性,可氧化铜生成铜离子,溶液变蓝色,反应中硝酸钾起到氧化剂的作用,故B错误;
C.能使湿润蓝色石蕊试纸变红的气体为氨气,则向待测液中滴加浓氢氧化钠溶液并加热,产生使湿润蓝色石蕊试纸变红的气体,可说明待测液中含有NH4+,故C正确;
D.加入淀粉,溶液变蓝色,应生成碘单质,则可说明待测溶液中含有I﹣,故D正确;
故选:CD。
(多选)57.(2021春 高青县期末)“探究与创新能力”是化学的关键能力。下列各项中“操作或现象”能达到预期“实验目的”的是( )
选项 实验目的 操作或现象
A 制作简单原电池 将铁钉和铜丝连接插入食醋中即可形成原电池
B 验证碳能与浓硝酸反应 向浓硝酸中插入红热的碳,产生红棕色气体
C 鉴别溴蒸气和NO2 分别通入AgNO3溶液中,产生浅黄色沉淀的是溴蒸气
D 除去乙酸乙酯中的少量乙酸 加入足量饱和氢氧化钠溶液,充分混合后分液
A.A B.B C.C D.D
【解答】解:A.将铁钉和铜丝连接插入食醋中,铁为负极,铜为正极,乙酸为电解质,可形成原电池,故A正确;
B.浓硝酸受热分解生成二氧化氮,则向浓HNO3中插入红热的炭,产生红棕色气体,不能证明炭可与浓HNO3反应生成NO2,故B错误;
C.溴与硝酸银反应生成淡黄色沉淀,二氧化氮与水反应后溶液为无色,现象不同可鉴别,故C正确;
D.乙酸乙酯溶于氢氧化钠溶液,不能用氢氧化钠溶液除去乙酸乙酯中的少量乙酸,应该选用饱和碳酸钠溶液,故D错误;
中小学教育资源及组卷应用平台
故选:AC。21世纪教育网(www.21cnjy.com)
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
