6.2化学反应的速率与反应限度教案—2021-2022学年高一下学期化学人教版(2019)必修第二册(Word版)
文档属性
| 名称 | 6.2化学反应的速率与反应限度教案—2021-2022学年高一下学期化学人教版(2019)必修第二册(Word版) |

|
|
| 格式 | zip | ||
| 文件大小 | 114.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-18 18:35:09 | ||
图片预览


文档简介
化学反应速率与反应限度
【教学目标】
1.知道化学反应速率和反应限度概念
2.知道化学反应限度的本质原因及外部特征
3.了解影响化学反应速率和反应限度的因素
【教学重难点】
化学反应速率和反应限度概念;了解影响化学反应速率和反应限度的因素。
化学反应限度的本质原因及外部特征
【教学过程】
【第一课时】
[引言]在前面两节中,我们着重探讨化学能向其他形式的能量(如热能和电能)的转化,并指出化学反应中的物质变化及伴随发生的能量变化是化学反应的两大基本特征。今天我们则要从另一个角度研究化学反应,探讨人类面对具体的化学反应要考虑的两个基本问题:外界条件对化学反应速率和反应限度的影响。人类如何利用和控制化学反应,如提高燃料的利用率,必须了解这些问题。
[新课]第一节化学反应的速率和限度
一、化学反应的速率
日常生活中的化学变化有快有慢。有的反应瞬间完成,如爆炸;有的化学反应要经历几万年以上,如化石燃料的形成和溶洞的形成;有的反应在高温条件下变化快,在低温的条件下变化慢,如食品的变质;还有的反应在干燥的环境中变化慢,在潮湿的环境下变化快,如钢铁的锈蚀。人们在实验室进行化学反应时,常常采用粉碎反应物以增大其接触面积,或将固体反应物溶于水中以提高其接触机会,或加入催化剂等措施来提高化学应速率。
我们知道汽车运行时有一定的速度,我们可以用Km/min来表示。那么化学反应速率又用什么来表示?
反应速率的概念:
表示化学反应进行快慢的物理量。(与物理上的速度加以区别)
反应速率的表示方法:
常依据反应物的消失(单位时间内反应物浓度的减小)或生成物的产生(单位时间内生成物浓度的增大)来表示。
单位:mol/L。min或mol/(L·S)V=△c/△t
△c:表示物质的量浓度的变化量。
△t:表示时间的变化量
例题分析:
在一个容积为5L的密闭容器中进行可逆反应:
4NH3(气)+5O2(气)4NO(气)+6H2O(气),3OS后,NO的物质的量增加了0.3mol,则此反应的平均速率x为()
A.VO2=0.01mol/(L·S)B.VNO=0.008mol/(L·S)
C.VH2O=0.003mol/(L·S)D.VNH3=0.002mol/(L·S)
分析:根据化学反应速率的概念,可先求出以NO的浓度变化表示的平均速率,然后依据化学方程式的系数关系再换算成其它反应物或生成物的平均速率。
即:VNO==0.002mol/(L·S)
则:VNH3=VNO=0.002mol/(L·S)
VO2=0.002mol/(L·S)×4/5=0.0025mol/(L·S)
VH2O=0.002mol(L·S)×4/6=0.003mol/(L·S)
答案:C.D.
3.影响化学反应速率的因素
(1)反应原理探究
实验题目 双氧水分解反应
实验步骤 在一支试管中加入2~3mL约5%的H2O2,然后滴加1~2滴1mol/L的FeCl3溶液 待试管中产生大量气泡时,用带火星的火柴梗检验产生的气体
实验现象 有大量气泡产生 木条复燃
用化学方程式解释实验现象 2H2O2=2H2O+O2↑
思考问题 寻找答案 1.通过观察什么现象来判断该反应进行得快慢? 2.还有哪些其他办法观察该化学反应速率?
列出你对 问题的 想法
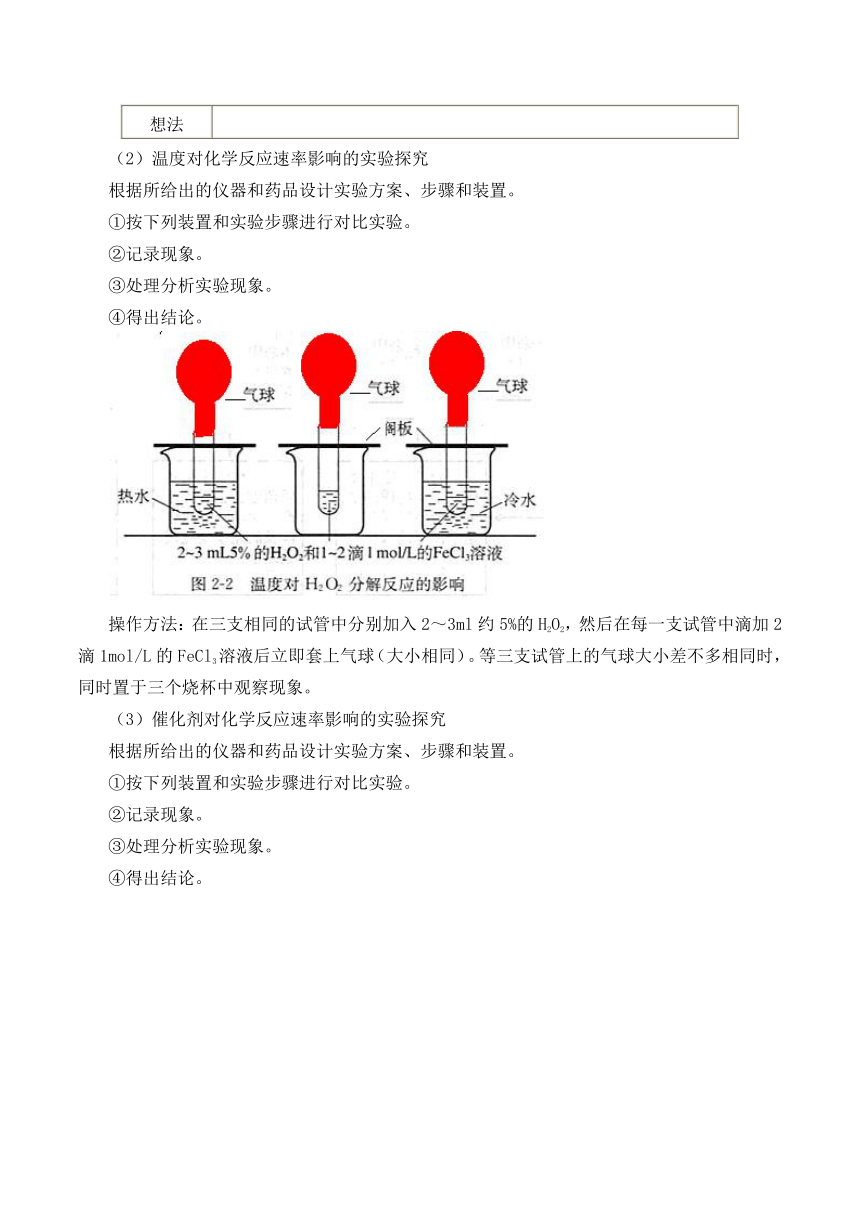
(2)温度对化学反应速率影响的实验探究
根据所给出的仪器和药品设计实验方案、步骤和装置。
①按下列装置和实验步骤进行对比实验。
②记录现象。
③处理分析实验现象。
④得出结论。
操作方法:在三支相同的试管中分别加入2~3ml约5%的H2O2,然后在每一支试管中滴加2滴1mol/L的FeCl3溶液后立即套上气球(大小相同)。等三支试管上的气球大小差不多相同时,同时置于三个烧杯中观察现象。
(3)催化剂对化学反应速率影响的实验探究
根据所给出的仪器和药品设计实验方案、步骤和装置。
①按下列装置和实验步骤进行对比实验。
②记录现象。
③处理分析实验现象。
④得出结论。
操作方法:在三个相同的带活塞的漏斗中分别加入2~3mL约5%的H2O2,然后在一支试管中滴加2滴1mol/L的FeCl3溶液,另一支试管中加入少量MnO2固体。同时向三支试管中放入漏斗中的全部溶液,观察红墨水上升情况。
4.总结影响化学反应速率的因素:温度、固体表面积、反应物的状态、溶液浓度、催化剂都是影响化学反应速率的因素。
[课堂练习]
1.在一个容积为5L的密闭容器中进行可逆反应:
4NH3(气)+5O2(气)===4NO(气)+6H2O(气),3OS后,NO的物质的量增加了0.3mol,则此反应的平均速率x为()
A.VO2=0.01mol/L(L·S)B.VNO=0.008mol/(L·S)
C.VH2O=0.003mol/(L·S)D.VNH3=0.002mol/(L·S)
2.把镁条投入盛有盐酸的敞口容器中,产生H2的速率可用下图表示,在下列因素中:①盐的浓度②镁条的表面积③溶液的温度④氯离子的浓度,影响反应速率的因素是()
(A)①④(B)③④
(C)①②③(D)①②③④
【第二课时】
[引言]上节课我们学习了有关化学反应速率问题,我们现在知道了,对于同一个化学反应,条件不同,反应速率不同。我们来回忆一下:什么是化学反应速率?化学反应速率的表示方法是什么?影响化学反应速率的因素有哪些?那么对于现实生产生活中,一个反应仅仅控制反应的速率是否就可以了呢?我们现实生活中一个简单的例子在冬天取暖的煤炉中煤炭怎样来让它发挥最大限度释放出最多的热能?这就是我们今天研究的课题—化学反应的限度问题。
[新课]第三节化学反应的速率和限度
一、化学反应的限度
为了引进这个限度的概念,我们先看这样的一个试验
实验2-7
实验步骤 向3~4mL1mol/L的CaCl2溶液中滴入1mol/L的Na2SO4溶液
实验现象 白色混浊
化学方程式 CaCl2+Na2SO4=CaSO4↓+2NaCl
离子方程式 Ca2++SO42-=CaSO4↓
小组讨论 交流 向上述反应后的清液中滴入适量1mol/L的Na2CO3溶液会出现什么现象
对于实验现象 提出的假设, 说明理由 假设:仍有白色混浊现象 理由:反应没有完全进行到底
实验证明 你的假设 现象:仍有白色混浊现象
化学方程式 CaCl2+Na2CO3=CaCO3↓+2NaCl
离子方程式 Ca2++CO32-=CaC03↓
解释 反应没有按着方程式剂量系数关系进行到底
以上实验说明了化学反应的限度问题
概念:化学反应的限度:在一定条件下,可逆反应中正反应速率与逆反应速率相等,反应混合物中各组成成分的含量保持不变,达到表面静止的一种“平衡状态”。
特征:处于密闭体系的可逆反应,化学平衡状态建立的条件是正反应速率和逆反应速率相等。即v(正)=v(逆)≠0.这是可逆反应达到平衡状态的重要标志。
影响因素:浓度、温度、气象反应的压强(将在以后的选修教材中详细讲解)
过渡:通过我们前边对化学法案应速率即限度的了解,对于现实生产生活的实际问题,如何来控制反应的速率和限度,是一个理论和实践的交汇点,下面我们来通过一些事例加以讨论。
二、化学反应条件的控制
事例一:定向爆破
事例二:怎样让燃煤充分燃烧
事例三:食品保鲜防腐
事例四:工业合成氨的条件(简单说明)
学生讨论总结:
教师归纳提出见解
【教学目标】
1.知道化学反应速率和反应限度概念
2.知道化学反应限度的本质原因及外部特征
3.了解影响化学反应速率和反应限度的因素
【教学重难点】
化学反应速率和反应限度概念;了解影响化学反应速率和反应限度的因素。
化学反应限度的本质原因及外部特征
【教学过程】
【第一课时】
[引言]在前面两节中,我们着重探讨化学能向其他形式的能量(如热能和电能)的转化,并指出化学反应中的物质变化及伴随发生的能量变化是化学反应的两大基本特征。今天我们则要从另一个角度研究化学反应,探讨人类面对具体的化学反应要考虑的两个基本问题:外界条件对化学反应速率和反应限度的影响。人类如何利用和控制化学反应,如提高燃料的利用率,必须了解这些问题。
[新课]第一节化学反应的速率和限度
一、化学反应的速率
日常生活中的化学变化有快有慢。有的反应瞬间完成,如爆炸;有的化学反应要经历几万年以上,如化石燃料的形成和溶洞的形成;有的反应在高温条件下变化快,在低温的条件下变化慢,如食品的变质;还有的反应在干燥的环境中变化慢,在潮湿的环境下变化快,如钢铁的锈蚀。人们在实验室进行化学反应时,常常采用粉碎反应物以增大其接触面积,或将固体反应物溶于水中以提高其接触机会,或加入催化剂等措施来提高化学应速率。
我们知道汽车运行时有一定的速度,我们可以用Km/min来表示。那么化学反应速率又用什么来表示?
反应速率的概念:
表示化学反应进行快慢的物理量。(与物理上的速度加以区别)
反应速率的表示方法:
常依据反应物的消失(单位时间内反应物浓度的减小)或生成物的产生(单位时间内生成物浓度的增大)来表示。
单位:mol/L。min或mol/(L·S)V=△c/△t
△c:表示物质的量浓度的变化量。
△t:表示时间的变化量
例题分析:
在一个容积为5L的密闭容器中进行可逆反应:
4NH3(气)+5O2(气)4NO(气)+6H2O(气),3OS后,NO的物质的量增加了0.3mol,则此反应的平均速率x为()
A.VO2=0.01mol/(L·S)B.VNO=0.008mol/(L·S)
C.VH2O=0.003mol/(L·S)D.VNH3=0.002mol/(L·S)
分析:根据化学反应速率的概念,可先求出以NO的浓度变化表示的平均速率,然后依据化学方程式的系数关系再换算成其它反应物或生成物的平均速率。
即:VNO==0.002mol/(L·S)
则:VNH3=VNO=0.002mol/(L·S)
VO2=0.002mol/(L·S)×4/5=0.0025mol/(L·S)
VH2O=0.002mol(L·S)×4/6=0.003mol/(L·S)
答案:C.D.
3.影响化学反应速率的因素
(1)反应原理探究
实验题目 双氧水分解反应
实验步骤 在一支试管中加入2~3mL约5%的H2O2,然后滴加1~2滴1mol/L的FeCl3溶液 待试管中产生大量气泡时,用带火星的火柴梗检验产生的气体
实验现象 有大量气泡产生 木条复燃
用化学方程式解释实验现象 2H2O2=2H2O+O2↑
思考问题 寻找答案 1.通过观察什么现象来判断该反应进行得快慢? 2.还有哪些其他办法观察该化学反应速率?
列出你对 问题的 想法
(2)温度对化学反应速率影响的实验探究
根据所给出的仪器和药品设计实验方案、步骤和装置。
①按下列装置和实验步骤进行对比实验。
②记录现象。
③处理分析实验现象。
④得出结论。
操作方法:在三支相同的试管中分别加入2~3ml约5%的H2O2,然后在每一支试管中滴加2滴1mol/L的FeCl3溶液后立即套上气球(大小相同)。等三支试管上的气球大小差不多相同时,同时置于三个烧杯中观察现象。
(3)催化剂对化学反应速率影响的实验探究
根据所给出的仪器和药品设计实验方案、步骤和装置。
①按下列装置和实验步骤进行对比实验。
②记录现象。
③处理分析实验现象。
④得出结论。
操作方法:在三个相同的带活塞的漏斗中分别加入2~3mL约5%的H2O2,然后在一支试管中滴加2滴1mol/L的FeCl3溶液,另一支试管中加入少量MnO2固体。同时向三支试管中放入漏斗中的全部溶液,观察红墨水上升情况。
4.总结影响化学反应速率的因素:温度、固体表面积、反应物的状态、溶液浓度、催化剂都是影响化学反应速率的因素。
[课堂练习]
1.在一个容积为5L的密闭容器中进行可逆反应:
4NH3(气)+5O2(气)===4NO(气)+6H2O(气),3OS后,NO的物质的量增加了0.3mol,则此反应的平均速率x为()
A.VO2=0.01mol/L(L·S)B.VNO=0.008mol/(L·S)
C.VH2O=0.003mol/(L·S)D.VNH3=0.002mol/(L·S)
2.把镁条投入盛有盐酸的敞口容器中,产生H2的速率可用下图表示,在下列因素中:①盐的浓度②镁条的表面积③溶液的温度④氯离子的浓度,影响反应速率的因素是()
(A)①④(B)③④
(C)①②③(D)①②③④
【第二课时】
[引言]上节课我们学习了有关化学反应速率问题,我们现在知道了,对于同一个化学反应,条件不同,反应速率不同。我们来回忆一下:什么是化学反应速率?化学反应速率的表示方法是什么?影响化学反应速率的因素有哪些?那么对于现实生产生活中,一个反应仅仅控制反应的速率是否就可以了呢?我们现实生活中一个简单的例子在冬天取暖的煤炉中煤炭怎样来让它发挥最大限度释放出最多的热能?这就是我们今天研究的课题—化学反应的限度问题。
[新课]第三节化学反应的速率和限度
一、化学反应的限度
为了引进这个限度的概念,我们先看这样的一个试验
实验2-7
实验步骤 向3~4mL1mol/L的CaCl2溶液中滴入1mol/L的Na2SO4溶液
实验现象 白色混浊
化学方程式 CaCl2+Na2SO4=CaSO4↓+2NaCl
离子方程式 Ca2++SO42-=CaSO4↓
小组讨论 交流 向上述反应后的清液中滴入适量1mol/L的Na2CO3溶液会出现什么现象
对于实验现象 提出的假设, 说明理由 假设:仍有白色混浊现象 理由:反应没有完全进行到底
实验证明 你的假设 现象:仍有白色混浊现象
化学方程式 CaCl2+Na2CO3=CaCO3↓+2NaCl
离子方程式 Ca2++CO32-=CaC03↓
解释 反应没有按着方程式剂量系数关系进行到底
以上实验说明了化学反应的限度问题
概念:化学反应的限度:在一定条件下,可逆反应中正反应速率与逆反应速率相等,反应混合物中各组成成分的含量保持不变,达到表面静止的一种“平衡状态”。
特征:处于密闭体系的可逆反应,化学平衡状态建立的条件是正反应速率和逆反应速率相等。即v(正)=v(逆)≠0.这是可逆反应达到平衡状态的重要标志。
影响因素:浓度、温度、气象反应的压强(将在以后的选修教材中详细讲解)
过渡:通过我们前边对化学法案应速率即限度的了解,对于现实生产生活的实际问题,如何来控制反应的速率和限度,是一个理论和实践的交汇点,下面我们来通过一些事例加以讨论。
二、化学反应条件的控制
事例一:定向爆破
事例二:怎样让燃煤充分燃烧
事例三:食品保鲜防腐
事例四:工业合成氨的条件(简单说明)
学生讨论总结:
教师归纳提出见解
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
