3.2.1 溶解组成的表示方法课件-2022-2023学年九年级化学鲁教版上册(共28张PPT)
文档属性
| 名称 | 3.2.1 溶解组成的表示方法课件-2022-2023学年九年级化学鲁教版上册(共28张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-19 00:00:00 | ||
图片预览








文档简介
(共28张PPT)
第二节 溶液组成的定量表示
第1课时 溶解组成的表示方法
第三单元 溶液
鲁教版 化学 九年级上册
1. 溶液组成的表示方法;
2. 溶质质量分数.
学习目标
生产生活中,我们经常会提及“溶液的浓度”,也就是相同的溶液,所含的溶质质量是不一致的,那么化学中我们如何来表示呢?
导入新知
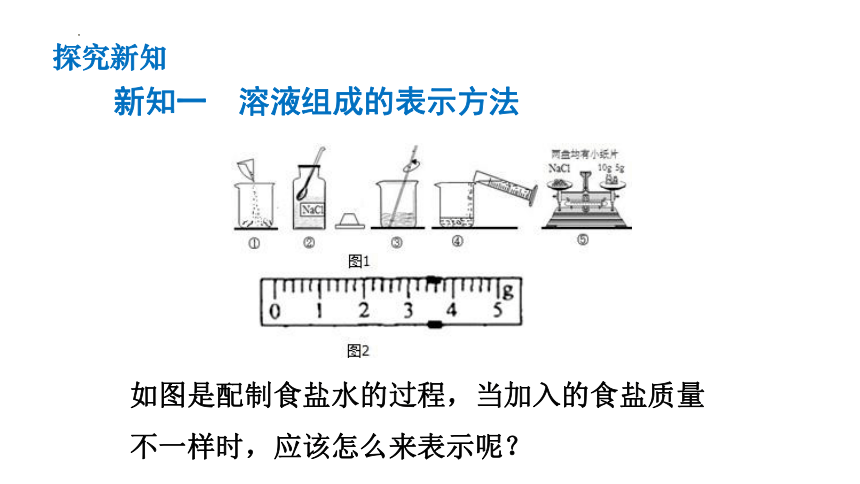
如图是配制食盐水的过程,当加入的食盐质量不一样时,应该怎么来表示呢?
新知一 溶液组成的表示方法
探究新知
1. 概念 溶质质量与溶液质量的比值叫溶质的质量分数。
2. 常用的计算公式和方法
溶质的质量分数=
×100%
溶质质量
溶液质量
相关的计算有:(1)溶液质量= 溶质质量+ 溶剂质量
(2)溶液质量= 溶液体积× 溶液密度
(3)溶质质量= 溶液质量× 溶质的质量分数
(4)溶液质量=
溶质质量
溶质的质量分数
特别提醒
计算溶质的质量分数时,一定要格式规范,特别注意单位统一,不同的物理量之间要进行换算;
溶质的质量是指已经溶解的部分,未溶解的不能算入溶液的质量。
关于100 g 10%的硝酸钾溶液,叙述正确的是( )
A. 100 g 水中溶有10 g 硝酸钾
B. 溶液中硝酸钾与水的质量比为1 ∶ 10
C. 将硝酸钾和水按9 ∶ 1 的质量比配成的溶液
D. 将10 g 硝酸钾溶于90 g 水中,可配得该溶液
D
例1
易错提醒
溶质质量分数是溶质质量与溶液质量之比,而溶液质量是溶质质量与溶剂质量之和,不能将溶质质量分数理解为溶质质量与溶剂质量之比。
现有某温度下的硝酸钾溶液35 g,若将其蒸干, 得到7 g 硝酸钾, 则该溶液中溶质的质量分数为__________ 。
(1)若将上述溶液取出2 mL,则剩余溶液的溶质质量分数为 __________。
(2)若往上述溶液中加入21 g 水,所得溶液的溶质质量分数为 __________ 。
20%
20%
12.5%
例2
(3)若往上述溶液中加入3 g 硝酸钾,搅拌后完全溶解,所得溶液的溶质质量分数为 __________ 。
(4)若往上述溶液中加入45 g 12% 的硝酸钾溶液,所得溶液的溶质质量分数为 __________ 。
26.3%
15.5%
方法点拨
计算溶质质量分数时应注意:
1. 正确运用公式: ×100%,是质量比,不是体积比。
2. 溶液具有均一性,各部分的密度及溶质质量分数相等。
溶质质量
溶液质量
3. 当溶液中的溶质、溶剂质量改变 ,如添加(或析出)溶质 ,增加(或蒸发)溶剂时,计算溶质质量分数时相关的量也作相应的变化。
4.混合后的溶液中溶质、溶液质量为各溶液的溶质、溶液质量之和。
新知二 溶液稀释与浓缩问题的计算
溶液加水稀释或者浓缩后,溶质的质量分数会发生变化,那相关的计算如何进行呢?接下来我们来探讨一下!
1. 溶液稀释的方法与计算公式
(1)加水稀释:A 为浓溶液质量,a% 为浓溶液溶质的质量分数;B 为稀释后溶液质量,b% 表示稀释后溶质的质量分数;M 水表示加入水的质量。稀释前后溶质质量不变。则有:A·a%=B·b% 或A·a%=(A+M 水)·b%。
(2)加入稀溶液稀释浓溶液:A 为浓溶液质量,a% 为浓溶液溶质的质量分数;B 为稀溶液质量,b% 表示稀溶液溶质的质量分数;c% 代表混合后所得溶液溶质的质量分数。则有:A·a%+B·b%=(A+B)·c%。
2. 溶液浓缩的方法与计算公式
(1)加入溶质:A 为原溶液质量,a% 为其溶质的质量分数;B 为加入溶质的质量,c% 表示加入溶质后所得溶液溶质的质量分数。则:A·a%+B=(A+B)·c%。
(2)蒸发溶剂:A 为原溶液质量,a% 为其溶质的质量分数;B 为减少的溶剂的质量,c% 为蒸发溶剂后所得溶液溶质的质量分数。则:A·a%=(A-B)·c%。
(3)与浓溶液混合:A 为原溶液质量,a% 为其溶质的质量分数,B 为浓溶液质量,b% 表示其溶质的质量分数,c% 表示混合后所得溶液溶质的质量分数。则:A·a%+B·b%=(A+B)·c%。
易错提示
1.计算时要保持单位一致。
2.两种溶液混合,混合后溶液的质量等于混合前两种溶液的质量之和,但混合后溶液的体积不一定等于混合前两种溶液的体积之和。
(1)将50 g 98% 的浓硫酸配制成9.8% 的稀硫酸,需加水的质量为( )
A.250 g B.350 g C.450 g D.500 g
(2)将80 g 20% 的NaCl 溶液变成10%,下列方法正确的是( )
A. 加入8 g NaCl 固体 B. 加入80 g 水
C. 倒掉40 g 溶液 D. 加入40 g 5% 的NaCl 溶液
C
B
例3
方法点拨
要使溶液的溶质质量分数减小,可用的方法有:
加水稀释。可利用稀释前后溶质的质量不变来列式计算,若要使溶液的溶质质量分数减小至原来的一半,加入水的质量应等于原溶液质量;
加入溶质质量分数比其小的溶液。
可利用混合后溶液中溶质质量与混合前两种溶液中溶质质量和相等的关系列式计算。
2021 年,新冠肺炎疫情继续在全球肆虐。预防新冠肺炎最有效的方法之一就是用消毒液消毒。二氧化氯消毒液能够迅速、彻底杀灭各种细菌和病毒,某地决定对某小区全面消毒。小陈观察到瓶上的标签如表所示。求:
二氧化氯(ClO2)1 000 mL 溶质的质量分数 80%
密度 1.2 g/mL
相对分子质量 67.5
强腐蚀性,阴冷处密封储藏 例4
(1) 这1 000 mL 二氧化氯消毒液的质量是________g,其中含溶质二氧化氯 ________ g。
1 200
二氧化氯(ClO2)1 000 mL 溶质的质量分数 80%
密度 1.2 g/mL
相对分子质量 67.5
强腐蚀性,阴冷处密封储藏 960
(2)若将这1 000 mL 二氧化氯消毒液与5 000 g 水均匀混合,所得稀二氧化氯消毒液中二氧化氯的质量分数为________ (结果保留小数点后一位)。
15.5%
二氧化氯(ClO2)1 000 mL 溶质的质量分数 80%
密度 1.2 g/mL
相对分子质量 67.5
强腐蚀性,阴冷处密封储藏 (3)欲配制30 kg 质量分数为20% 的稀二氧化氯消毒液用于消毒,需要 ________ kg 这种二氧化氯消毒液和________ kg 水。
7.5
二氧化氯(ClO2)1 000 mL 溶质的质量分数 80%
密度 1.2 g/mL
相对分子质量 67.5
强腐蚀性,阴冷处密封储藏 22.5
解法提醒
溶质质量分数关系式中的各种量都是以质量表示的,不得以体积数据代替。
在计算中如需把体积换算成质量,可以通过密度来计算:溶液质量[m(溶液)]= 溶液体积(V)× 溶液密度(ρ);
若要将溶液质量换算为溶液体积,则可代入:
溶液体积( V )= 。
溶液密度( ρ )
溶液质量[m(溶液)]
溶液质量分数的基本计算
溶液的质量分数
溶液组成的表示方法
归纳新知
再 见
第二节 溶液组成的定量表示
第1课时 溶解组成的表示方法
第三单元 溶液
鲁教版 化学 九年级上册
1. 溶液组成的表示方法;
2. 溶质质量分数.
学习目标
生产生活中,我们经常会提及“溶液的浓度”,也就是相同的溶液,所含的溶质质量是不一致的,那么化学中我们如何来表示呢?
导入新知
如图是配制食盐水的过程,当加入的食盐质量不一样时,应该怎么来表示呢?
新知一 溶液组成的表示方法
探究新知
1. 概念 溶质质量与溶液质量的比值叫溶质的质量分数。
2. 常用的计算公式和方法
溶质的质量分数=
×100%
溶质质量
溶液质量
相关的计算有:(1)溶液质量= 溶质质量+ 溶剂质量
(2)溶液质量= 溶液体积× 溶液密度
(3)溶质质量= 溶液质量× 溶质的质量分数
(4)溶液质量=
溶质质量
溶质的质量分数
特别提醒
计算溶质的质量分数时,一定要格式规范,特别注意单位统一,不同的物理量之间要进行换算;
溶质的质量是指已经溶解的部分,未溶解的不能算入溶液的质量。
关于100 g 10%的硝酸钾溶液,叙述正确的是( )
A. 100 g 水中溶有10 g 硝酸钾
B. 溶液中硝酸钾与水的质量比为1 ∶ 10
C. 将硝酸钾和水按9 ∶ 1 的质量比配成的溶液
D. 将10 g 硝酸钾溶于90 g 水中,可配得该溶液
D
例1
易错提醒
溶质质量分数是溶质质量与溶液质量之比,而溶液质量是溶质质量与溶剂质量之和,不能将溶质质量分数理解为溶质质量与溶剂质量之比。
现有某温度下的硝酸钾溶液35 g,若将其蒸干, 得到7 g 硝酸钾, 则该溶液中溶质的质量分数为__________ 。
(1)若将上述溶液取出2 mL,则剩余溶液的溶质质量分数为 __________。
(2)若往上述溶液中加入21 g 水,所得溶液的溶质质量分数为 __________ 。
20%
20%
12.5%
例2
(3)若往上述溶液中加入3 g 硝酸钾,搅拌后完全溶解,所得溶液的溶质质量分数为 __________ 。
(4)若往上述溶液中加入45 g 12% 的硝酸钾溶液,所得溶液的溶质质量分数为 __________ 。
26.3%
15.5%
方法点拨
计算溶质质量分数时应注意:
1. 正确运用公式: ×100%,是质量比,不是体积比。
2. 溶液具有均一性,各部分的密度及溶质质量分数相等。
溶质质量
溶液质量
3. 当溶液中的溶质、溶剂质量改变 ,如添加(或析出)溶质 ,增加(或蒸发)溶剂时,计算溶质质量分数时相关的量也作相应的变化。
4.混合后的溶液中溶质、溶液质量为各溶液的溶质、溶液质量之和。
新知二 溶液稀释与浓缩问题的计算
溶液加水稀释或者浓缩后,溶质的质量分数会发生变化,那相关的计算如何进行呢?接下来我们来探讨一下!
1. 溶液稀释的方法与计算公式
(1)加水稀释:A 为浓溶液质量,a% 为浓溶液溶质的质量分数;B 为稀释后溶液质量,b% 表示稀释后溶质的质量分数;M 水表示加入水的质量。稀释前后溶质质量不变。则有:A·a%=B·b% 或A·a%=(A+M 水)·b%。
(2)加入稀溶液稀释浓溶液:A 为浓溶液质量,a% 为浓溶液溶质的质量分数;B 为稀溶液质量,b% 表示稀溶液溶质的质量分数;c% 代表混合后所得溶液溶质的质量分数。则有:A·a%+B·b%=(A+B)·c%。
2. 溶液浓缩的方法与计算公式
(1)加入溶质:A 为原溶液质量,a% 为其溶质的质量分数;B 为加入溶质的质量,c% 表示加入溶质后所得溶液溶质的质量分数。则:A·a%+B=(A+B)·c%。
(2)蒸发溶剂:A 为原溶液质量,a% 为其溶质的质量分数;B 为减少的溶剂的质量,c% 为蒸发溶剂后所得溶液溶质的质量分数。则:A·a%=(A-B)·c%。
(3)与浓溶液混合:A 为原溶液质量,a% 为其溶质的质量分数,B 为浓溶液质量,b% 表示其溶质的质量分数,c% 表示混合后所得溶液溶质的质量分数。则:A·a%+B·b%=(A+B)·c%。
易错提示
1.计算时要保持单位一致。
2.两种溶液混合,混合后溶液的质量等于混合前两种溶液的质量之和,但混合后溶液的体积不一定等于混合前两种溶液的体积之和。
(1)将50 g 98% 的浓硫酸配制成9.8% 的稀硫酸,需加水的质量为( )
A.250 g B.350 g C.450 g D.500 g
(2)将80 g 20% 的NaCl 溶液变成10%,下列方法正确的是( )
A. 加入8 g NaCl 固体 B. 加入80 g 水
C. 倒掉40 g 溶液 D. 加入40 g 5% 的NaCl 溶液
C
B
例3
方法点拨
要使溶液的溶质质量分数减小,可用的方法有:
加水稀释。可利用稀释前后溶质的质量不变来列式计算,若要使溶液的溶质质量分数减小至原来的一半,加入水的质量应等于原溶液质量;
加入溶质质量分数比其小的溶液。
可利用混合后溶液中溶质质量与混合前两种溶液中溶质质量和相等的关系列式计算。
2021 年,新冠肺炎疫情继续在全球肆虐。预防新冠肺炎最有效的方法之一就是用消毒液消毒。二氧化氯消毒液能够迅速、彻底杀灭各种细菌和病毒,某地决定对某小区全面消毒。小陈观察到瓶上的标签如表所示。求:
二氧化氯(ClO2)1 000 mL 溶质的质量分数 80%
密度 1.2 g/mL
相对分子质量 67.5
强腐蚀性,阴冷处密封储藏 例4
(1) 这1 000 mL 二氧化氯消毒液的质量是________g,其中含溶质二氧化氯 ________ g。
1 200
二氧化氯(ClO2)1 000 mL 溶质的质量分数 80%
密度 1.2 g/mL
相对分子质量 67.5
强腐蚀性,阴冷处密封储藏 960
(2)若将这1 000 mL 二氧化氯消毒液与5 000 g 水均匀混合,所得稀二氧化氯消毒液中二氧化氯的质量分数为________ (结果保留小数点后一位)。
15.5%
二氧化氯(ClO2)1 000 mL 溶质的质量分数 80%
密度 1.2 g/mL
相对分子质量 67.5
强腐蚀性,阴冷处密封储藏 (3)欲配制30 kg 质量分数为20% 的稀二氧化氯消毒液用于消毒,需要 ________ kg 这种二氧化氯消毒液和________ kg 水。
7.5
二氧化氯(ClO2)1 000 mL 溶质的质量分数 80%
密度 1.2 g/mL
相对分子质量 67.5
强腐蚀性,阴冷处密封储藏 22.5
解法提醒
溶质质量分数关系式中的各种量都是以质量表示的,不得以体积数据代替。
在计算中如需把体积换算成质量,可以通过密度来计算:溶液质量[m(溶液)]= 溶液体积(V)× 溶液密度(ρ);
若要将溶液质量换算为溶液体积,则可代入:
溶液体积( V )= 。
溶液密度( ρ )
溶液质量[m(溶液)]
溶液质量分数的基本计算
溶液的质量分数
溶液组成的表示方法
归纳新知
再 见
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
