5.2 化学反应的表示课件 --2022--2023学年九年级化学鲁教版上册(共36张PPT)
文档属性
| 名称 | 5.2 化学反应的表示课件 --2022--2023学年九年级化学鲁教版上册(共36张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-19 10:16:17 | ||
图片预览











文档简介
(共36张PPT)
第二节 化学反应的表示
第五单元 定量研究化学反应
鲁教版 化学 九年级上册
1. 化学方程式及意义.
2. 化学方程式的书写.
学习目标
在化学反应中,是将反应物转化为生成物,但是很多时候我们表述起来怎么更简单、更方便呢?
导入新知
大家来看一下上面氧气的表述,哪个更简单呢?
我们能否用同样的方式来表述化学变化呢?
新知一 化学方程式的意义及读法
氧气
O2
探究新知
1. 概念
用化学式来表示化学反应的式子,叫做化学方程式。
2. 化学方程式的意义
(1)反映了反应物、生成物和反应条件;
(2) 反映了各物质间的质量比,即各物质的相对分子质量与化学计量数的乘积之比;
(3)反映了各粒子间的相对数量比,即化学计量数之比。
3. 化学方程式的读法
以2H2+O2 ======2H2O 为例:
(1)从物质的角度:氢气与氧气在点燃条件下反应生成水;
(2) 从量的角度: 每4 份质量的氢气与32 份质量的氧气完全反应,生成36 份质量的水;
(3) 从微观角度:每2 个氢分子与1 个氧分子结合生成2 个水分子。
点燃
易错提示
计算化学方程式中各物质的质量比时,应用物质的相对分子质量乘化学计量数,而不能直接用化学计量数之比或相对分子质量之比来表示。
读化学方程式时,中间的“+”读作“和”或“与”,不能读成“加”,“===”读作“生成”,不能读作数学符号“等于”。
[2021·泰安] 关于化学方程式CH4 + 2O2=====
CO2+ 2H2O 的描述正确的是( )
A. 甲烷加氧气在点燃条件下,反应生成二氧化碳和水
B. 1 个甲烷和2 个氧气在点燃条件下,生成1 个二氧化碳和 2 个水
C. 每1 个CH4 分子和2 个O2 分子在点燃条件下,生成1 个CO2 分子和2 个H2O 分子
D. 1 g CH4 和2 g O2 在点燃条件下,生成1 g CO2 和2 g H2O
C
点燃
例1
规律总结
化学方程式提供的信息
(1)反应物;(2)生成物;(3)反应条件;
(4)反应物和生成物之间的粒子数目之比(即化学计量数之比);
(5)反应物与生成物之间的质量之比(即相对分子质量与化学计量数的乘积之比);
(6)反应类型。
新知二 化学方程式的书写
用化学方程式可以简明科学的了解化学反应,那么在化学方程式的书写上有什么原则?
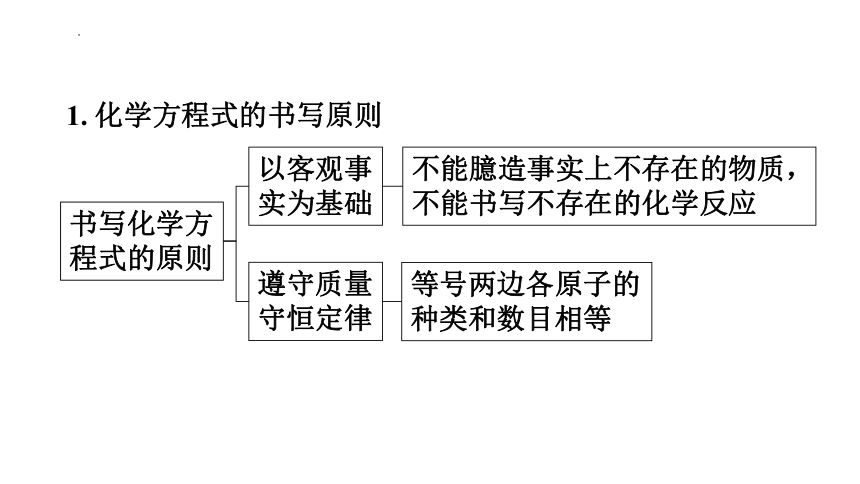
1. 化学方程式的书写原则
等号两边各原子的
种类和数目相等
书写化学方
程式的原则
以客观事
实为基础
不能臆造事实上不存在的物质,
不能书写不存在的化学反应
遵守质量
守恒定律
如:Fe+O2=====FeO2,与事实不符,FeO2 不存在;Mg+O2 =====MgO2、4Fe+3O2 =====2Fe2O3,均不符合客观事实;H2+O2 =====H2O,不符合质量守恒定律。
点燃
点燃
点燃
点燃
2. 化学方程式的书写
书写化学方程式的步骤如下:(以电解水为例)
一写
二配
在化学式前面配上适当的化学计量数,使左
右两边原子个数相等。2H2O ——2H2+O2;
正确书写反应物、生成物的化学式,反应物、生
成物中间用“——”连接。如H2O ——H2+O2;
三标
四查
查化学式是否正确;化学方程式是否配平;
反应条件是否漏写、错写;生成物的状态即
“↑”或“↓”是否漏标、错标。
标明化学反应条件。如加热(用“△”表示)、
点燃等,写在等号上方;(2)标明生成物的
状态;并将“——”改成“=====”。
2H2O ======2H2 ↑ +O2 ↑;
通电
重点提示
配平时,化学计量数为最简整数比。
书写反应条件时,加热用“△”表示。能用化学式的不能用文字表示,但注意点燃≠燃烧。
当反应物中有气体时,生成的气体化学式右边不标“↑”,只有当反应物中没有气体,才能在生成的气体化学式右边标“ ↑”;同理,溶液中的反应,只有当反应物中无固体时,才能在生成的固体化学式右边标“↓”,
工业生产金属钛的过程中有一种反应的化学方程式如下:TiF4+2H2SO4 ==== 4HF+2X+TiO2,其中X 的化学式为( )
A. H2SO4 B. SO2 C. H2SO3 D. SO3
D
△
例2
方法点拨
确定化学反应中的反应物或生成物中原子的种类时,可采用分类汇总法,即先分别找出反应前后已知的每种原子的总数量,然后左右对照,缺少的原子的种类、数量由未知物补充。
现有下列物质:水、铁丝、氧气、木炭、过氧化氢,从中选出物质,写出符合下列要求的化学方程式各一个:
(1)物质燃烧生成黑色固体 __________________________________________。
(2)有两种气体单质生成的分解反应 __________________________________________。
3Fe+2O2=====Fe3O4
点燃
2H2O =====2H2 ↑ +O2 ↑
通电
例3
(3)物质燃烧生成能使澄清石灰水变浑浊的气体__________________________________________。
(4)一种物质在催化剂作用下分解生成氧气 __________________________________________。
C+O2=====CO2
点燃
2H2O2===== 2H2O+O2 ↑
MnO2
误区警示
书写化学方程式要注意做到:
1.正确书写出反应物、生成物的化学式,不能凭空臆造反应物、生成物;
2.要配平,且化学计量数写在相应化学式前面,为最简整数比,不能为了配平改变物质的构成;
3.正确使用“↓”“↑”,不得漏标、错标。
4.反应条件不能漏,不要错。
新知三 化学方程式的配平
在化学反应中要遵守质量守恒定律的,当我们用化学方程式表示化学反应时,怎么来保证质量守恒定律呢?
化学方程式的配平即是在化学式前面配上适当的化学计量数,使左右两边原子个数相等。配平化学方程式时应做到:观察分析,选准方法,逐一配平。常见的配平方法有:
特别提醒:化学方程式配平的方法:
1. 最小公倍数法,适合于左右两边的同种原子集中在一种物质中。
2. 奇数配偶法,适合于左右两边的同种原子分散在多种物质中,且个数为一奇一偶。
3. 设“1”配平法,适合于含C、H 或C、H、O 元素的物质与O2 反应。
要点提示:化学方程式配平的方法很多,应用时注意:
(1)分类灵活运用,如反应物、生成物中同种元素的原子分别集中在一种物质中,则可采用最小公倍数法依次配平,若同种原子分散在多种物质中,则可采用“奇数配偶法”或“配分数法”配平;
(2)一题多法,有的化学方程式可采用多种方法来配平,达到殊途同归的效果。
配平下列化学方程式。
(1)Al+Fe3O4 ———Fe+Al2O3
(2)Fe2O3+H2SO4———Fe2(SO4)3 +H2O
高温
Fe2O3+3H2SO4 ===== Fe2(SO4)3+3H2O
8Al+3Fe3O4 =====9Fe+4Al2O3
高温
例4
方法点拨
1. 首先找出两边化学式中各出现一次的元素,若几种元素两边都是各出现一次,则选原子个数较多的元素,求其原子个数的最小公倍数。
2. 用最小公倍数分别除以化学式中该元素的原子个数,所得的商标在含有该元素的化学式前面;
3. 同理再配平其他元素的原子。
CO+Fe3O4=====Fe+CO2
高温
4CO+Fe3O4=====4CO2+3Fe
高温
例5
方法点拨
1. 找出在两边化学式中多次出现,且原子个数为一奇一偶的元素;
2. 在相关化学式前配上适当的化学计量数,将奇数与偶数相互转换;
3. 依次配平其他元素的原子。
C2H5OH+O2 =====CO2+H2O
点燃
C2H5OH+3O2 =====2CO2+3H2O
点燃
例6
方法点拨
1. 先找出化学式较复杂的一种,将其前面的化学计量数设为“1”;
2. 以该物质中的原子个数为参照标准,配平其他原子,必要时,还可在化学式前配上分数,最后将分数化为整数。
[改编·邵阳] 下列化学方程式书写正确的是( )
A. Mg+O2 =====MgO2
B. 4P + 5O2 =====2P2O5
C. 2H2O =====2H2+ O2
D. CO+Fe2O3 =====Fe+CO2
B
点燃
点燃
通电
高温
例7
解法提醒
书写化学方程式时,
1.应如实写出反应物、生成物的化学式。如A中应生成MgO;
2.化学方程式需配平,如D 项未配平;
3.要正确标明反应条件和生成物的状态。如C项H2、O2后未标注“↑”
[中考· 泸州] 一种新型复合光催化剂(C3N4/CQDs),能利用太阳光分解水,原理如图1 所示。回答下列问题:
(1)这个过程将 _________能转化为化学能。反应Ⅱ属于基本反应类型中的 ________________ 。
太阳
分解反应
例8
(2)写出反应Ⅰ的化学方程式:_____________________________。
2H2O ====== H2O2+H2 ↑
太阳能
C3N4
试题解析
(1)这个过程将太阳能转化为化学能;反应Ⅱ是由过氧化氢一种物质生成水和氧气两种物质,属于基本反应类型中的分解反应。(2) 由微观反应示意图可知,反应Ⅰ是由水在太阳能和催化剂的作用下生成过氧化氢和氢气,据此书写化学方程式。
化学方程式的
意义与读法
确定
反映
某一化学方程式
的读法与写法
归纳新知
第二节 化学反应的表示
第五单元 定量研究化学反应
鲁教版 化学 九年级上册
1. 化学方程式及意义.
2. 化学方程式的书写.
学习目标
在化学反应中,是将反应物转化为生成物,但是很多时候我们表述起来怎么更简单、更方便呢?
导入新知
大家来看一下上面氧气的表述,哪个更简单呢?
我们能否用同样的方式来表述化学变化呢?
新知一 化学方程式的意义及读法
氧气
O2
探究新知
1. 概念
用化学式来表示化学反应的式子,叫做化学方程式。
2. 化学方程式的意义
(1)反映了反应物、生成物和反应条件;
(2) 反映了各物质间的质量比,即各物质的相对分子质量与化学计量数的乘积之比;
(3)反映了各粒子间的相对数量比,即化学计量数之比。
3. 化学方程式的读法
以2H2+O2 ======2H2O 为例:
(1)从物质的角度:氢气与氧气在点燃条件下反应生成水;
(2) 从量的角度: 每4 份质量的氢气与32 份质量的氧气完全反应,生成36 份质量的水;
(3) 从微观角度:每2 个氢分子与1 个氧分子结合生成2 个水分子。
点燃
易错提示
计算化学方程式中各物质的质量比时,应用物质的相对分子质量乘化学计量数,而不能直接用化学计量数之比或相对分子质量之比来表示。
读化学方程式时,中间的“+”读作“和”或“与”,不能读成“加”,“===”读作“生成”,不能读作数学符号“等于”。
[2021·泰安] 关于化学方程式CH4 + 2O2=====
CO2+ 2H2O 的描述正确的是( )
A. 甲烷加氧气在点燃条件下,反应生成二氧化碳和水
B. 1 个甲烷和2 个氧气在点燃条件下,生成1 个二氧化碳和 2 个水
C. 每1 个CH4 分子和2 个O2 分子在点燃条件下,生成1 个CO2 分子和2 个H2O 分子
D. 1 g CH4 和2 g O2 在点燃条件下,生成1 g CO2 和2 g H2O
C
点燃
例1
规律总结
化学方程式提供的信息
(1)反应物;(2)生成物;(3)反应条件;
(4)反应物和生成物之间的粒子数目之比(即化学计量数之比);
(5)反应物与生成物之间的质量之比(即相对分子质量与化学计量数的乘积之比);
(6)反应类型。
新知二 化学方程式的书写
用化学方程式可以简明科学的了解化学反应,那么在化学方程式的书写上有什么原则?
1. 化学方程式的书写原则
等号两边各原子的
种类和数目相等
书写化学方
程式的原则
以客观事
实为基础
不能臆造事实上不存在的物质,
不能书写不存在的化学反应
遵守质量
守恒定律
如:Fe+O2=====FeO2,与事实不符,FeO2 不存在;Mg+O2 =====MgO2、4Fe+3O2 =====2Fe2O3,均不符合客观事实;H2+O2 =====H2O,不符合质量守恒定律。
点燃
点燃
点燃
点燃
2. 化学方程式的书写
书写化学方程式的步骤如下:(以电解水为例)
一写
二配
在化学式前面配上适当的化学计量数,使左
右两边原子个数相等。2H2O ——2H2+O2;
正确书写反应物、生成物的化学式,反应物、生
成物中间用“——”连接。如H2O ——H2+O2;
三标
四查
查化学式是否正确;化学方程式是否配平;
反应条件是否漏写、错写;生成物的状态即
“↑”或“↓”是否漏标、错标。
标明化学反应条件。如加热(用“△”表示)、
点燃等,写在等号上方;(2)标明生成物的
状态;并将“——”改成“=====”。
2H2O ======2H2 ↑ +O2 ↑;
通电
重点提示
配平时,化学计量数为最简整数比。
书写反应条件时,加热用“△”表示。能用化学式的不能用文字表示,但注意点燃≠燃烧。
当反应物中有气体时,生成的气体化学式右边不标“↑”,只有当反应物中没有气体,才能在生成的气体化学式右边标“ ↑”;同理,溶液中的反应,只有当反应物中无固体时,才能在生成的固体化学式右边标“↓”,
工业生产金属钛的过程中有一种反应的化学方程式如下:TiF4+2H2SO4 ==== 4HF+2X+TiO2,其中X 的化学式为( )
A. H2SO4 B. SO2 C. H2SO3 D. SO3
D
△
例2
方法点拨
确定化学反应中的反应物或生成物中原子的种类时,可采用分类汇总法,即先分别找出反应前后已知的每种原子的总数量,然后左右对照,缺少的原子的种类、数量由未知物补充。
现有下列物质:水、铁丝、氧气、木炭、过氧化氢,从中选出物质,写出符合下列要求的化学方程式各一个:
(1)物质燃烧生成黑色固体 __________________________________________。
(2)有两种气体单质生成的分解反应 __________________________________________。
3Fe+2O2=====Fe3O4
点燃
2H2O =====2H2 ↑ +O2 ↑
通电
例3
(3)物质燃烧生成能使澄清石灰水变浑浊的气体__________________________________________。
(4)一种物质在催化剂作用下分解生成氧气 __________________________________________。
C+O2=====CO2
点燃
2H2O2===== 2H2O+O2 ↑
MnO2
误区警示
书写化学方程式要注意做到:
1.正确书写出反应物、生成物的化学式,不能凭空臆造反应物、生成物;
2.要配平,且化学计量数写在相应化学式前面,为最简整数比,不能为了配平改变物质的构成;
3.正确使用“↓”“↑”,不得漏标、错标。
4.反应条件不能漏,不要错。
新知三 化学方程式的配平
在化学反应中要遵守质量守恒定律的,当我们用化学方程式表示化学反应时,怎么来保证质量守恒定律呢?
化学方程式的配平即是在化学式前面配上适当的化学计量数,使左右两边原子个数相等。配平化学方程式时应做到:观察分析,选准方法,逐一配平。常见的配平方法有:
特别提醒:化学方程式配平的方法:
1. 最小公倍数法,适合于左右两边的同种原子集中在一种物质中。
2. 奇数配偶法,适合于左右两边的同种原子分散在多种物质中,且个数为一奇一偶。
3. 设“1”配平法,适合于含C、H 或C、H、O 元素的物质与O2 反应。
要点提示:化学方程式配平的方法很多,应用时注意:
(1)分类灵活运用,如反应物、生成物中同种元素的原子分别集中在一种物质中,则可采用最小公倍数法依次配平,若同种原子分散在多种物质中,则可采用“奇数配偶法”或“配分数法”配平;
(2)一题多法,有的化学方程式可采用多种方法来配平,达到殊途同归的效果。
配平下列化学方程式。
(1)Al+Fe3O4 ———Fe+Al2O3
(2)Fe2O3+H2SO4———Fe2(SO4)3 +H2O
高温
Fe2O3+3H2SO4 ===== Fe2(SO4)3+3H2O
8Al+3Fe3O4 =====9Fe+4Al2O3
高温
例4
方法点拨
1. 首先找出两边化学式中各出现一次的元素,若几种元素两边都是各出现一次,则选原子个数较多的元素,求其原子个数的最小公倍数。
2. 用最小公倍数分别除以化学式中该元素的原子个数,所得的商标在含有该元素的化学式前面;
3. 同理再配平其他元素的原子。
CO+Fe3O4=====Fe+CO2
高温
4CO+Fe3O4=====4CO2+3Fe
高温
例5
方法点拨
1. 找出在两边化学式中多次出现,且原子个数为一奇一偶的元素;
2. 在相关化学式前配上适当的化学计量数,将奇数与偶数相互转换;
3. 依次配平其他元素的原子。
C2H5OH+O2 =====CO2+H2O
点燃
C2H5OH+3O2 =====2CO2+3H2O
点燃
例6
方法点拨
1. 先找出化学式较复杂的一种,将其前面的化学计量数设为“1”;
2. 以该物质中的原子个数为参照标准,配平其他原子,必要时,还可在化学式前配上分数,最后将分数化为整数。
[改编·邵阳] 下列化学方程式书写正确的是( )
A. Mg+O2 =====MgO2
B. 4P + 5O2 =====2P2O5
C. 2H2O =====2H2+ O2
D. CO+Fe2O3 =====Fe+CO2
B
点燃
点燃
通电
高温
例7
解法提醒
书写化学方程式时,
1.应如实写出反应物、生成物的化学式。如A中应生成MgO;
2.化学方程式需配平,如D 项未配平;
3.要正确标明反应条件和生成物的状态。如C项H2、O2后未标注“↑”
[中考· 泸州] 一种新型复合光催化剂(C3N4/CQDs),能利用太阳光分解水,原理如图1 所示。回答下列问题:
(1)这个过程将 _________能转化为化学能。反应Ⅱ属于基本反应类型中的 ________________ 。
太阳
分解反应
例8
(2)写出反应Ⅰ的化学方程式:_____________________________。
2H2O ====== H2O2+H2 ↑
太阳能
C3N4
试题解析
(1)这个过程将太阳能转化为化学能;反应Ⅱ是由过氧化氢一种物质生成水和氧气两种物质,属于基本反应类型中的分解反应。(2) 由微观反应示意图可知,反应Ⅰ是由水在太阳能和催化剂的作用下生成过氧化氢和氢气,据此书写化学方程式。
化学方程式的
意义与读法
确定
反映
某一化学方程式
的读法与写法
归纳新知
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
