中考二轮专题 鉴别和除杂复习探究 课件(共26张PPT)
文档属性
| 名称 | 中考二轮专题 鉴别和除杂复习探究 课件(共26张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-20 20:51:36 | ||
图片预览






文档简介
(共26张PPT)
化 学 中 考
鉴别和除杂复习探究
4分
4分
8分
4分
2017年
2015年
2018年
2016年
考情分析:鉴别和除杂两个选择题
01
物 质 鉴 别
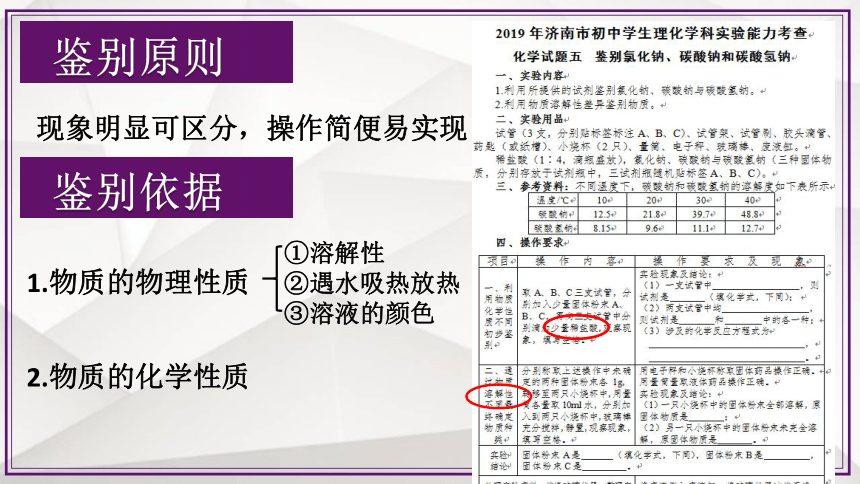
鉴别原则
现象明显可区分,操作简便易实现
鉴别依据
2.物质的化学性质
1.物质的物理性质
①溶解性
②遇水吸热放热
③溶液的颜色
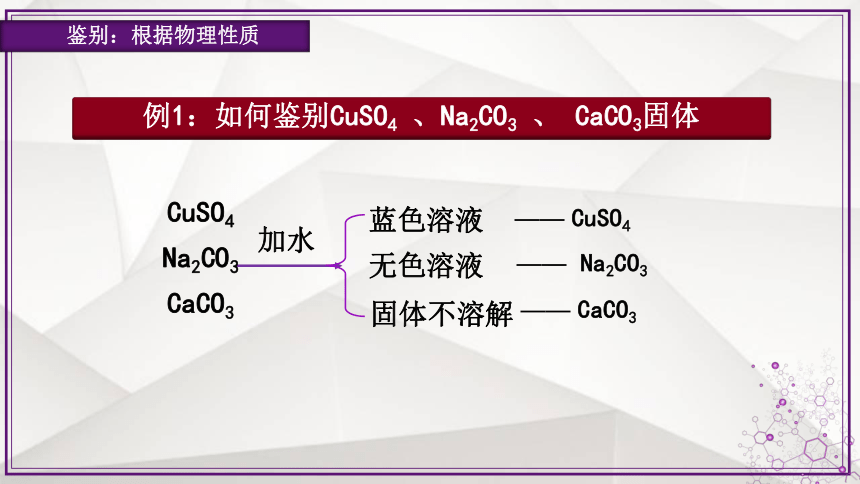
鉴别:根据物理性质
CuSO4
Na2CO3
CaCO3
加水
蓝色溶液
无色溶液
固体不溶解
—— CuSO4
—— Na2CO3
—— CaCO3
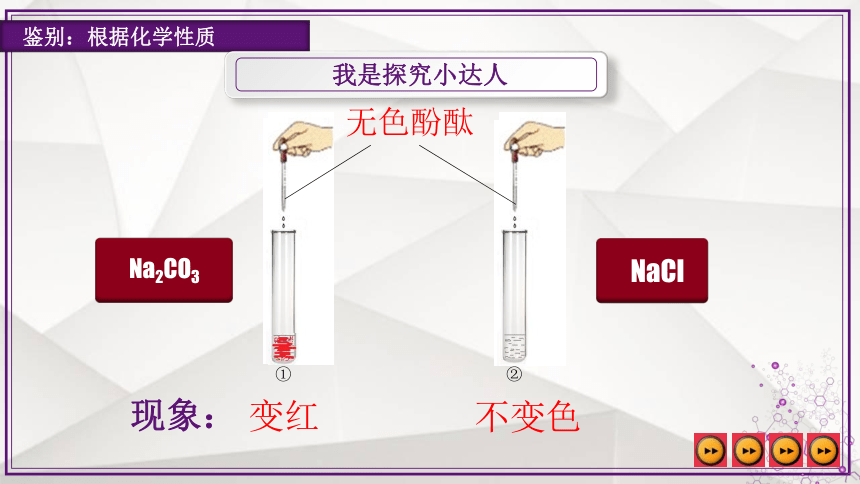
我是探究小达人
鉴别:根据化学性质
温 馨 提 示
鉴别:根据化学性质
1.实验前小组交流探讨鉴别方案。
2. 将①、②试剂瓶中的溶液分别倒入贴有
①、②标签的试管中,不易混淆。
3.每种试剂倾倒的用量约1~2ml,滴加时5~6滴即可。 酚酞建议1~2滴即可。
4.操作中注意记录实验现象,书写化学方程式。
5.注意实验操作的规范性。
①
②
我是探究小达人
鉴别:根据化学性质
现象:
化学方程式:
我是探究小达人
鉴别:根据化学性质
变红
不变色
无色酚酞
①
②
现象:
稀盐酸
产生气体
无明显现象
Na2CO3+2HCl = 2NaCl + H2O +CO2↑
①
②
现象:
化学方程式:
我是探究小达人
鉴别:根据化学性质
生成沉淀
无明显现象
Na2CO3 + Ca(OH)2 = CaCO3 ↓ + 2NaOH
①
②
氢氧化钙溶液
现象:
化学方程式:
我是探究小达人
鉴别:根据化学性质
生成沉淀
无明显现象
Na2CO3 + BaCl2 = BaCO3 ↓ + 2NaCl
①
②
氯化钡溶液
现象:
化学方程式:
我是探究小达人
鉴别:根据化学性质
我是探究小达人
鉴别:根据化学性质
1.不同类别物质的鉴别
紫色石蕊试液
鉴别:根据化学性质
根据物质的类别采用不同的方法,使其生成气体或沉淀等明显现象
生成气体: H+ + CO32- _____ + H2O ;
OH- + NH4+ _____+ H2O
生成沉淀:OH- + Mg2+ _____ ;OH- + Al3+ _______;
OH-+ Cu2+ _____ ; OH-+ Fe3+ _______
CO32- + Ca2+ _______;CO32- + Ba2+ ______
Cl- + Ag+ ________; SO42- + Ba2+ ______
根据物质的类别采用不同的方法,使其生成气体或沉淀等明显现象
生成气体: H+ + CO32- CO2 + H2O ;
OH- + NH4+ NH3 + H2O
生成沉淀:OH- + Mg2+ Mg(OH)2;OH- + Al3+ Al(OH)3;
OH-+ Cu2+ Cu(OH)2 ; OH-+ Fe3+ Fe(OH)3
CO32- + Ca2+ CaCO3;CO32- + Ba2+ BaCO3
Cl- + Ag+ AgCl; SO42- + Ba2+ BaSO4
例3:HCl HNO3
[ AgNO3 ]
Na2SO4 Na2CO3
[ HCl ]
NaOH Ca(OH)2
[ Na2CO3 ]
鉴别:根据化学性质
2.同种类别物质的鉴别
中考链接
(2018中考)无色液体X是下列四种物质中的一种。将其分成等量的三份,向其中分别加人少量的稀盐酸、石灰水、酚酞试液,产生的现象如下表。则X是下列选项中的( )
A.Na2CO3溶液 B.稀硫酸 C. NaOH溶液 D. NaCl 溶液
加入的物质 稀盐酸 石灰水 酚酞试液
现象 有气泡冒出 有白色沉淀 变成红色
被鉴别物中有酸、有Ca2+ (或Ba2+)时,
往往考虑加可溶性碳酸盐(如Na2CO3 、K2CO3 )鉴别。
思路提炼:
A
02
物 质 除 杂
除杂方法
(1) 过 滤 法
NaCl(泥沙)
KNO3 (NaCl)
(2) 结 晶 法
蒸发结晶
降温结晶
1. 物理方法
NaCl (KNO3)
除杂
2. 化学方法
除杂原则:
(1) 除杂:加入的试剂只与杂质反应
(2) 不减:不与主体物质反应(不能玉石俱焚)
(3) 不增:不能引入新的杂质(不能引狼入室)
(4) 易分:将杂质转化为另一种状态的物质便于分离
除杂方法
除杂:化学方法
3.(2016)除去CaCl2溶液中的少量盐酸:加入过量的CaCO3固体,过滤
2.(2016)除去NaNO3溶液中的少量Na2SO4:加入适量的BaCl2固体,过滤
除溶液中杂质的思路:
找杂质离子,除杂质离子,加主体物质中的离子
沉淀 气体 水 被置换
Ba(NO3)2
1.例如:除去NaCl溶液中的少量 NaOH:
√
除杂:化学方法
2.(2016)除去铜粉中的少量CuO固体:通入足量的CO气体并加热
3.(2017)除去CaO中混有的少量CaCO3:加入足量水,过滤
除固体中杂质的思路:
让杂质固体通过溶解、分解和置换等途径除去
1.例如:除去铜粉中的少量Fe粉:
高温
CuO +CO = Cu+CO2
√
除杂:化学方法
除气体中杂质的思路:
让杂质气体被吸收消耗或转化为主体物质
判断以下除去气体杂质的措施是否合理?
N2(O2) ——放入红热的木炭
CO2(HCl)——将混合气体通过NaOH溶液
CO2(CO) ——点燃
H2(HCl)——将混合气体通过NaOH溶液
×
√
×
×
通过灼热的铜网
通过灼热的Fe2O3转化为二氧化碳
通过AgNO3溶液
(2018中考)除去下列各组物质中的少量杂质,所用的试剂和方法都正确的是( )
物质 杂质 除杂质所用的试剂和方法
A CO2 HCl 将混合气体通过NaOH溶液
B NaCl固体 泥沙 加水,溶解,过滤,蒸发
C 铁粉 铜粉 加入过量的硫酸铜溶液,过滤
D NaNO3溶液 Na2SO4溶液 加入过量的Ba(NO3)2溶液
中考链接
B
思路提炼:
“过量”对于不同状态的物质无影响,可分离;
对于同状态的物质有影响,不易分离。
酸、碱、盐
之间的反应
离子间的反应
气体、沉淀、水
复分解反应
总结提升
化 学 中 考
鉴别和除杂复习探究
4分
4分
8分
4分
2017年
2015年
2018年
2016年
考情分析:鉴别和除杂两个选择题
01
物 质 鉴 别
鉴别原则
现象明显可区分,操作简便易实现
鉴别依据
2.物质的化学性质
1.物质的物理性质
①溶解性
②遇水吸热放热
③溶液的颜色
鉴别:根据物理性质
CuSO4
Na2CO3
CaCO3
加水
蓝色溶液
无色溶液
固体不溶解
—— CuSO4
—— Na2CO3
—— CaCO3
我是探究小达人
鉴别:根据化学性质
温 馨 提 示
鉴别:根据化学性质
1.实验前小组交流探讨鉴别方案。
2. 将①、②试剂瓶中的溶液分别倒入贴有
①、②标签的试管中,不易混淆。
3.每种试剂倾倒的用量约1~2ml,滴加时5~6滴即可。 酚酞建议1~2滴即可。
4.操作中注意记录实验现象,书写化学方程式。
5.注意实验操作的规范性。
①
②
我是探究小达人
鉴别:根据化学性质
现象:
化学方程式:
我是探究小达人
鉴别:根据化学性质
变红
不变色
无色酚酞
①
②
现象:
稀盐酸
产生气体
无明显现象
Na2CO3+2HCl = 2NaCl + H2O +CO2↑
①
②
现象:
化学方程式:
我是探究小达人
鉴别:根据化学性质
生成沉淀
无明显现象
Na2CO3 + Ca(OH)2 = CaCO3 ↓ + 2NaOH
①
②
氢氧化钙溶液
现象:
化学方程式:
我是探究小达人
鉴别:根据化学性质
生成沉淀
无明显现象
Na2CO3 + BaCl2 = BaCO3 ↓ + 2NaCl
①
②
氯化钡溶液
现象:
化学方程式:
我是探究小达人
鉴别:根据化学性质
我是探究小达人
鉴别:根据化学性质
1.不同类别物质的鉴别
紫色石蕊试液
鉴别:根据化学性质
根据物质的类别采用不同的方法,使其生成气体或沉淀等明显现象
生成气体: H+ + CO32- _____ + H2O ;
OH- + NH4+ _____+ H2O
生成沉淀:OH- + Mg2+ _____ ;OH- + Al3+ _______;
OH-+ Cu2+ _____ ; OH-+ Fe3+ _______
CO32- + Ca2+ _______;CO32- + Ba2+ ______
Cl- + Ag+ ________; SO42- + Ba2+ ______
根据物质的类别采用不同的方法,使其生成气体或沉淀等明显现象
生成气体: H+ + CO32- CO2 + H2O ;
OH- + NH4+ NH3 + H2O
生成沉淀:OH- + Mg2+ Mg(OH)2;OH- + Al3+ Al(OH)3;
OH-+ Cu2+ Cu(OH)2 ; OH-+ Fe3+ Fe(OH)3
CO32- + Ca2+ CaCO3;CO32- + Ba2+ BaCO3
Cl- + Ag+ AgCl; SO42- + Ba2+ BaSO4
例3:HCl HNO3
[ AgNO3 ]
Na2SO4 Na2CO3
[ HCl ]
NaOH Ca(OH)2
[ Na2CO3 ]
鉴别:根据化学性质
2.同种类别物质的鉴别
中考链接
(2018中考)无色液体X是下列四种物质中的一种。将其分成等量的三份,向其中分别加人少量的稀盐酸、石灰水、酚酞试液,产生的现象如下表。则X是下列选项中的( )
A.Na2CO3溶液 B.稀硫酸 C. NaOH溶液 D. NaCl 溶液
加入的物质 稀盐酸 石灰水 酚酞试液
现象 有气泡冒出 有白色沉淀 变成红色
被鉴别物中有酸、有Ca2+ (或Ba2+)时,
往往考虑加可溶性碳酸盐(如Na2CO3 、K2CO3 )鉴别。
思路提炼:
A
02
物 质 除 杂
除杂方法
(1) 过 滤 法
NaCl(泥沙)
KNO3 (NaCl)
(2) 结 晶 法
蒸发结晶
降温结晶
1. 物理方法
NaCl (KNO3)
除杂
2. 化学方法
除杂原则:
(1) 除杂:加入的试剂只与杂质反应
(2) 不减:不与主体物质反应(不能玉石俱焚)
(3) 不增:不能引入新的杂质(不能引狼入室)
(4) 易分:将杂质转化为另一种状态的物质便于分离
除杂方法
除杂:化学方法
3.(2016)除去CaCl2溶液中的少量盐酸:加入过量的CaCO3固体,过滤
2.(2016)除去NaNO3溶液中的少量Na2SO4:加入适量的BaCl2固体,过滤
除溶液中杂质的思路:
找杂质离子,除杂质离子,加主体物质中的离子
沉淀 气体 水 被置换
Ba(NO3)2
1.例如:除去NaCl溶液中的少量 NaOH:
√
除杂:化学方法
2.(2016)除去铜粉中的少量CuO固体:通入足量的CO气体并加热
3.(2017)除去CaO中混有的少量CaCO3:加入足量水,过滤
除固体中杂质的思路:
让杂质固体通过溶解、分解和置换等途径除去
1.例如:除去铜粉中的少量Fe粉:
高温
CuO +CO = Cu+CO2
√
除杂:化学方法
除气体中杂质的思路:
让杂质气体被吸收消耗或转化为主体物质
判断以下除去气体杂质的措施是否合理?
N2(O2) ——放入红热的木炭
CO2(HCl)——将混合气体通过NaOH溶液
CO2(CO) ——点燃
H2(HCl)——将混合气体通过NaOH溶液
×
√
×
×
通过灼热的铜网
通过灼热的Fe2O3转化为二氧化碳
通过AgNO3溶液
(2018中考)除去下列各组物质中的少量杂质,所用的试剂和方法都正确的是( )
物质 杂质 除杂质所用的试剂和方法
A CO2 HCl 将混合气体通过NaOH溶液
B NaCl固体 泥沙 加水,溶解,过滤,蒸发
C 铁粉 铜粉 加入过量的硫酸铜溶液,过滤
D NaNO3溶液 Na2SO4溶液 加入过量的Ba(NO3)2溶液
中考链接
B
思路提炼:
“过量”对于不同状态的物质无影响,可分离;
对于同状态的物质有影响,不易分离。
酸、碱、盐
之间的反应
离子间的反应
气体、沉淀、水
复分解反应
总结提升
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
