人教版化学九年级下册同步课时练习:第11单元 课题1 生活中常见的盐 第2课时 碳酸钠、碳酸氢钠、碳酸钙 复分解反应(word版 含答案)
文档属性
| 名称 | 人教版化学九年级下册同步课时练习:第11单元 课题1 生活中常见的盐 第2课时 碳酸钠、碳酸氢钠、碳酸钙 复分解反应(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 139.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-21 09:50:57 | ||
图片预览


文档简介
课题1 生活中常见的盐
第2课时 碳酸钠、碳酸氢钠、碳酸钙 复分解反应
知识点 1 碳酸钠、碳酸氢钠和碳酸钙
1.科学家们为改善我们的生活作出了很大的努力,其中为我国制碱工业作出巨大贡献的是 ( )
A.拉瓦锡 B.门捷列夫
C.汤姆生 D.侯德榜
2.下列物质的俗称与化学式相符的是 ( )
A.熟石灰CaO B.小苏打Na2CO3
C.纯碱 NaHCO3 D.烧碱 NaOH
3.下列关于碳酸钙的说法错误的是 ( )
A.大理石的主要成分是碳酸钙
B.实验室常用碳酸钙与稀硫酸反应制取二氧化碳
C.碳酸钙可用作补钙剂
D.用石灰浆粉刷墙壁,“出汗”后变成碳酸钙
4.选择适当盐的化学式填空。
(1)可用来治疗胃酸过多症的是 。
(2)常用作建筑材料的是 。
(3)焙制糕点所用的发酵粉的主要成分之一是 。
(4)可用于玻璃、造纸、纺织、洗涤剂的生产的是 。
(5)侯氏制碱法中的“碱”是 。
5.用如图示装置进行实验。
(1)若在试管①中加入少量大理石和稀盐酸,反应的化学方程式为
;该反应是实验室制取 气体的原理。
(2)将上述实验中的大理石换成Na2CO3或NaHCO3,实验中观察到的现象是
。写出 Na2CO3和NaHCO3分别与稀盐酸反应的化学方程式: ; 。
(3)组成里含有碳酸根离子或碳酸氢根离子(HC)的盐都能与盐酸反应,产生二氧化碳。故检验碳酸盐需用的试剂是 。
知识点 2 复分解反应的概念
6.下列有关复分解反应的说法不正确的是 ( )
A.反应物一定是两种化合物
B.反应一定伴随沉淀的生成
C.属于基本反应类型
D.反应中各元素的化合价不变
7.下列化学反应中属于复分解反应的是 ( )
A.Fe+CuSO4Cu+FeSO4
B.CO2+Ca(OH)2CaCO3↓+H2O
C.Fe2O3+3CO2Fe+3CO2
D.NaOH+HClNaCl+H2O
8.下列关于纯碱的说法和认识不正确的是 ( )
A.纯碱是碳酸钠的俗称,在分类上属于碱
B.纯碱溶于水,溶液显碱性,能使酚酞变红
C.盐湖“冬天捞碱”,即纯碱,这说明纯碱的溶解度受温度变化影响较大
D.纯碱可除去餐具表面的油污
9.从多角度看物质,有助于加深对物质的认识。Na2CO3是一种常见的盐,请回答:
(1)Na2CO3溶液显碱性,其pH (填“>”“<”或“=”)7。
(2)Na2CO3可以看成是碱和氧化物反应的产物。写出反应的化学方程式: 。
(3)Na2CO3作为反应物,写出符合AB+CDAD+CB的化学方程式:
。
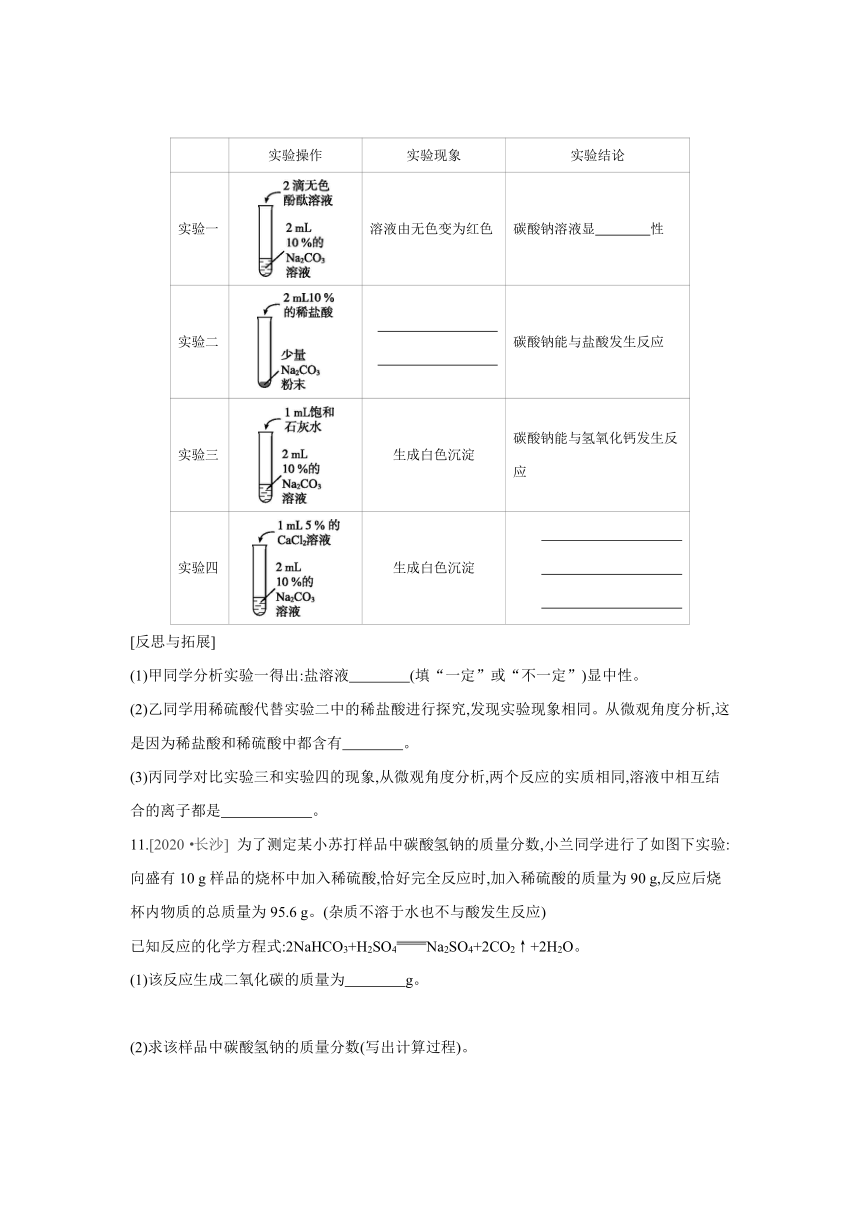
10.[2020·青岛] 化学课堂上,同学们分小组合作探究碳酸钠的性质,请你参与探究并填空。
[实验记录与分析]
实验操作 实验现象 实验结论
实验一 溶液由无色变为红色 碳酸钠溶液显 性
实验二 碳酸钠能与盐酸发生反应
实验三 生成白色沉淀 碳酸钠能与氢氧化钙发生反应
实验四 生成白色沉淀
[反思与拓展]
(1)甲同学分析实验一得出:盐溶液 (填“一定”或“不一定”)显中性。
(2)乙同学用稀硫酸代替实验二中的稀盐酸进行探究,发现实验现象相同。从微观角度分析,这是因为稀盐酸和稀硫酸中都含有 。
(3)丙同学对比实验三和实验四的现象,从微观角度分析,两个反应的实质相同,溶液中相互结合的离子都是 。
11.[2020·长沙] 为了测定某小苏打样品中碳酸氢钠的质量分数,小兰同学进行了如图下实验:向盛有10 g样品的烧杯中加入稀硫酸,恰好完全反应时,加入稀硫酸的质量为90 g,反应后烧杯内物质的总质量为95.6 g。(杂质不溶于水也不与酸发生反应)
已知反应的化学方程式:2NaHCO3+H2SO4Na2SO4+2CO2↑+2H2O。
(1)该反应生成二氧化碳的质量为 g。
(2)求该样品中碳酸氢钠的质量分数(写出计算过程)。
12.[2021·山西改编] 3月16日沙尘暴席卷我国西北地区,某校环境监测实践小组的同学们对沙尘暴的成分产生了浓厚的兴趣,在老师的指导下,他们开启了探究之旅。
[信息检索] 我国西北地区,含有大量钠盐的干涸盐湖和盐碱地总面积约有50万平方千米,为沙尘暴的形成埋下隐患。
[猜想假设] 此次沙尘暴中可能含有碳酸钠等碱性物质。
[进行实验] 取少量盐碱地的土壤与蒸馏水按1∶5的质量比在烧杯中混合,充分搅拌后静置,取上层清液,用示装置完成如图下实验。
项目 实验步骤 实验现象 实验结论
方案 ①挤压胶头滴管a,滴入过量X溶液 产生白 色沉淀 沙尘暴中含有Na2CO3,不含NaOH
②挤压胶头滴管b,滴入几滴酚酞溶液 酚酞溶液 不变色
[反思评价]
(1)步骤①中发生反应的化学方程式为 。
(2)若证明沙尘暴中含有Na2CO3,而无法确定是否含有NaOH,则X的化学式可能为 。反应的化学方程式为 。
答案
课题1 生活中常见的盐
第2课时 碳酸钠、碳酸氢钠、碳酸钙 复分解反应
1.D
2.D 熟石灰是Ca(OH)2,小苏打是NaHCO3, 纯碱是 Na2CO3。
3.B
4.(1)NaHCO3
(2)CaCO3
(3)NaHCO3
(4)Na2CO3
(5)Na2CO3
5.(1)CaCO3+2HClCaCl2+CO2↑+H2O
二氧化碳(或CO2)
(2)试管①中产生大量气泡,试管②中澄清石灰水变浑浊
Na2CO3+2HCl2NaCl+CO2↑+H2O
NaHCO3+HClNaCl+CO2↑+H2O
(3)稀盐酸和澄清石灰水
6.B
7.D 判断复分解反应要抓住两点:一是两种化合物反应生成两种新的化合物,二是一定要互相交换成分。B项虽然是两种化合物反应生成两种新的化合物,但没有互相交换成分。
8.A 纯碱不是碱,属于盐。
9.(1)> (2)2NaOH+CO2Na2CO3+H2O
(3)Na2CO3+Ca(OH)2CaCO3↓+2NaOH(合理即可)
10.[实验记录与分析] 碱 固体减少,固体表面有气泡产生 碳酸钠能和氯化钙发生反应
[反思与拓展] (1)不一定 (2)H+
(3)Ca2+和C
[实验记录与分析] 碳酸钠溶液能使无色酚酞溶液变红,说明碳酸钠溶液显碱性;盐酸和碳酸钠能反应生成二氧化碳气体;将氯化钙溶液加入碳酸钠溶液中生成白色沉淀,说明碳酸钠能和氯化钙发生反应。[反思与拓展] (1)碳酸钠溶液为盐溶液,其显碱性,说明盐溶液不一定显中性。(2)稀盐酸和稀硫酸都属于酸,能电离出氢离子,具有酸的通性,都能和碳酸钠反应生成二氧化碳。(3)实验三和实验四实质上都是溶液中的Ca2+和C相互结合生成白色碳酸钙沉淀。
11.(1)4.4
(2)解:设该样品中碳酸氢钠的质量为x。
2NaHCO3+H2SO4Na2SO4+2CO2↑+2H2O
168 88
x 4.4 g
=
x=8.4 g
该样品中碳酸氢钠的质量分数为×100%=84%。
答:该样品中碳酸氢钠的质量分数是84%。
(1)该反应生成二氧化碳的质量为10 g+90 g-95.6 g=4.4 g。
12.(1)Na2CO3+CaCl2CaCO3↓+2NaCl(或Na2CO3+BaCl2BaCO3↓+2NaCl,合理即可)
(2)Ba(OH)2[或Ca(OH)2]
Na2CO3+Ba(OH)2BaCO3↓+2NaOH[或Na2CO3+Ca(OH)2CaCO3↓+2NaOH]
(2)因为碳酸钠溶液、氢氧化钠溶液都显碱性,要检验碳酸钠存在,同时证明不含有氢氧化钠时,应该先加入足量的氯化钙(或硝酸钙、氯化钡等)溶液检验并且除去碳酸钠后,方可检验是否含有氢氧化钠;若检验碳酸钠时加入氢氧化钙或氢氧化钡溶液,则无法确定原溶液中是否含氢氧化钠。
第2课时 碳酸钠、碳酸氢钠、碳酸钙 复分解反应
知识点 1 碳酸钠、碳酸氢钠和碳酸钙
1.科学家们为改善我们的生活作出了很大的努力,其中为我国制碱工业作出巨大贡献的是 ( )
A.拉瓦锡 B.门捷列夫
C.汤姆生 D.侯德榜
2.下列物质的俗称与化学式相符的是 ( )
A.熟石灰CaO B.小苏打Na2CO3
C.纯碱 NaHCO3 D.烧碱 NaOH
3.下列关于碳酸钙的说法错误的是 ( )
A.大理石的主要成分是碳酸钙
B.实验室常用碳酸钙与稀硫酸反应制取二氧化碳
C.碳酸钙可用作补钙剂
D.用石灰浆粉刷墙壁,“出汗”后变成碳酸钙
4.选择适当盐的化学式填空。
(1)可用来治疗胃酸过多症的是 。
(2)常用作建筑材料的是 。
(3)焙制糕点所用的发酵粉的主要成分之一是 。
(4)可用于玻璃、造纸、纺织、洗涤剂的生产的是 。
(5)侯氏制碱法中的“碱”是 。
5.用如图示装置进行实验。
(1)若在试管①中加入少量大理石和稀盐酸,反应的化学方程式为
;该反应是实验室制取 气体的原理。
(2)将上述实验中的大理石换成Na2CO3或NaHCO3,实验中观察到的现象是
。写出 Na2CO3和NaHCO3分别与稀盐酸反应的化学方程式: ; 。
(3)组成里含有碳酸根离子或碳酸氢根离子(HC)的盐都能与盐酸反应,产生二氧化碳。故检验碳酸盐需用的试剂是 。
知识点 2 复分解反应的概念
6.下列有关复分解反应的说法不正确的是 ( )
A.反应物一定是两种化合物
B.反应一定伴随沉淀的生成
C.属于基本反应类型
D.反应中各元素的化合价不变
7.下列化学反应中属于复分解反应的是 ( )
A.Fe+CuSO4Cu+FeSO4
B.CO2+Ca(OH)2CaCO3↓+H2O
C.Fe2O3+3CO2Fe+3CO2
D.NaOH+HClNaCl+H2O
8.下列关于纯碱的说法和认识不正确的是 ( )
A.纯碱是碳酸钠的俗称,在分类上属于碱
B.纯碱溶于水,溶液显碱性,能使酚酞变红
C.盐湖“冬天捞碱”,即纯碱,这说明纯碱的溶解度受温度变化影响较大
D.纯碱可除去餐具表面的油污
9.从多角度看物质,有助于加深对物质的认识。Na2CO3是一种常见的盐,请回答:
(1)Na2CO3溶液显碱性,其pH (填“>”“<”或“=”)7。
(2)Na2CO3可以看成是碱和氧化物反应的产物。写出反应的化学方程式: 。
(3)Na2CO3作为反应物,写出符合AB+CDAD+CB的化学方程式:
。
10.[2020·青岛] 化学课堂上,同学们分小组合作探究碳酸钠的性质,请你参与探究并填空。
[实验记录与分析]
实验操作 实验现象 实验结论
实验一 溶液由无色变为红色 碳酸钠溶液显 性
实验二 碳酸钠能与盐酸发生反应
实验三 生成白色沉淀 碳酸钠能与氢氧化钙发生反应
实验四 生成白色沉淀
[反思与拓展]
(1)甲同学分析实验一得出:盐溶液 (填“一定”或“不一定”)显中性。
(2)乙同学用稀硫酸代替实验二中的稀盐酸进行探究,发现实验现象相同。从微观角度分析,这是因为稀盐酸和稀硫酸中都含有 。
(3)丙同学对比实验三和实验四的现象,从微观角度分析,两个反应的实质相同,溶液中相互结合的离子都是 。
11.[2020·长沙] 为了测定某小苏打样品中碳酸氢钠的质量分数,小兰同学进行了如图下实验:向盛有10 g样品的烧杯中加入稀硫酸,恰好完全反应时,加入稀硫酸的质量为90 g,反应后烧杯内物质的总质量为95.6 g。(杂质不溶于水也不与酸发生反应)
已知反应的化学方程式:2NaHCO3+H2SO4Na2SO4+2CO2↑+2H2O。
(1)该反应生成二氧化碳的质量为 g。
(2)求该样品中碳酸氢钠的质量分数(写出计算过程)。
12.[2021·山西改编] 3月16日沙尘暴席卷我国西北地区,某校环境监测实践小组的同学们对沙尘暴的成分产生了浓厚的兴趣,在老师的指导下,他们开启了探究之旅。
[信息检索] 我国西北地区,含有大量钠盐的干涸盐湖和盐碱地总面积约有50万平方千米,为沙尘暴的形成埋下隐患。
[猜想假设] 此次沙尘暴中可能含有碳酸钠等碱性物质。
[进行实验] 取少量盐碱地的土壤与蒸馏水按1∶5的质量比在烧杯中混合,充分搅拌后静置,取上层清液,用示装置完成如图下实验。
项目 实验步骤 实验现象 实验结论
方案 ①挤压胶头滴管a,滴入过量X溶液 产生白 色沉淀 沙尘暴中含有Na2CO3,不含NaOH
②挤压胶头滴管b,滴入几滴酚酞溶液 酚酞溶液 不变色
[反思评价]
(1)步骤①中发生反应的化学方程式为 。
(2)若证明沙尘暴中含有Na2CO3,而无法确定是否含有NaOH,则X的化学式可能为 。反应的化学方程式为 。
答案
课题1 生活中常见的盐
第2课时 碳酸钠、碳酸氢钠、碳酸钙 复分解反应
1.D
2.D 熟石灰是Ca(OH)2,小苏打是NaHCO3, 纯碱是 Na2CO3。
3.B
4.(1)NaHCO3
(2)CaCO3
(3)NaHCO3
(4)Na2CO3
(5)Na2CO3
5.(1)CaCO3+2HClCaCl2+CO2↑+H2O
二氧化碳(或CO2)
(2)试管①中产生大量气泡,试管②中澄清石灰水变浑浊
Na2CO3+2HCl2NaCl+CO2↑+H2O
NaHCO3+HClNaCl+CO2↑+H2O
(3)稀盐酸和澄清石灰水
6.B
7.D 判断复分解反应要抓住两点:一是两种化合物反应生成两种新的化合物,二是一定要互相交换成分。B项虽然是两种化合物反应生成两种新的化合物,但没有互相交换成分。
8.A 纯碱不是碱,属于盐。
9.(1)> (2)2NaOH+CO2Na2CO3+H2O
(3)Na2CO3+Ca(OH)2CaCO3↓+2NaOH(合理即可)
10.[实验记录与分析] 碱 固体减少,固体表面有气泡产生 碳酸钠能和氯化钙发生反应
[反思与拓展] (1)不一定 (2)H+
(3)Ca2+和C
[实验记录与分析] 碳酸钠溶液能使无色酚酞溶液变红,说明碳酸钠溶液显碱性;盐酸和碳酸钠能反应生成二氧化碳气体;将氯化钙溶液加入碳酸钠溶液中生成白色沉淀,说明碳酸钠能和氯化钙发生反应。[反思与拓展] (1)碳酸钠溶液为盐溶液,其显碱性,说明盐溶液不一定显中性。(2)稀盐酸和稀硫酸都属于酸,能电离出氢离子,具有酸的通性,都能和碳酸钠反应生成二氧化碳。(3)实验三和实验四实质上都是溶液中的Ca2+和C相互结合生成白色碳酸钙沉淀。
11.(1)4.4
(2)解:设该样品中碳酸氢钠的质量为x。
2NaHCO3+H2SO4Na2SO4+2CO2↑+2H2O
168 88
x 4.4 g
=
x=8.4 g
该样品中碳酸氢钠的质量分数为×100%=84%。
答:该样品中碳酸氢钠的质量分数是84%。
(1)该反应生成二氧化碳的质量为10 g+90 g-95.6 g=4.4 g。
12.(1)Na2CO3+CaCl2CaCO3↓+2NaCl(或Na2CO3+BaCl2BaCO3↓+2NaCl,合理即可)
(2)Ba(OH)2[或Ca(OH)2]
Na2CO3+Ba(OH)2BaCO3↓+2NaOH[或Na2CO3+Ca(OH)2CaCO3↓+2NaOH]
(2)因为碳酸钠溶液、氢氧化钠溶液都显碱性,要检验碳酸钠存在,同时证明不含有氢氧化钠时,应该先加入足量的氯化钙(或硝酸钙、氯化钡等)溶液检验并且除去碳酸钠后,方可检验是否含有氢氧化钠;若检验碳酸钠时加入氢氧化钙或氢氧化钡溶液,则无法确定原溶液中是否含氢氧化钠。
同课章节目录
