人教版化学九年级下册同步课时练习:第10单元 课题1 常见的酸和碱 第2课时 浓硫酸 酸的化学性质(word版 含答案)
文档属性
| 名称 | 人教版化学九年级下册同步课时练习:第10单元 课题1 常见的酸和碱 第2课时 浓硫酸 酸的化学性质(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 235.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-21 09:53:57 | ||
图片预览


文档简介
课题1 常见的酸和碱
第2课时 浓硫酸 酸的化学性质
知识点 1 浓硫酸的吸水性和腐蚀性
1.配制稀硫酸的部分操作过程如图示,其中错误的是 ( )
2.若浓盐酸和浓硫酸都敞口放置在空气中,下列说法正确的是 ( )
A.都产生白雾
B.都能闻到刺激性气味
C.溶质的质量分数都减小
D.质量都减少
3.实验室中常需要使用硫酸。
(1)用小木棍蘸取少量浓硫酸,放置一会儿后,可观察到 。
这是因为浓硫酸具有 (填“吸水”或“脱水”)性,属于 (填“化学”或“物理”)性质。
(2)如图示装置可用于除去氧气中混有的水蒸气,将混合气体从 (填“a”或“b”)端通入浓硫酸中。这是利用了浓硫酸的 (填浓硫酸的性质)。
(3)浓硫酸具有强烈的腐蚀性。如图果不慎沾到皮肤或衣服上,应立即 ,
然后再 。
(4)将98%的浓硫酸稀释为稀硫酸时,一定要将 沿烧杯壁缓慢地注入 里,并用 不断搅拌,这是为了防止 使水沸腾,导致硫酸液滴飞溅。
知识点 2 酸的化学性质
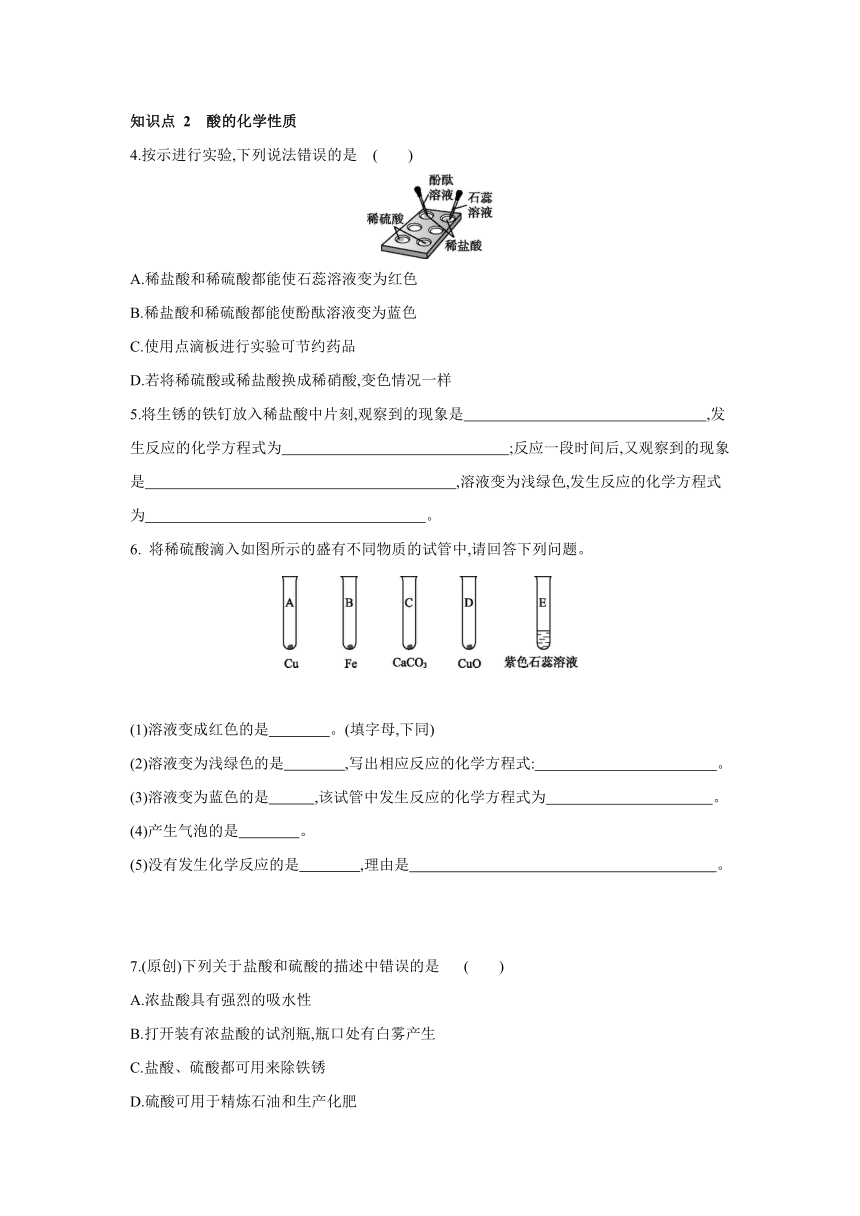
4.按示进行实验,下列说法错误的是 ( )
A.稀盐酸和稀硫酸都能使石蕊溶液变为红色
B.稀盐酸和稀硫酸都能使酚酞溶液变为蓝色
C.使用点滴板进行实验可节约药品
D.若将稀硫酸或稀盐酸换成稀硝酸,变色情况一样
5.将生锈的铁钉放入稀盐酸中片刻,观察到的现象是 ,发生反应的化学方程式为 ;反应一段时间后,又观察到的现象是 ,溶液变为浅绿色,发生反应的化学方程式为 。
6. 将稀硫酸滴入如图所示的盛有不同物质的试管中,请回答下列问题。
(1)溶液变成红色的是 。(填字母,下同)
(2)溶液变为浅绿色的是 ,写出相应反应的化学方程式: 。
(3)溶液变为蓝色的是 ,该试管中发生反应的化学方程式为 。
(4)产生气泡的是 。
(5)没有发生化学反应的是 ,理由是 。
7.(原创)下列关于盐酸和硫酸的描述中错误的是 ( )
A.浓盐酸具有强烈的吸水性
B.打开装有浓盐酸的试剂瓶,瓶口处有白雾产生
C.盐酸、硫酸都可用来除铁锈
D.硫酸可用于精炼石油和生产化肥
8.实验室有两瓶失去标签的溶液,分别是稀盐酸和氯化钠溶液,下列试剂不能将其鉴别开的是 ( )
A.镁条 B.碳酸钙固体
C.酚酞溶液 D.石蕊溶液
9.在一定条件下,下列转化不能通过加酸一步实现的是 ( )
A.Fe2O3→FeCl3 B.Cu→CuCl2
C.CuO→CuSO4 D.Fe→FeSO4
10.学习完酸的化学性质,小浩构建了如图所示知识网络。请回答下列问题。
(1)溶液X是一种酸,则试剂A的名称是 。
(2)若X是稀硫酸,B是氧化物,则B的化学式为 。
(3)若X是稀盐酸,C是单质,则C的名称为 。
(4)若X是稀盐酸,D是碳酸钙,则X与D反应的化学方程式为 。
11.浓硫酸具有强腐蚀性,主要原因有两点:
(1)浓硫酸具有吸水性,同时溶于水时 热量。浓硫酸可以用作气体 (写出3种气体)的干燥剂。
(2)浓硫酸具有脱水性,能将小木棍、蔗糖这类物质中的氢元素和氧元素按水的组成比脱去。
①用小木棍蘸取浓硫酸放置一段时间后,观察到的现象是 。
②蔗糖化学式是C12H22O11,其中氢、氧原子个数比为 ,如图果蔗糖完全脱水,生成的碳和水的质量比为 。
12.小明将未经砂纸打磨的铝条放入盛有足量稀盐酸的密闭容器中,用压强传感器测得容器内气体压强随反应时间变化的曲线如图所示。回答下列问题。
(1)ab段发生反应的化学方程式为 。
(2)bc段发生反应的化学方程式为 。
(3)cd段压强变化的主要原因是 。
13.盐酸是一种重要的化工产品,也是实验室中重要的化学试剂。
(1)增大压强,氯化氢由气态变为液态,从微观的角度分析该变化过程中改变的是 。
(2)在盐酸中加入过量的铁粉充分反应。
①可以观察到的现象是 。
②如图表示该反应前后溶液中存在的主要离子,请写出每种图形代表的离子(填离子符号)。
③下列金属中能与盐酸发生类似反应的是 (填字母,下同)。
A.Cu B.Mg
C.Al D.Ag
(3)氢溴酸(HBr)的化学性质与盐酸非常相似,下列物质不可能与氢溴酸反应的是 。
A.Fe B.CuO
C.Ag
14. [2021·长沙改编] 为加深对酸的主要性质的认识,通过实验解释生活中的一些现象,在学完酸的化学性质后,老师组织同学们完成了以下实验活动。
实验一:按如图所示完成实验。
实验二:将生锈的铁钉加入足量的稀盐酸中。
(1)实验一中,观察到石蕊溶液变为 色。
(2)实验二中,观察到溶液由无色变成黄色,一段时间后有气泡产生,请解释出现这两个现象的原因: 。
[应用与拓展]
(3)请设计实验方案除去铜粉中混有的氧化铜,得到纯净的铜:
。
答案
课题1 常见的酸和碱
第2课时 浓硫酸 酸的化学性质
1.C 浓硫酸的密度比水大,稀释时应该将浓硫酸沿烧杯壁缓缓倒入水中,并用玻璃棒不断搅拌。
2.C 浓盐酸挥发出氯化氢气体,浓硫酸吸收水分,都导致溶质的质量分数减小。
3.(1)小木棍蘸有浓硫酸的部位变黑 脱水 化学
(2)a 吸水性
(3)用大量水冲洗 涂上3%~5%的碳酸氢钠溶液
(4)浓硫酸 水 玻璃棒
浓硫酸溶于水放出大量的热
4.B
5.铁锈消失,溶液由无色变为黄色
Fe2O3+6HCl2FeCl3+3H2O
铁钉表面有气泡产生
Fe+2HClFeCl2+H2↑
6.(1)E (2)B Fe+H2SO4FeSO4+H2↑
(3)D CuO+H2SO4CuSO4+H2O
(4)BC
(5)A 在金属活动性顺序里,Cu位于H的后面
7.A 浓硫酸具有吸水性,浓盐酸没有吸水性。
8.C 酚酞溶液在稀盐酸和氯化钠溶液中都是无色的,故不能将二者鉴别开。
9.B
10.(1)紫色石蕊溶液 (2)Fe2O3 (3)铁
(4)2HCl+CaCO3CaCl2+CO2↑+H2O
(1)酸溶液能使紫色石蕊溶液变红,故试剂A为紫色石蕊溶液。(2)因为Fe2O3能与稀硫酸反应生成黄色的Fe2(SO4)3溶液,故B为Fe2O3。(3)因为盐酸能与铁反应生成浅绿色的FeCl2溶液,故C为铁。(4)稀盐酸能与碳酸钙反应生成氯化钙、水和二氧化碳。
11.(1)放出 H2、O2、CO2(合理即可)
(2)①小木棍蘸有浓硫酸的部位表面变黑
②2∶1 8∶11
12.(1)Al2O3+6HCl2AlCl3+3H2O
(2)2Al+6HCl2AlCl3+3H2↑
(3)气体温度降低
13.(1)分子间的间隔
(2)①固体减少,有气泡产生,溶液由无色逐渐变为浅绿色 ②H+ Cl- Fe2+ ③BC
(3)C
14.(1)红
(2)氧化铁先与盐酸反应生成氯化铁,此时溶液变为黄色,氧化铁反应完毕后,内部未生锈的铁与盐酸反应生成氢气,有气泡产生
(3)向混合物中加入足量稀盐酸,充分反应后过滤、洗涤、干燥,得到纯净的铜(合理即可)
(3)由于铜在金属活动性中位于氢后,不与稀盐酸、稀硫酸反应,而氧化铜属于金属氧化物,能与稀盐酸、稀硫酸反应,所以采用加入足量的稀盐酸或稀硫酸充分反应后再过滤的方法除去铜粉中混有的氧化铜。
第2课时 浓硫酸 酸的化学性质
知识点 1 浓硫酸的吸水性和腐蚀性
1.配制稀硫酸的部分操作过程如图示,其中错误的是 ( )
2.若浓盐酸和浓硫酸都敞口放置在空气中,下列说法正确的是 ( )
A.都产生白雾
B.都能闻到刺激性气味
C.溶质的质量分数都减小
D.质量都减少
3.实验室中常需要使用硫酸。
(1)用小木棍蘸取少量浓硫酸,放置一会儿后,可观察到 。
这是因为浓硫酸具有 (填“吸水”或“脱水”)性,属于 (填“化学”或“物理”)性质。
(2)如图示装置可用于除去氧气中混有的水蒸气,将混合气体从 (填“a”或“b”)端通入浓硫酸中。这是利用了浓硫酸的 (填浓硫酸的性质)。
(3)浓硫酸具有强烈的腐蚀性。如图果不慎沾到皮肤或衣服上,应立即 ,
然后再 。
(4)将98%的浓硫酸稀释为稀硫酸时,一定要将 沿烧杯壁缓慢地注入 里,并用 不断搅拌,这是为了防止 使水沸腾,导致硫酸液滴飞溅。
知识点 2 酸的化学性质
4.按示进行实验,下列说法错误的是 ( )
A.稀盐酸和稀硫酸都能使石蕊溶液变为红色
B.稀盐酸和稀硫酸都能使酚酞溶液变为蓝色
C.使用点滴板进行实验可节约药品
D.若将稀硫酸或稀盐酸换成稀硝酸,变色情况一样
5.将生锈的铁钉放入稀盐酸中片刻,观察到的现象是 ,发生反应的化学方程式为 ;反应一段时间后,又观察到的现象是 ,溶液变为浅绿色,发生反应的化学方程式为 。
6. 将稀硫酸滴入如图所示的盛有不同物质的试管中,请回答下列问题。
(1)溶液变成红色的是 。(填字母,下同)
(2)溶液变为浅绿色的是 ,写出相应反应的化学方程式: 。
(3)溶液变为蓝色的是 ,该试管中发生反应的化学方程式为 。
(4)产生气泡的是 。
(5)没有发生化学反应的是 ,理由是 。
7.(原创)下列关于盐酸和硫酸的描述中错误的是 ( )
A.浓盐酸具有强烈的吸水性
B.打开装有浓盐酸的试剂瓶,瓶口处有白雾产生
C.盐酸、硫酸都可用来除铁锈
D.硫酸可用于精炼石油和生产化肥
8.实验室有两瓶失去标签的溶液,分别是稀盐酸和氯化钠溶液,下列试剂不能将其鉴别开的是 ( )
A.镁条 B.碳酸钙固体
C.酚酞溶液 D.石蕊溶液
9.在一定条件下,下列转化不能通过加酸一步实现的是 ( )
A.Fe2O3→FeCl3 B.Cu→CuCl2
C.CuO→CuSO4 D.Fe→FeSO4
10.学习完酸的化学性质,小浩构建了如图所示知识网络。请回答下列问题。
(1)溶液X是一种酸,则试剂A的名称是 。
(2)若X是稀硫酸,B是氧化物,则B的化学式为 。
(3)若X是稀盐酸,C是单质,则C的名称为 。
(4)若X是稀盐酸,D是碳酸钙,则X与D反应的化学方程式为 。
11.浓硫酸具有强腐蚀性,主要原因有两点:
(1)浓硫酸具有吸水性,同时溶于水时 热量。浓硫酸可以用作气体 (写出3种气体)的干燥剂。
(2)浓硫酸具有脱水性,能将小木棍、蔗糖这类物质中的氢元素和氧元素按水的组成比脱去。
①用小木棍蘸取浓硫酸放置一段时间后,观察到的现象是 。
②蔗糖化学式是C12H22O11,其中氢、氧原子个数比为 ,如图果蔗糖完全脱水,生成的碳和水的质量比为 。
12.小明将未经砂纸打磨的铝条放入盛有足量稀盐酸的密闭容器中,用压强传感器测得容器内气体压强随反应时间变化的曲线如图所示。回答下列问题。
(1)ab段发生反应的化学方程式为 。
(2)bc段发生反应的化学方程式为 。
(3)cd段压强变化的主要原因是 。
13.盐酸是一种重要的化工产品,也是实验室中重要的化学试剂。
(1)增大压强,氯化氢由气态变为液态,从微观的角度分析该变化过程中改变的是 。
(2)在盐酸中加入过量的铁粉充分反应。
①可以观察到的现象是 。
②如图表示该反应前后溶液中存在的主要离子,请写出每种图形代表的离子(填离子符号)。
③下列金属中能与盐酸发生类似反应的是 (填字母,下同)。
A.Cu B.Mg
C.Al D.Ag
(3)氢溴酸(HBr)的化学性质与盐酸非常相似,下列物质不可能与氢溴酸反应的是 。
A.Fe B.CuO
C.Ag
14. [2021·长沙改编] 为加深对酸的主要性质的认识,通过实验解释生活中的一些现象,在学完酸的化学性质后,老师组织同学们完成了以下实验活动。
实验一:按如图所示完成实验。
实验二:将生锈的铁钉加入足量的稀盐酸中。
(1)实验一中,观察到石蕊溶液变为 色。
(2)实验二中,观察到溶液由无色变成黄色,一段时间后有气泡产生,请解释出现这两个现象的原因: 。
[应用与拓展]
(3)请设计实验方案除去铜粉中混有的氧化铜,得到纯净的铜:
。
答案
课题1 常见的酸和碱
第2课时 浓硫酸 酸的化学性质
1.C 浓硫酸的密度比水大,稀释时应该将浓硫酸沿烧杯壁缓缓倒入水中,并用玻璃棒不断搅拌。
2.C 浓盐酸挥发出氯化氢气体,浓硫酸吸收水分,都导致溶质的质量分数减小。
3.(1)小木棍蘸有浓硫酸的部位变黑 脱水 化学
(2)a 吸水性
(3)用大量水冲洗 涂上3%~5%的碳酸氢钠溶液
(4)浓硫酸 水 玻璃棒
浓硫酸溶于水放出大量的热
4.B
5.铁锈消失,溶液由无色变为黄色
Fe2O3+6HCl2FeCl3+3H2O
铁钉表面有气泡产生
Fe+2HClFeCl2+H2↑
6.(1)E (2)B Fe+H2SO4FeSO4+H2↑
(3)D CuO+H2SO4CuSO4+H2O
(4)BC
(5)A 在金属活动性顺序里,Cu位于H的后面
7.A 浓硫酸具有吸水性,浓盐酸没有吸水性。
8.C 酚酞溶液在稀盐酸和氯化钠溶液中都是无色的,故不能将二者鉴别开。
9.B
10.(1)紫色石蕊溶液 (2)Fe2O3 (3)铁
(4)2HCl+CaCO3CaCl2+CO2↑+H2O
(1)酸溶液能使紫色石蕊溶液变红,故试剂A为紫色石蕊溶液。(2)因为Fe2O3能与稀硫酸反应生成黄色的Fe2(SO4)3溶液,故B为Fe2O3。(3)因为盐酸能与铁反应生成浅绿色的FeCl2溶液,故C为铁。(4)稀盐酸能与碳酸钙反应生成氯化钙、水和二氧化碳。
11.(1)放出 H2、O2、CO2(合理即可)
(2)①小木棍蘸有浓硫酸的部位表面变黑
②2∶1 8∶11
12.(1)Al2O3+6HCl2AlCl3+3H2O
(2)2Al+6HCl2AlCl3+3H2↑
(3)气体温度降低
13.(1)分子间的间隔
(2)①固体减少,有气泡产生,溶液由无色逐渐变为浅绿色 ②H+ Cl- Fe2+ ③BC
(3)C
14.(1)红
(2)氧化铁先与盐酸反应生成氯化铁,此时溶液变为黄色,氧化铁反应完毕后,内部未生锈的铁与盐酸反应生成氢气,有气泡产生
(3)向混合物中加入足量稀盐酸,充分反应后过滤、洗涤、干燥,得到纯净的铜(合理即可)
(3)由于铜在金属活动性中位于氢后,不与稀盐酸、稀硫酸反应,而氧化铜属于金属氧化物,能与稀盐酸、稀硫酸反应,所以采用加入足量的稀盐酸或稀硫酸充分反应后再过滤的方法除去铜粉中混有的氧化铜。
同课章节目录
