人教版化学九年级下册同步课时练习:第10单元 课题2 酸和碱的中和反应 第2课时 溶液酸碱度的表示法——pH(word版 含答案)
文档属性
| 名称 | 人教版化学九年级下册同步课时练习:第10单元 课题2 酸和碱的中和反应 第2课时 溶液酸碱度的表示法——pH(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 136.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-21 09:54:19 | ||
图片预览


文档简介
课题2 酸和碱的中和反应
第2课时 溶液酸碱度的表示法——pH
知识点 1 溶液酸碱度的表示法——pH
1.常温下,下列说法错误的是 ( )
A.pH=2的溶液显酸性
B.pH=7的溶液显中性
C.溶液的pH由5变为2,其酸性减弱
D.溶液的pH由10变为12,其碱性增强
2.实验测得人体内或排出的一些液体的pH如图下,其中酸性最强的是 ( )
A.唾液 (6.6~7.1) B.胃液 (0.9~1.5)
C.汗液 (6.6~7.6) D.血浆 (7.35~7.45)
3.某同学用pH试纸测定溶液的酸碱度,下列操作或结论正确的是 ( )
A.用pH试纸直接蘸取待测溶液
B.先用水润湿pH试纸再测定溶液的酸碱度
C.用pH试纸测得石灰水的pH=9.5
D.用pH试纸测得盐酸的pH=1
4.实验室有A、B两种溶液,A溶液能使紫色石蕊溶液变红,B溶液能使无色酚酞溶液变红,则A、B两种溶液的pH的大小关系是A (填“大于”或“小于”)B。
知识点 2 溶液pH的测定方法
5.测量雨水pH的方法:收集雨水样品,先将 放在 上,再用 蘸取待测雨水,滴到 上,再把试纸显示的颜色与 比较,读出雨水的pH。
知识点 3 溶液酸碱性的重要意义
6.下表是某些农作物生长最适宜的pH范围。某省有些地方的土壤呈弱碱性,你认为该地区最不适宜种植的农作物是 ( )
农作物 小麦 玉米 大豆 柑橘
pH 6.2~7.5 6.5~7.5 6.5~7.5 5.0~6.5
A.小麦 B.玉米
C.大豆 D.柑橘
7.(1)小明同学用pH试纸测得某洗发剂的pH略大于7,则该洗发剂显 性;测得某护发剂的pH略小于7,则该护发剂显 性。
(2)厕所清洁剂能使石蕊变红,则其pH 7,厨房清洁剂能使石蕊变蓝,则其pH 7。将两种清洁剂混合在一起,三者均失去清洁能力,这是因为 。
(3)小明同学测得家乡雨水的pH为6.2,则该雨水显 性,那么该雨水是酸雨吗 ,你的理由是 。
8.[2020·上海] 下表为四种食物的近似pH,你认为胃酸过多的患者不宜多吃的食物是 ( )
食物 苹果汁 豆浆 玉米粥 鸡蛋清
pH 2.9~3.3 7.4~7.9 6.8~8.0 7.6~8.0
A.苹果汁 B.豆浆
C.玉米粥 D.鸡蛋清
9.[2020·昆明] 下列能使紫色石蕊溶液和无色酚酞溶液均变色的是 ( )
A.pH=1的盐酸
B.pH=3的硫酸
C.pH=7的氯化钠溶液
D.pH=14的氢氧化钾溶液
10.下列有关测定氢氧化钠溶液pH的实验操作或描述,你认为正确的是 ( )
A.用镊子夹取pH试纸直接伸入氢氧化钠溶液中测定
B.先用蒸馏水将pH试纸润湿,再用滴管吸取氢氧化钠溶液滴到pH试纸上测定
C.用洁净、干燥的玻璃棒蘸取氢氧化钠溶液滴到pH试纸上,再与标准比色卡对照
D.用pH试纸测得该氢氧化钠溶液的pH=12.6
11.用pH试纸测定石灰水的pH,如图示,则测得的结果与实际值相比 ( )
A.偏高 B.偏低
C.相等 D.无法确定
12.(原创)某同学在实验室测得几种液体的pH如图下表,请先填表,再结合该表填空。(物质分类填“酸”“碱”“盐”或“氧化物”)
物质 盐酸 (NH4)2SO4溶液 Na2SO4溶液 H2O Na2CO3溶液 NaOH溶液
pH <7 <7 =7 =7 >7 >7
物质 分类 氧化物
滴加酚酞 后颜色
滴加石蕊 后颜色
由上述测定结果可知:酸性溶液不一定都是 溶液,碱性溶液不一定都是 溶液。
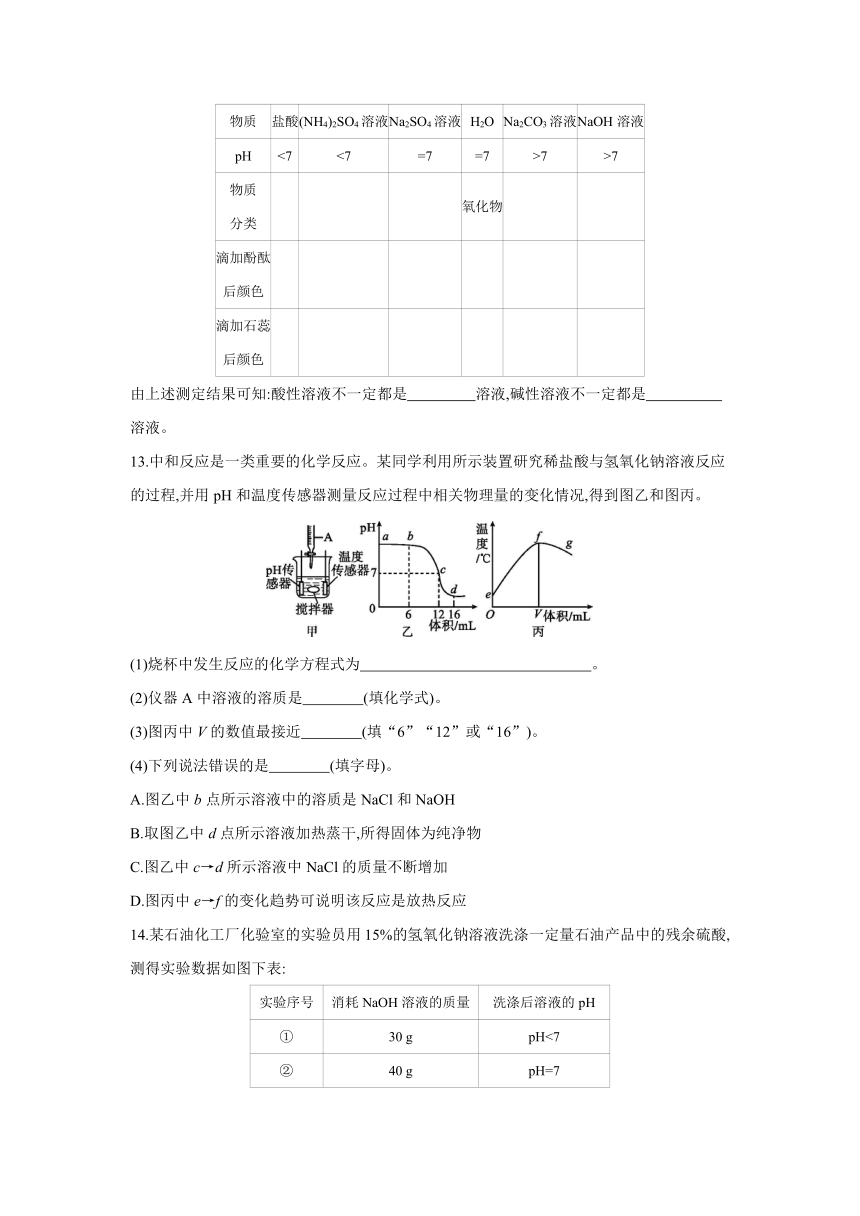
13.中和反应是一类重要的化学反应。某同学利用所示装置研究稀盐酸与氢氧化钠溶液反应的过程,并用pH和温度传感器测量反应过程中相关物理量的变化情况,得到图乙和图丙。
(1)烧杯中发生反应的化学方程式为 。
(2)仪器A中溶液的溶质是 (填化学式)。
(3)图丙中V的数值最接近 (填“6”“12”或“16”)。
(4)下列说法错误的是 (填字母)。
A.图乙中b点所示溶液中的溶质是NaCl和NaOH
B.取图乙中d点所示溶液加热蒸干,所得固体为纯净物
C.图乙中c→d所示溶液中NaCl的质量不断增加
D.图丙中e→f的变化趋势可说明该反应是放热反应
14.某石油化工厂化验室的实验员用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,测得实验数据如图下表:
实验序号 消耗NaOH溶液的质量 洗涤后溶液的pH
① 30 g pH<7
② 40 g pH=7
③ 50 g pH>7
(1)欲计算出上述一定量石油产品中所含H2SO4的质量,应该选择实验 (填实验序号)的数据。
(2)若本实验中石油产品中残余硫酸溶液的质量为100 g,请计算该残余硫酸溶液中溶质的质量分数。(写出计算过程)
15. [2021·苏州] 如图室温下稀盐酸与稀氢氧化钠溶液反应过程中pH的变化曲线。下列说法不正确的是 ( )
A.实验时将稀盐酸逐滴滴入稀氢氧化钠溶液中
B.a点到b点pH变化的原因是H+和OH-发生反应
C.b点时,参加反应的HCl与NaOH的质量比为36.5 40
D.c点时,溶液中Na+的个数大于Cl-的个数
答案
课题2 酸和碱的中和反应
第2课时 溶液酸碱度的表示法——pH
1.C 溶液的pH由5变为2,数值减小,酸性增强。
2.B
3.D 不能用pH试纸直接蘸取待测溶液,以防污染待测溶液;先用水润湿pH试纸再测定溶液的酸碱度,会稀释滴在pH试纸上的待测液,所测pH可能不准确;普通pH试纸测出的pH只能是整数。
4.小于
A溶液能使紫色石蕊溶液变红,说明A溶液显酸性,pH<7;B溶液能使无色酚酞溶液变红,说明B溶液显碱性,pH>7。
5.pH试纸 洁净的玻璃片(合理即可) 玻璃棒 pH试纸 标准比色卡
6.D
7.(1)碱 酸
(2)小于(或<) 大于(或>) 酸和碱发生了中和反应
(3)酸 不是 只有pH小于5.6的雨水才是酸雨
8.A 9.D
10.C 测定溶液pH的正确操作是在洁净干燥的玻璃片或白瓷板上放一小片pH试纸,用洁净干燥的玻璃棒蘸取待测液滴在pH试纸上,再与标准比色卡对照,读出的数值是整数。
11.B 石灰水是氢氧化钙的水溶液,显碱性,先将pH试纸用蒸馏水润湿,会使测得的pH比实际值低。
12.
物质 盐酸 (NH4)2SO4溶液 Na2SO4溶液 H2O Na2CO3溶液 NaOH溶液
pH <7 <7 =7 =7 >7 >7
物质分类 酸 盐 盐 氧化物 盐 碱
滴加酚酞 后颜色 无色 无色 无色 无色 红色 红色
滴加石蕊 后颜色 红色 红色 紫色 紫色 蓝色 蓝色
酸 碱
13.(1)NaOH+HClNaCl+H2O
(2)HCl (3)12 (4)C
(2)从图乙可看出,溶液的起始pH大于7,则烧杯中原溶液是氢氧化钠溶液,则仪器A中是稀盐酸。(4)图乙中cd过程,反应已经停止,盐酸过量,所以氯化钠的质量不会增加。
14.(1)②
(2)解:设该残余硫酸溶液中溶质的质量为x。
2NaOH + H2SO4Na2SO4+2H2O
80 98
40 g×15% x
= x=7.35 g
该残余硫酸溶液中溶质的质量分数为×100%=7.35%。
答:该残余硫酸溶液中溶质的质量分数为7.35%。
15.D 图中溶液的pH随滴入液体体积的增加而逐渐减小,说明是将稀盐酸逐滴滴入稀氢氧化钠溶液中;a点到b点pH的变化,是因为氢氧化钠和盐酸反应,其实质是H+和OH-发生反应;b点时,二者恰好完全反应,利用化学方程式可知,参加反应的HCl与NaOH的质量比为36.5 40;c点时,盐酸过量,溶液中Na+的个数小于Cl-的个数。
第2课时 溶液酸碱度的表示法——pH
知识点 1 溶液酸碱度的表示法——pH
1.常温下,下列说法错误的是 ( )
A.pH=2的溶液显酸性
B.pH=7的溶液显中性
C.溶液的pH由5变为2,其酸性减弱
D.溶液的pH由10变为12,其碱性增强
2.实验测得人体内或排出的一些液体的pH如图下,其中酸性最强的是 ( )
A.唾液 (6.6~7.1) B.胃液 (0.9~1.5)
C.汗液 (6.6~7.6) D.血浆 (7.35~7.45)
3.某同学用pH试纸测定溶液的酸碱度,下列操作或结论正确的是 ( )
A.用pH试纸直接蘸取待测溶液
B.先用水润湿pH试纸再测定溶液的酸碱度
C.用pH试纸测得石灰水的pH=9.5
D.用pH试纸测得盐酸的pH=1
4.实验室有A、B两种溶液,A溶液能使紫色石蕊溶液变红,B溶液能使无色酚酞溶液变红,则A、B两种溶液的pH的大小关系是A (填“大于”或“小于”)B。
知识点 2 溶液pH的测定方法
5.测量雨水pH的方法:收集雨水样品,先将 放在 上,再用 蘸取待测雨水,滴到 上,再把试纸显示的颜色与 比较,读出雨水的pH。
知识点 3 溶液酸碱性的重要意义
6.下表是某些农作物生长最适宜的pH范围。某省有些地方的土壤呈弱碱性,你认为该地区最不适宜种植的农作物是 ( )
农作物 小麦 玉米 大豆 柑橘
pH 6.2~7.5 6.5~7.5 6.5~7.5 5.0~6.5
A.小麦 B.玉米
C.大豆 D.柑橘
7.(1)小明同学用pH试纸测得某洗发剂的pH略大于7,则该洗发剂显 性;测得某护发剂的pH略小于7,则该护发剂显 性。
(2)厕所清洁剂能使石蕊变红,则其pH 7,厨房清洁剂能使石蕊变蓝,则其pH 7。将两种清洁剂混合在一起,三者均失去清洁能力,这是因为 。
(3)小明同学测得家乡雨水的pH为6.2,则该雨水显 性,那么该雨水是酸雨吗 ,你的理由是 。
8.[2020·上海] 下表为四种食物的近似pH,你认为胃酸过多的患者不宜多吃的食物是 ( )
食物 苹果汁 豆浆 玉米粥 鸡蛋清
pH 2.9~3.3 7.4~7.9 6.8~8.0 7.6~8.0
A.苹果汁 B.豆浆
C.玉米粥 D.鸡蛋清
9.[2020·昆明] 下列能使紫色石蕊溶液和无色酚酞溶液均变色的是 ( )
A.pH=1的盐酸
B.pH=3的硫酸
C.pH=7的氯化钠溶液
D.pH=14的氢氧化钾溶液
10.下列有关测定氢氧化钠溶液pH的实验操作或描述,你认为正确的是 ( )
A.用镊子夹取pH试纸直接伸入氢氧化钠溶液中测定
B.先用蒸馏水将pH试纸润湿,再用滴管吸取氢氧化钠溶液滴到pH试纸上测定
C.用洁净、干燥的玻璃棒蘸取氢氧化钠溶液滴到pH试纸上,再与标准比色卡对照
D.用pH试纸测得该氢氧化钠溶液的pH=12.6
11.用pH试纸测定石灰水的pH,如图示,则测得的结果与实际值相比 ( )
A.偏高 B.偏低
C.相等 D.无法确定
12.(原创)某同学在实验室测得几种液体的pH如图下表,请先填表,再结合该表填空。(物质分类填“酸”“碱”“盐”或“氧化物”)
物质 盐酸 (NH4)2SO4溶液 Na2SO4溶液 H2O Na2CO3溶液 NaOH溶液
pH <7 <7 =7 =7 >7 >7
物质 分类 氧化物
滴加酚酞 后颜色
滴加石蕊 后颜色
由上述测定结果可知:酸性溶液不一定都是 溶液,碱性溶液不一定都是 溶液。
13.中和反应是一类重要的化学反应。某同学利用所示装置研究稀盐酸与氢氧化钠溶液反应的过程,并用pH和温度传感器测量反应过程中相关物理量的变化情况,得到图乙和图丙。
(1)烧杯中发生反应的化学方程式为 。
(2)仪器A中溶液的溶质是 (填化学式)。
(3)图丙中V的数值最接近 (填“6”“12”或“16”)。
(4)下列说法错误的是 (填字母)。
A.图乙中b点所示溶液中的溶质是NaCl和NaOH
B.取图乙中d点所示溶液加热蒸干,所得固体为纯净物
C.图乙中c→d所示溶液中NaCl的质量不断增加
D.图丙中e→f的变化趋势可说明该反应是放热反应
14.某石油化工厂化验室的实验员用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,测得实验数据如图下表:
实验序号 消耗NaOH溶液的质量 洗涤后溶液的pH
① 30 g pH<7
② 40 g pH=7
③ 50 g pH>7
(1)欲计算出上述一定量石油产品中所含H2SO4的质量,应该选择实验 (填实验序号)的数据。
(2)若本实验中石油产品中残余硫酸溶液的质量为100 g,请计算该残余硫酸溶液中溶质的质量分数。(写出计算过程)
15. [2021·苏州] 如图室温下稀盐酸与稀氢氧化钠溶液反应过程中pH的变化曲线。下列说法不正确的是 ( )
A.实验时将稀盐酸逐滴滴入稀氢氧化钠溶液中
B.a点到b点pH变化的原因是H+和OH-发生反应
C.b点时,参加反应的HCl与NaOH的质量比为36.5 40
D.c点时,溶液中Na+的个数大于Cl-的个数
答案
课题2 酸和碱的中和反应
第2课时 溶液酸碱度的表示法——pH
1.C 溶液的pH由5变为2,数值减小,酸性增强。
2.B
3.D 不能用pH试纸直接蘸取待测溶液,以防污染待测溶液;先用水润湿pH试纸再测定溶液的酸碱度,会稀释滴在pH试纸上的待测液,所测pH可能不准确;普通pH试纸测出的pH只能是整数。
4.小于
A溶液能使紫色石蕊溶液变红,说明A溶液显酸性,pH<7;B溶液能使无色酚酞溶液变红,说明B溶液显碱性,pH>7。
5.pH试纸 洁净的玻璃片(合理即可) 玻璃棒 pH试纸 标准比色卡
6.D
7.(1)碱 酸
(2)小于(或<) 大于(或>) 酸和碱发生了中和反应
(3)酸 不是 只有pH小于5.6的雨水才是酸雨
8.A 9.D
10.C 测定溶液pH的正确操作是在洁净干燥的玻璃片或白瓷板上放一小片pH试纸,用洁净干燥的玻璃棒蘸取待测液滴在pH试纸上,再与标准比色卡对照,读出的数值是整数。
11.B 石灰水是氢氧化钙的水溶液,显碱性,先将pH试纸用蒸馏水润湿,会使测得的pH比实际值低。
12.
物质 盐酸 (NH4)2SO4溶液 Na2SO4溶液 H2O Na2CO3溶液 NaOH溶液
pH <7 <7 =7 =7 >7 >7
物质分类 酸 盐 盐 氧化物 盐 碱
滴加酚酞 后颜色 无色 无色 无色 无色 红色 红色
滴加石蕊 后颜色 红色 红色 紫色 紫色 蓝色 蓝色
酸 碱
13.(1)NaOH+HClNaCl+H2O
(2)HCl (3)12 (4)C
(2)从图乙可看出,溶液的起始pH大于7,则烧杯中原溶液是氢氧化钠溶液,则仪器A中是稀盐酸。(4)图乙中cd过程,反应已经停止,盐酸过量,所以氯化钠的质量不会增加。
14.(1)②
(2)解:设该残余硫酸溶液中溶质的质量为x。
2NaOH + H2SO4Na2SO4+2H2O
80 98
40 g×15% x
= x=7.35 g
该残余硫酸溶液中溶质的质量分数为×100%=7.35%。
答:该残余硫酸溶液中溶质的质量分数为7.35%。
15.D 图中溶液的pH随滴入液体体积的增加而逐渐减小,说明是将稀盐酸逐滴滴入稀氢氧化钠溶液中;a点到b点pH的变化,是因为氢氧化钠和盐酸反应,其实质是H+和OH-发生反应;b点时,二者恰好完全反应,利用化学方程式可知,参加反应的HCl与NaOH的质量比为36.5 40;c点时,盐酸过量,溶液中Na+的个数小于Cl-的个数。
同课章节目录
