鲁教版化学九年级下册 第七单元 第二节 碱及其性质 课件(共31张PPT)
文档属性
| 名称 | 鲁教版化学九年级下册 第七单元 第二节 碱及其性质 课件(共31张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-21 20:26:14 | ||
图片预览






文档简介
(共31张PPT)
第二节 碱及其性质
1.几种常见碱的化学式:
氢氧化钠______ 氢氧化钙_______
氢氧化钾______ 氢氧化钡_______
2.碱的概念:溶于水后解离出阴离子全部是______的化合物叫做碱。
NaOH
Ca(OH)2
KOH
Ba(OH)2
OH-
一.常见的碱
3.认识氢氧化钠、氢氧化钙
烧碱
火碱
消石灰
熟石灰
易
微
苛性钠
越小
石灰水
在空气中易吸水,发生____;溶于水时___热
潮解
放
特别提醒:在使用氢氧化钠时,必须十分小心,防止眼睛、皮肤、衣物等被腐蚀。如果不慎沾在皮肤上,要立即用大量水冲洗,然后再涂上硼酸溶液。
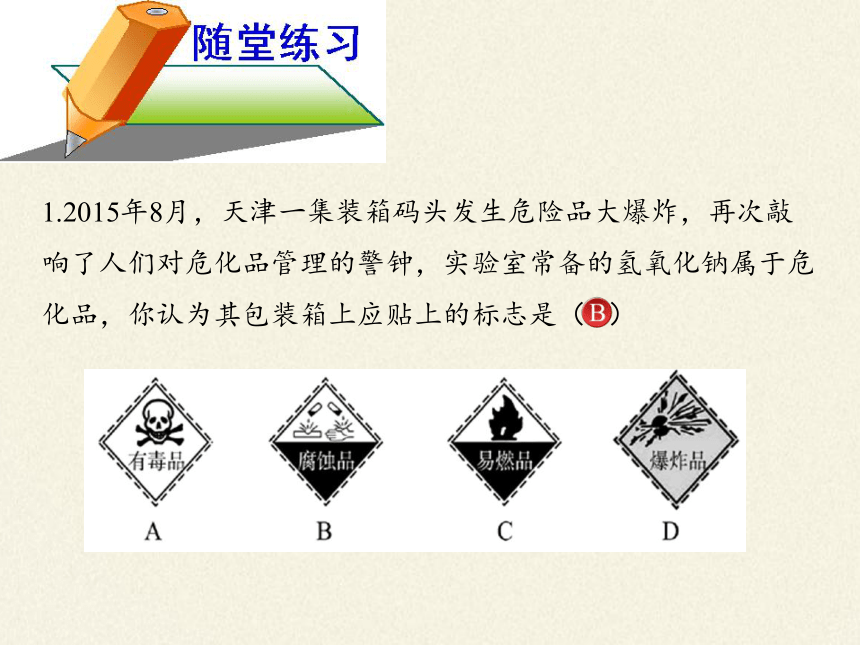
1.2015年8月,天津一集装箱码头发生危险品大爆炸,再次敲响了人们对危化品管理的警钟,实验室常备的氢氧化钠属于危化品,你认为其包装箱上应贴上的标志是( )
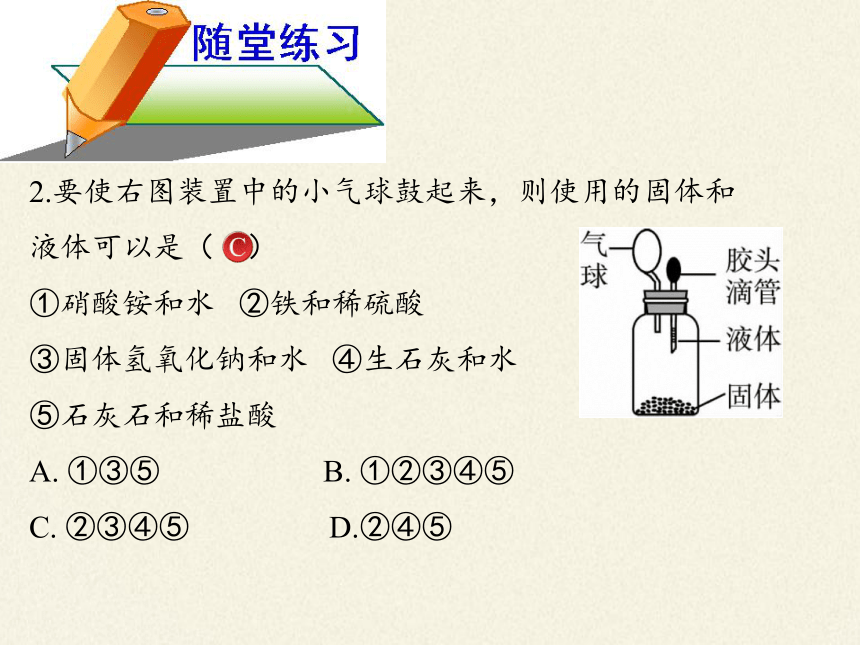
2.要使右图装置中的小气球鼓起来,则使用的固体和
液体可以是( )
①硝酸铵和水 ②铁和稀硫酸
③固体氢氧化钠和水 ④生石灰和水
⑤石灰石和稀盐酸
A. ①③⑤ B. ①②③④⑤
C. ②③④⑤ D.②④⑤
在头脑中回想一下常见的碱(以氢氧化钠和氢氧化钙为例)能与哪些物质发生化学反应?
探究1:碱与酸碱指示剂反应
NaOH溶液 Ca(OH)2溶液
紫色石蕊溶液 ________ ________
无色酚酞溶液 ________ ________
碱能使紫色石蕊试液变成蓝色,能使酚酞试液变成红色。
变蓝
变红
变红
变蓝
二. 碱的化学性质
结论:
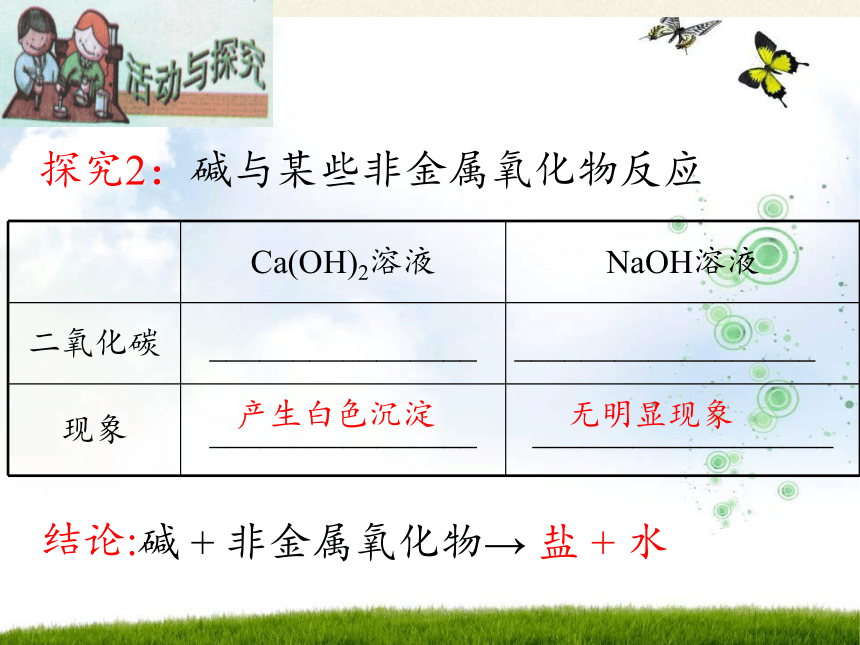
探究2:碱与某些非金属氧化物反应
Ca(OH)2溶液 NaOH溶液
二氧化碳 ________________ __________________
现象 ________________ __________________
碱 + 非金属氧化物→ 盐 + 水
产生白色沉淀
无明显现象
结论:
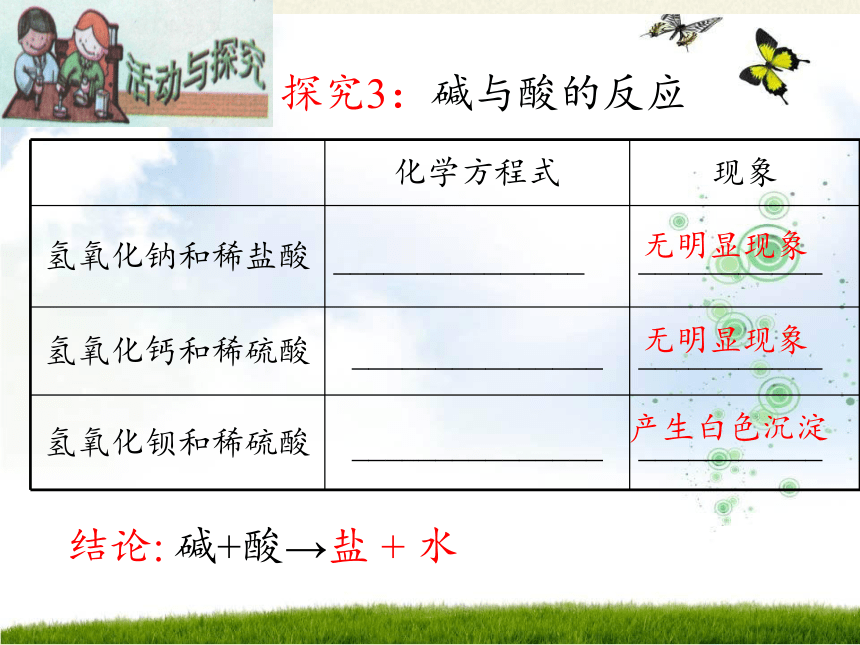
探究3:碱与酸的反应
碱+酸→盐 + 水
化学方程式 现象
氢氧化钠和稀盐酸 _______________ ___________
氢氧化钙和稀硫酸 _______________ ___________
氢氧化钡和稀硫酸 _______________ ___________
产生白色沉淀
无明显现象
无明显现象
结论:
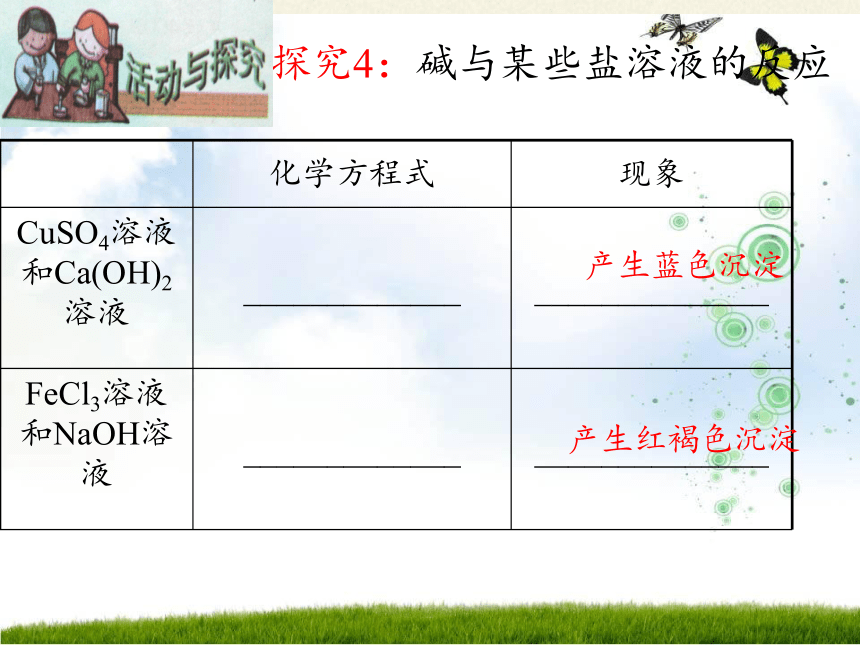
探究4:碱与某些盐溶液的反应
化学方程式 现象
CuSO4溶液和Ca(OH)2溶液 _____________ ______________
FeCl3溶液和NaOH溶液 _____________ ______________
产生蓝色沉淀
产生红褐色沉淀
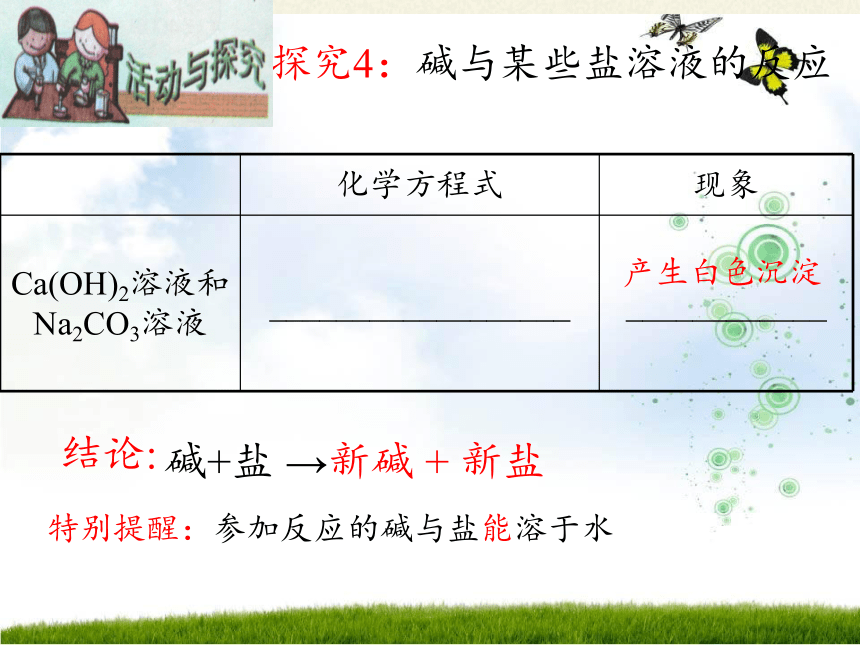
探究4:碱与某些盐溶液的反应
碱+盐 →新碱 + 新盐
特别提醒:参加反应的碱与盐能溶于水
化学方程式 现象
Ca(OH)2溶液和Na2CO3溶液 __________________ ____________
产生白色沉淀
结论:
归纳与总结 碱的通性:
特别提醒:Ca(OH)2溶液与Na2CO3溶液的反应不能体现碱的通性。
碱
盐
非金属氧化物
酸
酸碱指示剂
1.2008年9月27日,太空第一次留下“中国人的脚印”。我国研制的航天员舱外服为航天员成功进行太空行走提供了可靠的保证。航天员舱外服内含有与氢氧化钠性质相似的氢氧化锂(LiOH),它不可能具有的化学性质是 ( )
A.与氧化铁反应 B.与盐酸反应
C.与二氧化碳反应 D.与氯化铜溶液反应
2.现有两瓶标签脱落的无色溶液,它们分别为石灰水和氢氧化钠溶液,只需选用一种药品就能方便地将它们加以鉴别,该药品是( )
A.紫色石蕊溶液 B.无色酚酞溶液
C.稀盐酸 D.二氧化碳
三.中和反应及其应用
1.____和____作用生成____和____的反应,叫做中和反应;中和反应的实质是酸中的_____和碱中_____的结合生成了水。
酸
碱
盐
水
H+
OH-
(4)调节溶液的酸碱性
(1)应用于医药卫生
(2)改变土壤的酸碱性
(3)处理工业废水
2.应用:
1.中和反应在生活生产中有广泛的应用,下列做法不是利用中和反应原理的是 ( )
A.用熟石灰改良酸性土壤
B.用含氢氧化镁的药物治疗胃酸过多
C.用盐酸除去铁锈
D.用氨水(NH3.H2O)处理工厂的硫酸
2.某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像,如图所示。下列说法正确的是( )
A.图中c点所示溶液呈碱性
B.图中a点所示溶液中,含有的溶质是Na2SO4和H2SO4
C.该实验是将氢氧化钠容易逐滴滴入到盛有硫酸的烧杯中
D.由a点到b点的pH变化过程证明酸和碱发生了中和反应
1.下列物质露置于空气中,因发生化学变化而使其质量增加的是( )
A.浓硫酸 B.烧碱溶液
C.浓盐酸 D.过氧化氢溶液
直击中考
2.如图是有关Ca(OH)2的知识网络,请回答下列问题:
(1)遇氢氧化钙溶液变红色的酸碱指示剂是_____________。
(2)若图中非金属氧化物为CO2,则反应②的化学方程式为___
________________________________。
(3)反应③在生产中的一种用途是_________________。
无色酚酞溶液
改良酸性土壤
CO2+Ca(OH)2===CaCO3 +H2O
直击中考
3.下列有关NaOH的实验方案中,正确的是 ( )
A.用熟石灰和纯碱为原料制取NaOH
B.用酚酞溶液检验NaOH溶液是否变质
C.用NaOH固体干燥CO2气体
D.用CaCl2溶液除去NaOH溶液中的少量Na2CO3
直击中考
4.化学反应过程中常常伴随产生一些现象,同学们发现将CO2通入NaOH溶液时没有明显的现象,为此,他们进行了如下探究:
直击中考
(1)小明把一支收集满CO2的试管倒立在盛有饱和NaOH溶液的烧杯中(如图1所示),观察到试管内液面上升,原因是__________________________________(用化学方程式表示)。讨论分析后,同学们认为导致试管内液面上升还有另外一种原因,请简要说明_____________________________
_______________ _。
CO2+2NaOH===Na2CO3+H2O
CO2能溶于水且部分与水反应也会使试管内压强变小,液面上升
(2)为了进一步验证CO2与NaOH溶液确实发生了反应,小红设计了如下方案:分别取上述实验后的溶液于A/B两支试管中(如图2所示),向试管A中滴加足量的稀盐酸,观察到的现象是______________,反应的化学方程式为_________
_________________________________________;向试管B中滴加氯化钡溶液,观察到的现象是____________________,化学方程式为____________________________________________。
虽然实验的现象不同,但都能证明CO2与NaOH溶液确实发生了化学反应。
有气泡产生
有白色沉淀产生
Na2CO3+2HCl ===2NaCl+H2O+CO2
Na2CO3+BaCl2 ===2NaCl+BaCO3
(3)实验过程中需要吸收CO2时,大多选择NaOH溶液,但是,检验CO2时常常选择新配制的澄清石灰水,请简要解释原因______________________________________________
________________________________________________________
____________________________________ _______。
氢氧化钠的溶解度比氢氧化钙大,因此吸收二氧化碳常用氢氧化钠溶液;而二氧化碳能使澄清石灰水变浑浊,所以检验二氧化碳一定要用澄清石灰水
5.实验室有一瓶久置的氢氧化钠固体,某同学想了解其变质情况,称取5g样品于烧杯中,加入30g水使之完全溶解,再向烧杯中缓缓加入过量的氢氧化钡溶液,完全反应后,生成沉淀1.97g。
求(1)样品中碳酸钠的质量分数;
(2)反应后所得溶液中氢氧化钠的质量。
直击中考
谢 谢!
谢 谢
第二节 碱及其性质
1.几种常见碱的化学式:
氢氧化钠______ 氢氧化钙_______
氢氧化钾______ 氢氧化钡_______
2.碱的概念:溶于水后解离出阴离子全部是______的化合物叫做碱。
NaOH
Ca(OH)2
KOH
Ba(OH)2
OH-
一.常见的碱
3.认识氢氧化钠、氢氧化钙
烧碱
火碱
消石灰
熟石灰
易
微
苛性钠
越小
石灰水
在空气中易吸水,发生____;溶于水时___热
潮解
放
特别提醒:在使用氢氧化钠时,必须十分小心,防止眼睛、皮肤、衣物等被腐蚀。如果不慎沾在皮肤上,要立即用大量水冲洗,然后再涂上硼酸溶液。
1.2015年8月,天津一集装箱码头发生危险品大爆炸,再次敲响了人们对危化品管理的警钟,实验室常备的氢氧化钠属于危化品,你认为其包装箱上应贴上的标志是( )
2.要使右图装置中的小气球鼓起来,则使用的固体和
液体可以是( )
①硝酸铵和水 ②铁和稀硫酸
③固体氢氧化钠和水 ④生石灰和水
⑤石灰石和稀盐酸
A. ①③⑤ B. ①②③④⑤
C. ②③④⑤ D.②④⑤
在头脑中回想一下常见的碱(以氢氧化钠和氢氧化钙为例)能与哪些物质发生化学反应?
探究1:碱与酸碱指示剂反应
NaOH溶液 Ca(OH)2溶液
紫色石蕊溶液 ________ ________
无色酚酞溶液 ________ ________
碱能使紫色石蕊试液变成蓝色,能使酚酞试液变成红色。
变蓝
变红
变红
变蓝
二. 碱的化学性质
结论:
探究2:碱与某些非金属氧化物反应
Ca(OH)2溶液 NaOH溶液
二氧化碳 ________________ __________________
现象 ________________ __________________
碱 + 非金属氧化物→ 盐 + 水
产生白色沉淀
无明显现象
结论:
探究3:碱与酸的反应
碱+酸→盐 + 水
化学方程式 现象
氢氧化钠和稀盐酸 _______________ ___________
氢氧化钙和稀硫酸 _______________ ___________
氢氧化钡和稀硫酸 _______________ ___________
产生白色沉淀
无明显现象
无明显现象
结论:
探究4:碱与某些盐溶液的反应
化学方程式 现象
CuSO4溶液和Ca(OH)2溶液 _____________ ______________
FeCl3溶液和NaOH溶液 _____________ ______________
产生蓝色沉淀
产生红褐色沉淀
探究4:碱与某些盐溶液的反应
碱+盐 →新碱 + 新盐
特别提醒:参加反应的碱与盐能溶于水
化学方程式 现象
Ca(OH)2溶液和Na2CO3溶液 __________________ ____________
产生白色沉淀
结论:
归纳与总结 碱的通性:
特别提醒:Ca(OH)2溶液与Na2CO3溶液的反应不能体现碱的通性。
碱
盐
非金属氧化物
酸
酸碱指示剂
1.2008年9月27日,太空第一次留下“中国人的脚印”。我国研制的航天员舱外服为航天员成功进行太空行走提供了可靠的保证。航天员舱外服内含有与氢氧化钠性质相似的氢氧化锂(LiOH),它不可能具有的化学性质是 ( )
A.与氧化铁反应 B.与盐酸反应
C.与二氧化碳反应 D.与氯化铜溶液反应
2.现有两瓶标签脱落的无色溶液,它们分别为石灰水和氢氧化钠溶液,只需选用一种药品就能方便地将它们加以鉴别,该药品是( )
A.紫色石蕊溶液 B.无色酚酞溶液
C.稀盐酸 D.二氧化碳
三.中和反应及其应用
1.____和____作用生成____和____的反应,叫做中和反应;中和反应的实质是酸中的_____和碱中_____的结合生成了水。
酸
碱
盐
水
H+
OH-
(4)调节溶液的酸碱性
(1)应用于医药卫生
(2)改变土壤的酸碱性
(3)处理工业废水
2.应用:
1.中和反应在生活生产中有广泛的应用,下列做法不是利用中和反应原理的是 ( )
A.用熟石灰改良酸性土壤
B.用含氢氧化镁的药物治疗胃酸过多
C.用盐酸除去铁锈
D.用氨水(NH3.H2O)处理工厂的硫酸
2.某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像,如图所示。下列说法正确的是( )
A.图中c点所示溶液呈碱性
B.图中a点所示溶液中,含有的溶质是Na2SO4和H2SO4
C.该实验是将氢氧化钠容易逐滴滴入到盛有硫酸的烧杯中
D.由a点到b点的pH变化过程证明酸和碱发生了中和反应
1.下列物质露置于空气中,因发生化学变化而使其质量增加的是( )
A.浓硫酸 B.烧碱溶液
C.浓盐酸 D.过氧化氢溶液
直击中考
2.如图是有关Ca(OH)2的知识网络,请回答下列问题:
(1)遇氢氧化钙溶液变红色的酸碱指示剂是_____________。
(2)若图中非金属氧化物为CO2,则反应②的化学方程式为___
________________________________。
(3)反应③在生产中的一种用途是_________________。
无色酚酞溶液
改良酸性土壤
CO2+Ca(OH)2===CaCO3 +H2O
直击中考
3.下列有关NaOH的实验方案中,正确的是 ( )
A.用熟石灰和纯碱为原料制取NaOH
B.用酚酞溶液检验NaOH溶液是否变质
C.用NaOH固体干燥CO2气体
D.用CaCl2溶液除去NaOH溶液中的少量Na2CO3
直击中考
4.化学反应过程中常常伴随产生一些现象,同学们发现将CO2通入NaOH溶液时没有明显的现象,为此,他们进行了如下探究:
直击中考
(1)小明把一支收集满CO2的试管倒立在盛有饱和NaOH溶液的烧杯中(如图1所示),观察到试管内液面上升,原因是__________________________________(用化学方程式表示)。讨论分析后,同学们认为导致试管内液面上升还有另外一种原因,请简要说明_____________________________
_______________ _。
CO2+2NaOH===Na2CO3+H2O
CO2能溶于水且部分与水反应也会使试管内压强变小,液面上升
(2)为了进一步验证CO2与NaOH溶液确实发生了反应,小红设计了如下方案:分别取上述实验后的溶液于A/B两支试管中(如图2所示),向试管A中滴加足量的稀盐酸,观察到的现象是______________,反应的化学方程式为_________
_________________________________________;向试管B中滴加氯化钡溶液,观察到的现象是____________________,化学方程式为____________________________________________。
虽然实验的现象不同,但都能证明CO2与NaOH溶液确实发生了化学反应。
有气泡产生
有白色沉淀产生
Na2CO3+2HCl ===2NaCl+H2O+CO2
Na2CO3+BaCl2 ===2NaCl+BaCO3
(3)实验过程中需要吸收CO2时,大多选择NaOH溶液,但是,检验CO2时常常选择新配制的澄清石灰水,请简要解释原因______________________________________________
________________________________________________________
____________________________________ _______。
氢氧化钠的溶解度比氢氧化钙大,因此吸收二氧化碳常用氢氧化钠溶液;而二氧化碳能使澄清石灰水变浑浊,所以检验二氧化碳一定要用澄清石灰水
5.实验室有一瓶久置的氢氧化钠固体,某同学想了解其变质情况,称取5g样品于烧杯中,加入30g水使之完全溶解,再向烧杯中缓缓加入过量的氢氧化钡溶液,完全反应后,生成沉淀1.97g。
求(1)样品中碳酸钠的质量分数;
(2)反应后所得溶液中氢氧化钠的质量。
直击中考
谢 谢!
谢 谢
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
