人教版化学九年级下册 11-1 生活中常见的盐课件(共22张PPT)
文档属性
| 名称 | 人教版化学九年级下册 11-1 生活中常见的盐课件(共22张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-22 08:12:09 | ||
图片预览







文档简介
(共23张PPT)
第十一单元 盐 化肥
课题1 生活中常见的盐
1.通过资料收集和实验探究,认识生活中常见的盐的种类和用途。
2.初步学会粗盐提纯和鉴定碳酸根离子的方法。
3.能判断复分解反应的类型及发生条件。
指出下列物质中哪些是酸 哪些是碱 哪些是盐
H2O CaCO3 HCl H2O2 Na2CO3 Ca(OH)2 MnO2 H2SO4 NaOH
酸
HCl、 H2SO4
在水溶液中解离时,生成的阳离子全部是氢离子的化合物
碱
NaOH、Ca(OH)2 在水溶液中解离时,生成的阴离子全部是氢氧根离子的化合物
盐 CaCO3 、 Na2CO3 由金属离子和酸根离子构成的化合物
一、氯化钠(NaCl)-----俗名叫食盐
思考:(阅读课本)
1、工业用盐含有什么而有毒?
2、盐与食盐是否同一物质?什么是碘盐?
3、食盐有哪些重要用途?
用途:
(1)生理盐水 (2)调味品 (3)医疗
(4)农业 (5)腌渍品 (6)消除积雪
思考:食盐有哪些制法
(1)直接开采法 (2)海水晒盐法
(3)盐井水煮盐法 (4)盐湖水煮盐法
粗盐提纯的步骤:
1.称量(左物右码)
2.溶解
3.过滤
4.蒸发:
称量
计算产率
粗盐产率= ×100%
精盐质量
溶解粗盐质量
过滤的要点:
一贴、二低、三靠
仪器:烧杯、漏斗、蒸发皿、玻璃棒、酒精灯、铁架台
1.在溶解、过滤、蒸发中都用到了玻璃棒,它的作用分别是什么
溶解:搅拌,加速固体的溶解
过滤:引流
蒸发:防止液体受热不均匀,液滴飞溅
2.是否需要把水全部蒸干再熄灭酒精灯?
当蒸发皿中出现较多固体时,就要停止加热,利用蒸发皿
的余热使滤液蒸干
二、碳酸钠、碳酸氢钠、碳酸钙
1.碳酸钠(Na2CO3)
(1)俗名:纯碱、苏打
(2)纯碱不是碱,是盐(水溶液显碱性)
(3)用途:玻璃、造纸、纺织和洗涤剂的生产等
2.碳酸氢钠(NaHCO3)
(1)俗名:小苏打
(2)用途:焙制糕点、治疗胃酸过多
3.碳酸钙(CaCO3)
(1)大理石、石灰石的主要成分
(2)用途:建筑材料、补钙剂
怎样检验这些物质中含有碳酸根呢?
CO32-
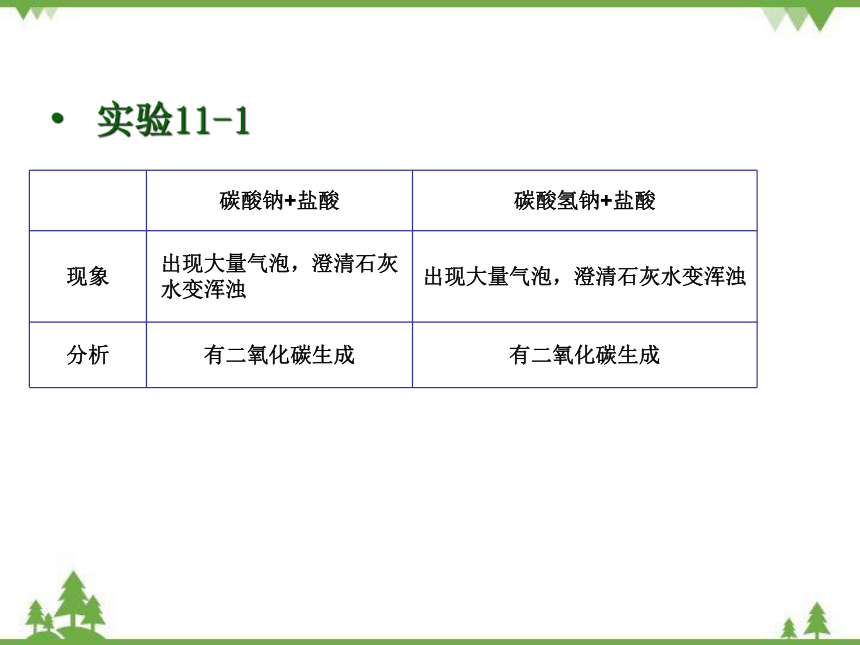
实验11-1
碳酸钠+盐酸 碳酸氢钠+盐酸
现象 出现大量气泡,澄清石灰水变浑浊 出现大量气泡,澄清石灰水变浑浊
分析 有二氧化碳生成 有二氧化碳生成
Na2CO3+2HCl=2NaCl+H2CO3
化学方程式:
Na2CO3+2HCl=2NaCl+ CO2 ↑ +H2O
CO2 ↑ +H2O
请同学们根据上述方程式来推导NaHCO3与盐酸的反应
NaHCO3+HCl=NaCl+H2CO3
CO2↑ +H2O
NaHCO3+HCl=NaCl+ CO2 ↑ +H2O
Na2CO3+Ca(OH)2=CaCO3 +2NaOH
碳酸钠溶液+澄清石灰水
现象
分析
出现白色澄淀
二者发生反应,生成一种难溶物
2.实验11-2
3. 碳酸盐(即CO32- 、HCO3-)的检验方法
实验操作
实验现象
实验结论
向少量样品中加入稀盐酸,将产生的气体通入澄清石灰水 有无色气体生成,澄清石灰水变浑浊
该样品是碳酸盐
1.下列说法正确的是( )
A.盐都能食用,故称为食盐
B.盐就是食盐,易溶于水
C.盐都有咸味,都是白色固体
D.盐是一类物质的总称
D
2.食盐是一种重要的化工原料,可用于生产:①金属钠②氯气③盐酸④硫酸⑤烧碱⑥纯碱等,以上正确的是( )
A.①②③⑤⑥ B.③④⑤
C.①④⑤⑥ D.①②③④⑤⑥
A
与碱反应(实验11-2)
现 象
化学方程式
分 析
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
含有CO32-的碳酸盐溶液与石灰水能反应产生白色沉淀
产生白色沉淀
三、复分解反应
两种化合物互相交换成分,生成另外两种化合物的反应,叫做
复分解反应 。
表达式:AB + CD→ AD + CB
特 点:双交换,价不变
复分解反应发生的条件
只有当两种化合物交换成分,生成物中有沉淀或有气体或有水生成时(至少满足上述条件之一),复分解反应才可以发生。
复分解反应的定义
盐的溶解性
口诀:
钾、钠、硝酸、铵盐溶
盐酸盐不溶氯化银
硫酸盐不溶硫酸钡
碳酸盐只溶钾、钠、铵
钾、钠、钙、钡的碱能溶
常见五酸都易溶
另外:AgCl、BaSO4不仅不溶于水,而且还不溶于稀硝酸
1.金属+盐→
新盐+新金属
在金属活动性顺序中,只有位于前面的金属才能把位于其后面 的金属从它们的盐溶液中置换出来,与氢的位置 无关;盐必须是可溶性盐
不能用K、Ca、Na置换盐溶液中的金属
铁参加的置换反应生成的都是亚铁盐
2.酸+盐→
新酸+新盐
满足复分解反应的条件
四、盐的化学性质
3.碱+盐→新碱+新盐
反应物需都可溶,且满足复分解反应的条件
4.盐+盐→新盐+新盐
反应物需都可溶,且满足复分解反应的条件
2、下列各组物质的溶液,不能发生复分解反应的是( )
A、HCl,Ca(OH)2 B、Na2CO3,H2SO4
C、AgNO3,BaCl2 D、KCl,CuSO4
D
B、2HgO 2Hg+O2
A、C+O2 CO2
点燃
C、2Al2O3 4 Al+3O2
通电
D、2KClO3 2KCl+3O2
MnO2
1、下列反应不属于分解反应的是( )
A
3、下列各组溶液,不加其他试剂就能鉴别的是( )(多选)
A、Na2CO3、HCl、H2SO4、NaNO3
B、K2CO3、H2SO4、HNO3、BaCl2
C、HCl、AgNO3、HNO3、NaCl
D、NaOH、FeCl3、MgCl2、BaCl2
B、D
4、下列化学反应属于复分解反应的是( )
A、Zn+H2SO4 =ZnSO4+H2↑
B、2KMnO4 = K2MnO4+MnO2+O2↑ C、CaO+H2O=Ca(OH)2 D、CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
D
四种盐的重要性质和用途;
碳酸盐的检验(即CO32-或HCO3-的检验);
复分解反应的概念;
复分解反应的条件。
第十一单元 盐 化肥
课题1 生活中常见的盐
1.通过资料收集和实验探究,认识生活中常见的盐的种类和用途。
2.初步学会粗盐提纯和鉴定碳酸根离子的方法。
3.能判断复分解反应的类型及发生条件。
指出下列物质中哪些是酸 哪些是碱 哪些是盐
H2O CaCO3 HCl H2O2 Na2CO3 Ca(OH)2 MnO2 H2SO4 NaOH
酸
HCl、 H2SO4
在水溶液中解离时,生成的阳离子全部是氢离子的化合物
碱
NaOH、Ca(OH)2 在水溶液中解离时,生成的阴离子全部是氢氧根离子的化合物
盐 CaCO3 、 Na2CO3 由金属离子和酸根离子构成的化合物
一、氯化钠(NaCl)-----俗名叫食盐
思考:(阅读课本)
1、工业用盐含有什么而有毒?
2、盐与食盐是否同一物质?什么是碘盐?
3、食盐有哪些重要用途?
用途:
(1)生理盐水 (2)调味品 (3)医疗
(4)农业 (5)腌渍品 (6)消除积雪
思考:食盐有哪些制法
(1)直接开采法 (2)海水晒盐法
(3)盐井水煮盐法 (4)盐湖水煮盐法
粗盐提纯的步骤:
1.称量(左物右码)
2.溶解
3.过滤
4.蒸发:
称量
计算产率
粗盐产率= ×100%
精盐质量
溶解粗盐质量
过滤的要点:
一贴、二低、三靠
仪器:烧杯、漏斗、蒸发皿、玻璃棒、酒精灯、铁架台
1.在溶解、过滤、蒸发中都用到了玻璃棒,它的作用分别是什么
溶解:搅拌,加速固体的溶解
过滤:引流
蒸发:防止液体受热不均匀,液滴飞溅
2.是否需要把水全部蒸干再熄灭酒精灯?
当蒸发皿中出现较多固体时,就要停止加热,利用蒸发皿
的余热使滤液蒸干
二、碳酸钠、碳酸氢钠、碳酸钙
1.碳酸钠(Na2CO3)
(1)俗名:纯碱、苏打
(2)纯碱不是碱,是盐(水溶液显碱性)
(3)用途:玻璃、造纸、纺织和洗涤剂的生产等
2.碳酸氢钠(NaHCO3)
(1)俗名:小苏打
(2)用途:焙制糕点、治疗胃酸过多
3.碳酸钙(CaCO3)
(1)大理石、石灰石的主要成分
(2)用途:建筑材料、补钙剂
怎样检验这些物质中含有碳酸根呢?
CO32-
实验11-1
碳酸钠+盐酸 碳酸氢钠+盐酸
现象 出现大量气泡,澄清石灰水变浑浊 出现大量气泡,澄清石灰水变浑浊
分析 有二氧化碳生成 有二氧化碳生成
Na2CO3+2HCl=2NaCl+H2CO3
化学方程式:
Na2CO3+2HCl=2NaCl+ CO2 ↑ +H2O
CO2 ↑ +H2O
请同学们根据上述方程式来推导NaHCO3与盐酸的反应
NaHCO3+HCl=NaCl+H2CO3
CO2↑ +H2O
NaHCO3+HCl=NaCl+ CO2 ↑ +H2O
Na2CO3+Ca(OH)2=CaCO3 +2NaOH
碳酸钠溶液+澄清石灰水
现象
分析
出现白色澄淀
二者发生反应,生成一种难溶物
2.实验11-2
3. 碳酸盐(即CO32- 、HCO3-)的检验方法
实验操作
实验现象
实验结论
向少量样品中加入稀盐酸,将产生的气体通入澄清石灰水 有无色气体生成,澄清石灰水变浑浊
该样品是碳酸盐
1.下列说法正确的是( )
A.盐都能食用,故称为食盐
B.盐就是食盐,易溶于水
C.盐都有咸味,都是白色固体
D.盐是一类物质的总称
D
2.食盐是一种重要的化工原料,可用于生产:①金属钠②氯气③盐酸④硫酸⑤烧碱⑥纯碱等,以上正确的是( )
A.①②③⑤⑥ B.③④⑤
C.①④⑤⑥ D.①②③④⑤⑥
A
与碱反应(实验11-2)
现 象
化学方程式
分 析
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
含有CO32-的碳酸盐溶液与石灰水能反应产生白色沉淀
产生白色沉淀
三、复分解反应
两种化合物互相交换成分,生成另外两种化合物的反应,叫做
复分解反应 。
表达式:AB + CD→ AD + CB
特 点:双交换,价不变
复分解反应发生的条件
只有当两种化合物交换成分,生成物中有沉淀或有气体或有水生成时(至少满足上述条件之一),复分解反应才可以发生。
复分解反应的定义
盐的溶解性
口诀:
钾、钠、硝酸、铵盐溶
盐酸盐不溶氯化银
硫酸盐不溶硫酸钡
碳酸盐只溶钾、钠、铵
钾、钠、钙、钡的碱能溶
常见五酸都易溶
另外:AgCl、BaSO4不仅不溶于水,而且还不溶于稀硝酸
1.金属+盐→
新盐+新金属
在金属活动性顺序中,只有位于前面的金属才能把位于其后面 的金属从它们的盐溶液中置换出来,与氢的位置 无关;盐必须是可溶性盐
不能用K、Ca、Na置换盐溶液中的金属
铁参加的置换反应生成的都是亚铁盐
2.酸+盐→
新酸+新盐
满足复分解反应的条件
四、盐的化学性质
3.碱+盐→新碱+新盐
反应物需都可溶,且满足复分解反应的条件
4.盐+盐→新盐+新盐
反应物需都可溶,且满足复分解反应的条件
2、下列各组物质的溶液,不能发生复分解反应的是( )
A、HCl,Ca(OH)2 B、Na2CO3,H2SO4
C、AgNO3,BaCl2 D、KCl,CuSO4
D
B、2HgO 2Hg+O2
A、C+O2 CO2
点燃
C、2Al2O3 4 Al+3O2
通电
D、2KClO3 2KCl+3O2
MnO2
1、下列反应不属于分解反应的是( )
A
3、下列各组溶液,不加其他试剂就能鉴别的是( )(多选)
A、Na2CO3、HCl、H2SO4、NaNO3
B、K2CO3、H2SO4、HNO3、BaCl2
C、HCl、AgNO3、HNO3、NaCl
D、NaOH、FeCl3、MgCl2、BaCl2
B、D
4、下列化学反应属于复分解反应的是( )
A、Zn+H2SO4 =ZnSO4+H2↑
B、2KMnO4 = K2MnO4+MnO2+O2↑ C、CaO+H2O=Ca(OH)2 D、CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
D
四种盐的重要性质和用途;
碳酸盐的检验(即CO32-或HCO3-的检验);
复分解反应的概念;
复分解反应的条件。
同课章节目录
