化学人教版(2019)必修第一册1.2.1电解质的电解(共18张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.2.1电解质的电解(共18张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 347.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-22 15:59:01 | ||
图片预览





文档简介
(共18张PPT)
第二节 离子反应
第1课时 电解质的电离
(1)什么是电解质?
(2)电解质与导电有什么关系?
思考
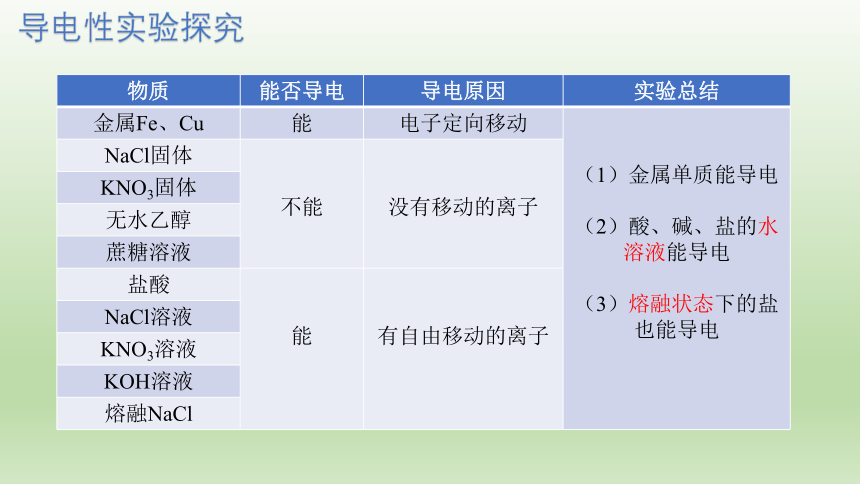
导电性实验探究
物质 能否导电 导电原因 实验总结
金属Fe、Cu 能 电子定向移动
(1)金属单质能导电
(2)酸、碱、盐的水溶液能导电
(3)熔融状态下的盐也能导电
NaCl固体 不能 没有移动的离子
KNO3固体 否
无水乙醇 否
蔗糖溶液 否
盐酸 能 有自由移动的离子
NaCl溶液 能
KNO3溶液 能
KOH溶液 能
熔融NaCl 能
1、电解质与非电解质
电解质:在水溶液里或熔融状态下能导电的化合物
如酸、碱、盐、活泼金属氧化物等
非电解质:在水溶液里和熔融状态下都不能导电的化合物
如大多数有机物、非金属氧化物等
物质
混合物
纯净物
单质
化合物
电解质
非电解质
分析:在判断一个物质是电解质还是非电解质,首先要明确其是否为
化合物,其次再确定其是否能导电。
下列物质中属于电解质的是:
① NaCl溶液 ②氯化氢 ③硫酸
④CO2 ⑤BaSO4 ⑥乙醇
⑦金属钠 ⑧石墨 ⑨MgCl2 ⑩CaO
发现:能导电的不一定是电解质,也可能是单质
② ③ ⑤ ⑨ ⑩
解析: ① 是混合物, ⑦ ⑧是单质,它们既不是电解质也不是非电解质
④ ⑥是非电解质
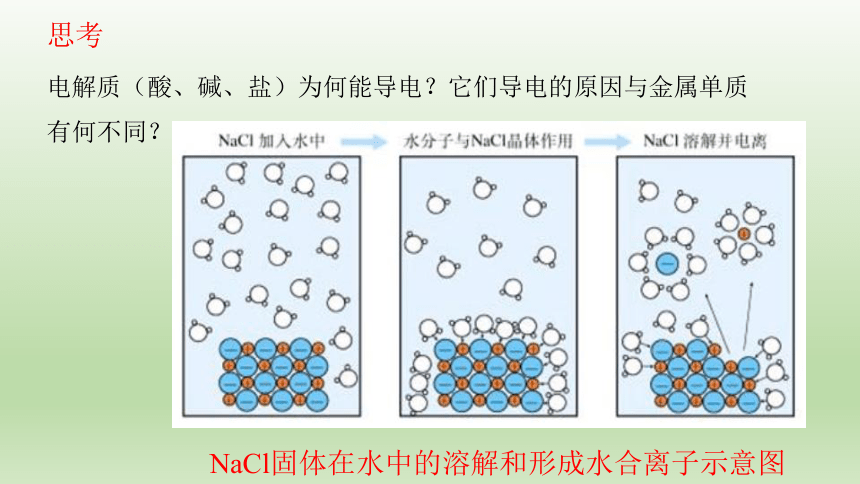
电解质(酸、碱、盐)为何能导电?它们导电的原因与金属单质有何不同?
思考
NaCl固体在水中的溶解和形成水合离子示意图
2、电离及电离方程式
(1)定义: 电解质溶于水或受热熔化时,形成自由移动的离子
的过程。
(2)表示方法:电离方程式——用来表示电解质的电离过程
NaCl的电离方程式:NaCl = Na+ + Cl-)
(3)电解质与非电解质的本质区别是:
化合物本身能否电离出离子
对下列物质进行判断与分类,并说明原因:
Cu KOH CO2 CaCO3 AgCl NH3 HCl
电解质: 非电解质:
既不是电解质也不是非电解质:
解析:电解质: KOH、 CaCO3 、 AgCl 、HCl,本身能在水里或熔融状态下电离出离子
非电解质: CO2、 NH3 自己本身不能电离出离子
既不是电解质也不是非电解质: Cu,不是化合物
请根据NaCl的电离方程式写出HCl、 H2SO4、HNO3的电离方程式,并归纳酸的共同点。
HCl = Cl- + H+
H2SO4 = SO42- + 2H+
HNO3 = NO3- + H+
共同点:酸电离时生成的阳离子都是H+
请写出KOH、NaOH、Ca(OH)2的电离方程式,并归纳碱的共同点。
KOH = K+ + OH -
NaOH = Na+ + OH -
Ca(OH)2 = Ca 2+ + 2OH -
共同点:碱电离时生成的阴离子都是OH -
1.下列物质属于电解质的是 ( )
A.Fe B.CO2 C.NaCl D.KNO3溶液
2.下列说法不正确的是( )
①氨溶于水得到的溶液能导电,所以NH3是电解质
②溶于水电离出H+的化合物都是酸
③液态HCl不导电,所以属于非电解质
④金属铜能导电,但它不是电解质,是非电解质
A.②③ B.①④ C.全部 D.①②③
C
D
3.下列电离方程式中,正确的是( )
A.Al2(SO4)3=2Al3++ 3SO42- B. Ba(OH)2 = Ba 2+ + OH2 –
C. Na2SO4 = SO4-2 + 2Na+ D. Ca( NO3) 2 = Ca 2+ + 2( NO3) 2-
A
4.下列属于电解质且能够导电的是( )
A.熔融氯化钠 B.蔗糖 C.KOH固体 D.铁
A
5.只有在水溶液中才导电的电解质是( )
A.NaCl B.CO2 C.CH3CH2OH D.HCl
D
6.下列有关物质分类的说法,不正确的是( )
A.CO、N2O5是非金属氧化物,也是酸性氧化物,它们属于电解质
B.KNO3是钾盐、硝酸盐,也是正盐
C.H2CO3是含氧酸、二元酸
D.NaOH是可溶性碱,也是强碱
7.下列说法正确的是( )
A.金属导电的原理和电解质导电的原理不同
B.强电解质一定是易溶于水的化合物,弱电解质一定是难溶于水的化合物
C.CO2的水溶液导电能力很弱,所以CO2是弱电解质
D.在强电解质的水溶液中只有离子没有分子
A
A
3、强电解质与弱电解质
强电解质:在水溶液里或熔融状态下全部电离成离子的电解质。如强酸、强碱、部分碱性氧化物、大部分盐类都是强电解质。
弱强电解质:在水溶液里部分电离的电解质。包括弱酸、弱碱、水与少数盐。
现有以下物质:①碳棒 ②盐酸 ③H2SO4 ④氨水 ⑤熔融KOH ⑥NH3 ⑦CCl4
⑧CO2 ⑨冰醋酸 ⑩NaHSO4固体
(1)上述物质中,可导电的是___________。
(2)上述物质中,属于非电解质的是___________。
(3)上述物质中,属于电解质但不导电的是___________。
(4)上述物质中,属于弱电解质的是___________。
(5)写出③、⑨两种物质在水溶液中的电离方程式。
③:______________________ 。
⑨:______________________ 。
① ② ④ ⑤
⑥⑦⑧
③⑨⑩
⑨
H2SO4 = SO42- + 2H+
CH3COOH CH3COO- + H+
课堂小结
(1)电解质与非电解质: 必须是化合物,区别是:在水溶液里、熔融状态下能否导电
(2)单质、混合物既不是电解质,也不是非电解质
(3)电解质的电离过程用电离方程式表示
(4)电解质与非电解质的本质区别是:
化合物本身能否电离出离子
(5)酸的本质:电离时生成的阳离子都是H+
碱的本质:电离时生成的阴离子都是OH -
(6)强电解质:在水溶液里或熔融状态下全部电离成离子的电解质。如强酸、强碱、部分碱性氧化物、大部分盐类都是强电解质。
(7)弱强电解质:在水溶液里部分电离的电解质。包括弱酸、弱碱、水与少数盐。
第二节 离子反应
第1课时 电解质的电离
(1)什么是电解质?
(2)电解质与导电有什么关系?
思考
导电性实验探究
物质 能否导电 导电原因 实验总结
金属Fe、Cu 能 电子定向移动
(1)金属单质能导电
(2)酸、碱、盐的水溶液能导电
(3)熔融状态下的盐也能导电
NaCl固体 不能 没有移动的离子
KNO3固体 否
无水乙醇 否
蔗糖溶液 否
盐酸 能 有自由移动的离子
NaCl溶液 能
KNO3溶液 能
KOH溶液 能
熔融NaCl 能
1、电解质与非电解质
电解质:在水溶液里或熔融状态下能导电的化合物
如酸、碱、盐、活泼金属氧化物等
非电解质:在水溶液里和熔融状态下都不能导电的化合物
如大多数有机物、非金属氧化物等
物质
混合物
纯净物
单质
化合物
电解质
非电解质
分析:在判断一个物质是电解质还是非电解质,首先要明确其是否为
化合物,其次再确定其是否能导电。
下列物质中属于电解质的是:
① NaCl溶液 ②氯化氢 ③硫酸
④CO2 ⑤BaSO4 ⑥乙醇
⑦金属钠 ⑧石墨 ⑨MgCl2 ⑩CaO
发现:能导电的不一定是电解质,也可能是单质
② ③ ⑤ ⑨ ⑩
解析: ① 是混合物, ⑦ ⑧是单质,它们既不是电解质也不是非电解质
④ ⑥是非电解质
电解质(酸、碱、盐)为何能导电?它们导电的原因与金属单质有何不同?
思考
NaCl固体在水中的溶解和形成水合离子示意图
2、电离及电离方程式
(1)定义: 电解质溶于水或受热熔化时,形成自由移动的离子
的过程。
(2)表示方法:电离方程式——用来表示电解质的电离过程
NaCl的电离方程式:NaCl = Na+ + Cl-)
(3)电解质与非电解质的本质区别是:
化合物本身能否电离出离子
对下列物质进行判断与分类,并说明原因:
Cu KOH CO2 CaCO3 AgCl NH3 HCl
电解质: 非电解质:
既不是电解质也不是非电解质:
解析:电解质: KOH、 CaCO3 、 AgCl 、HCl,本身能在水里或熔融状态下电离出离子
非电解质: CO2、 NH3 自己本身不能电离出离子
既不是电解质也不是非电解质: Cu,不是化合物
请根据NaCl的电离方程式写出HCl、 H2SO4、HNO3的电离方程式,并归纳酸的共同点。
HCl = Cl- + H+
H2SO4 = SO42- + 2H+
HNO3 = NO3- + H+
共同点:酸电离时生成的阳离子都是H+
请写出KOH、NaOH、Ca(OH)2的电离方程式,并归纳碱的共同点。
KOH = K+ + OH -
NaOH = Na+ + OH -
Ca(OH)2 = Ca 2+ + 2OH -
共同点:碱电离时生成的阴离子都是OH -
1.下列物质属于电解质的是 ( )
A.Fe B.CO2 C.NaCl D.KNO3溶液
2.下列说法不正确的是( )
①氨溶于水得到的溶液能导电,所以NH3是电解质
②溶于水电离出H+的化合物都是酸
③液态HCl不导电,所以属于非电解质
④金属铜能导电,但它不是电解质,是非电解质
A.②③ B.①④ C.全部 D.①②③
C
D
3.下列电离方程式中,正确的是( )
A.Al2(SO4)3=2Al3++ 3SO42- B. Ba(OH)2 = Ba 2+ + OH2 –
C. Na2SO4 = SO4-2 + 2Na+ D. Ca( NO3) 2 = Ca 2+ + 2( NO3) 2-
A
4.下列属于电解质且能够导电的是( )
A.熔融氯化钠 B.蔗糖 C.KOH固体 D.铁
A
5.只有在水溶液中才导电的电解质是( )
A.NaCl B.CO2 C.CH3CH2OH D.HCl
D
6.下列有关物质分类的说法,不正确的是( )
A.CO、N2O5是非金属氧化物,也是酸性氧化物,它们属于电解质
B.KNO3是钾盐、硝酸盐,也是正盐
C.H2CO3是含氧酸、二元酸
D.NaOH是可溶性碱,也是强碱
7.下列说法正确的是( )
A.金属导电的原理和电解质导电的原理不同
B.强电解质一定是易溶于水的化合物,弱电解质一定是难溶于水的化合物
C.CO2的水溶液导电能力很弱,所以CO2是弱电解质
D.在强电解质的水溶液中只有离子没有分子
A
A
3、强电解质与弱电解质
强电解质:在水溶液里或熔融状态下全部电离成离子的电解质。如强酸、强碱、部分碱性氧化物、大部分盐类都是强电解质。
弱强电解质:在水溶液里部分电离的电解质。包括弱酸、弱碱、水与少数盐。
现有以下物质:①碳棒 ②盐酸 ③H2SO4 ④氨水 ⑤熔融KOH ⑥NH3 ⑦CCl4
⑧CO2 ⑨冰醋酸 ⑩NaHSO4固体
(1)上述物质中,可导电的是___________。
(2)上述物质中,属于非电解质的是___________。
(3)上述物质中,属于电解质但不导电的是___________。
(4)上述物质中,属于弱电解质的是___________。
(5)写出③、⑨两种物质在水溶液中的电离方程式。
③:______________________ 。
⑨:______________________ 。
① ② ④ ⑤
⑥⑦⑧
③⑨⑩
⑨
H2SO4 = SO42- + 2H+
CH3COOH CH3COO- + H+
课堂小结
(1)电解质与非电解质: 必须是化合物,区别是:在水溶液里、熔融状态下能否导电
(2)单质、混合物既不是电解质,也不是非电解质
(3)电解质的电离过程用电离方程式表示
(4)电解质与非电解质的本质区别是:
化合物本身能否电离出离子
(5)酸的本质:电离时生成的阳离子都是H+
碱的本质:电离时生成的阴离子都是OH -
(6)强电解质:在水溶液里或熔融状态下全部电离成离子的电解质。如强酸、强碱、部分碱性氧化物、大部分盐类都是强电解质。
(7)弱强电解质:在水溶液里部分电离的电解质。包括弱酸、弱碱、水与少数盐。
