2015-2022年全国各地高考化学真题汇编:填空题(Word含答案)
文档属性
| 名称 | 2015-2022年全国各地高考化学真题汇编:填空题(Word含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 634.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-22 16:06:04 | ||
图片预览


文档简介
2015-2022年全国各地高考化学真题汇编:填空题
1.(2018·北京·高考真题)碳、氢、氧3种元素组成的有机物A,相对分子质量为102,含氢的质量分数为9.8%,分子氢原子个数为氧的5倍。
(1)A的分子式是_______。
(2)A有2个不同的含氧官能团,其名称是_______。
(3)一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团。
①A的结构简式是_______。
②A不能发生的反应是(填写序号字母)_______。
a.取代反应 b.消去反应 c.酯化反应 d.还原反应
(4)写出两个与A具有相同官能团、并带有支链的同分异构体的结构简式:_______、_______。
(5)A还有另一类酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,此反应的化学方程式是_______。
(6)已知环氧氯丙烷可与乙二醇发生如下聚合反应:
B也能与环氧氯丙烷发生类似反应生成高聚物,该高聚物的结构简式是_______。
2.(2018·山东·高考真题)金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是_________。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2H2O,该反应的还原剂是________,当1mol O2发生反应时,还原剂所失电子的物质的量为___mol;向CuSO4溶液中加入镁条时有气体生成,该气体是_________。
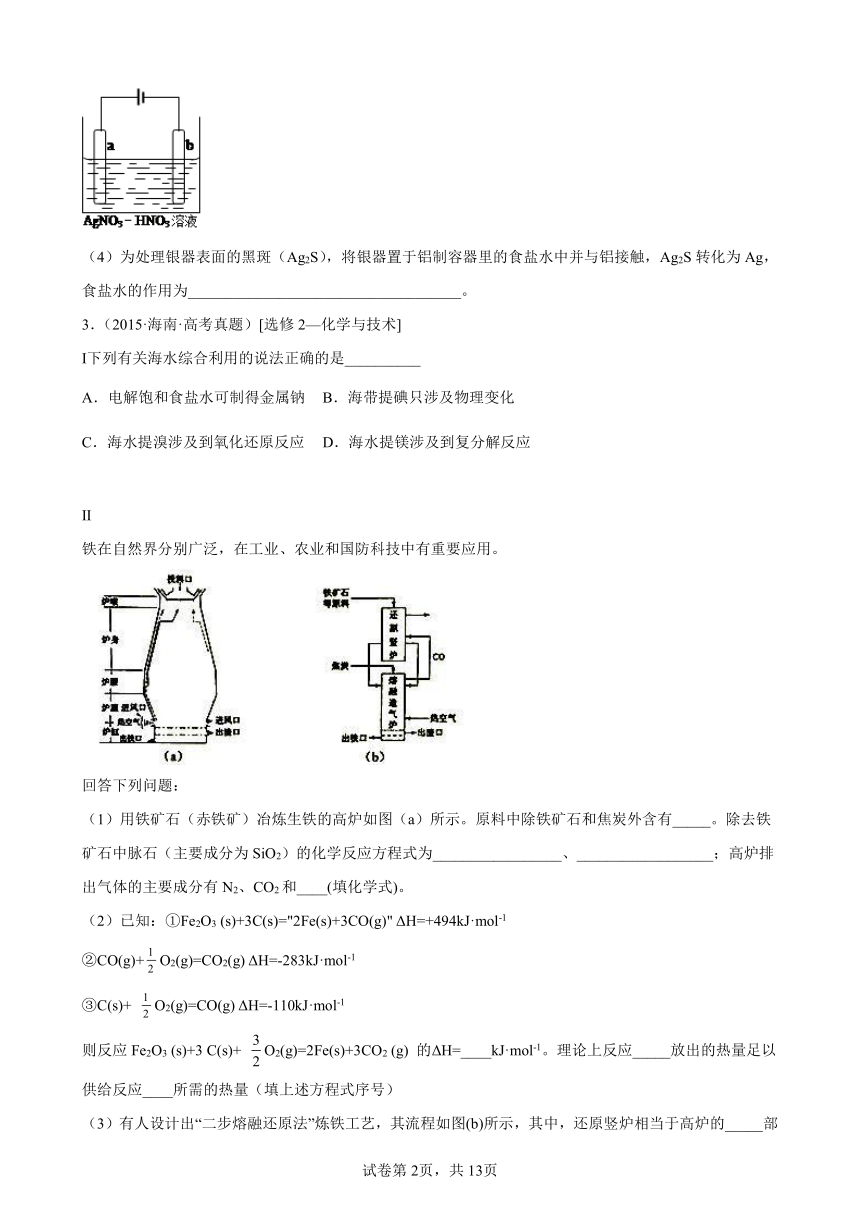
(3)下图为电解精炼银的示意图,______(填“a”或“b”)极为含有杂质的粗银,若b极 有少量红棕色气体产生,则生成该气体的电极反应式为________________。
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为____________________________________。
3.(2015·海南·高考真题)[选修2—化学与技术]
Ⅰ下列有关海水综合利用的说法正确的是__________
A.电解饱和食盐水可制得金属钠 B.海带提碘只涉及物理变化
C.海水提溴涉及到氧化还原反应 D.海水提镁涉及到复分解反应
Ⅱ
铁在自然界分别广泛,在工业、农业和国防科技中有重要应用。
回答下列问题:
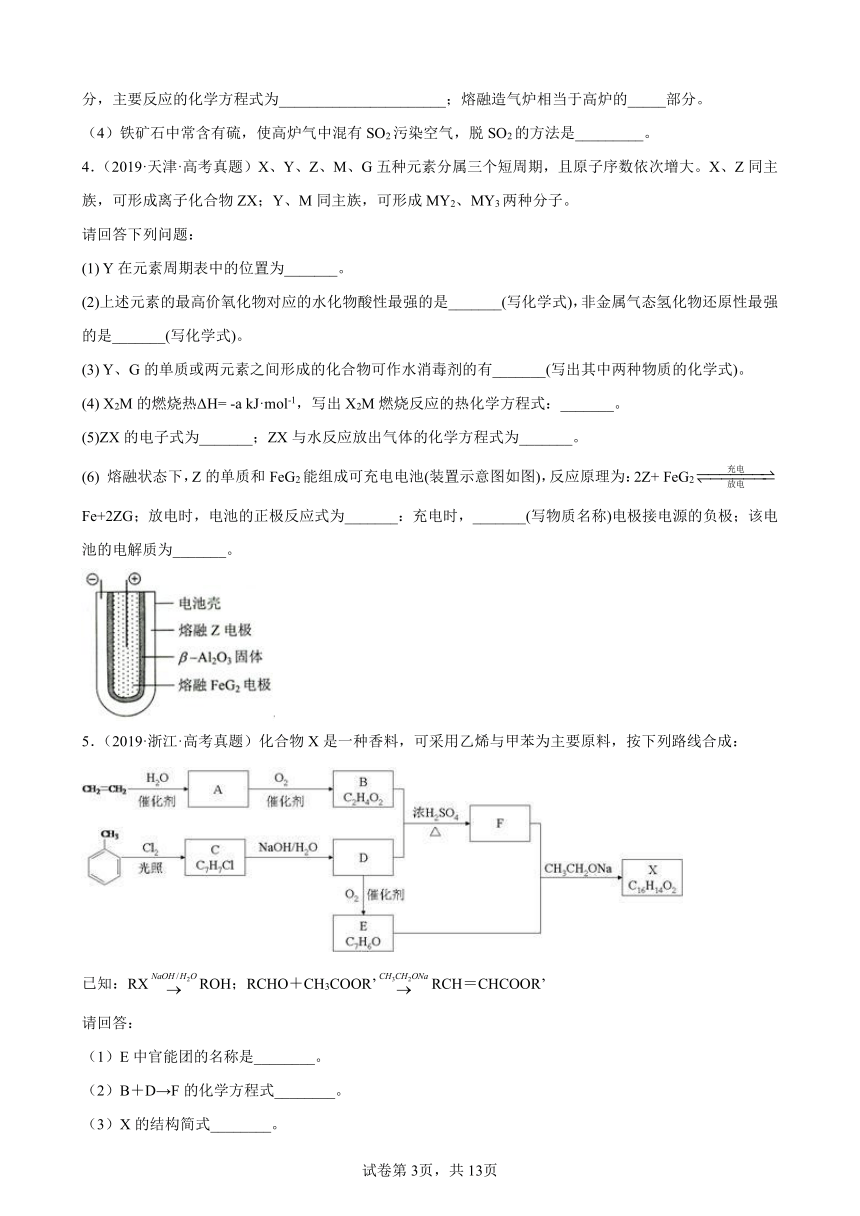
(1)用铁矿石(赤铁矿)冶炼生铁的高炉如图(a)所示。原料中除铁矿石和焦炭外含有_____。除去铁矿石中脉石(主要成分为SiO2)的化学反应方程式为_________________、__________________;高炉排出气体的主要成分有N2、CO2和____(填化学式)。
(2)已知:①Fe2O3 (s)+3C(s)="2Fe(s)+3CO(g)" ΔH=+494kJ·mol-1
②CO(g)+O2(g)=CO2(g) ΔH=-283kJ·mol-1
③C(s)+ O2(g)=CO(g) ΔH=-110kJ·mol-1
则反应Fe2O3 (s)+3 C(s)+ O2(g)=2Fe(s)+3CO2 (g) 的ΔH=____kJ·mol-1。理论上反应_____放出的热量足以供给反应____所需的热量(填上述方程式序号)
(3)有人设计出“二步熔融还原法”炼铁工艺,其流程如图(b)所示,其中,还原竖炉相当于高炉的_____部分,主要反应的化学方程式为______________________;熔融造气炉相当于高炉的_____部分。
(4)铁矿石中常含有硫,使高炉气中混有SO2污染空气,脱SO2的方法是_________。
4.(2019·天津·高考真题)X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1) Y在元素周期表中的位置为_______。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______(写化学式),非金属气态氢化物还原性最强的是_______(写化学式)。
(3) Y、G的单质或两元素之间形成的化合物可作水消毒剂的有_______(写出其中两种物质的化学式)。
(4) X2M的燃烧热ΔH= -a kJ·mol-1,写出X2M燃烧反应的热化学方程式:_______。
(5)ZX的电子式为_______;ZX与水反应放出气体的化学方程式为_______。
(6) 熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如图),反应原理为:2Z+ FeG2 Fe+2ZG;放电时,电池的正极反应式为_______:充电时,_______(写物质名称)电极接电源的负极;该电池的电解质为_______。
5.(2019·浙江·高考真题)化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:
已知:RXROH;RCHO+CH3COOR’RCH=CHCOOR’
请回答:
(1)E中官能团的名称是________。
(2)B+D→F的化学方程式________。
(3)X的结构简式________。
(4)对于化合物X,下列说法正确的是________。
A.能发生水解反应 B.不与浓硝酸发生取代反应
C.能使Br2/CCl4溶液褪色 D.能发生银镜反应
(5)下列化合物中属于F的同分异构体的是________。
6.(2020·湖南·高考真题)明矾石经处理后得到明矾【 KAl(SO4)2·12H2O】。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是__________________。
(2)从水浸后的滤液中得到K2SO4晶体的方法是_____________________。
(3)A12O3在一定条件下可制得AIN,其晶体结构如右图所示,该晶体中Al的配位数是____。
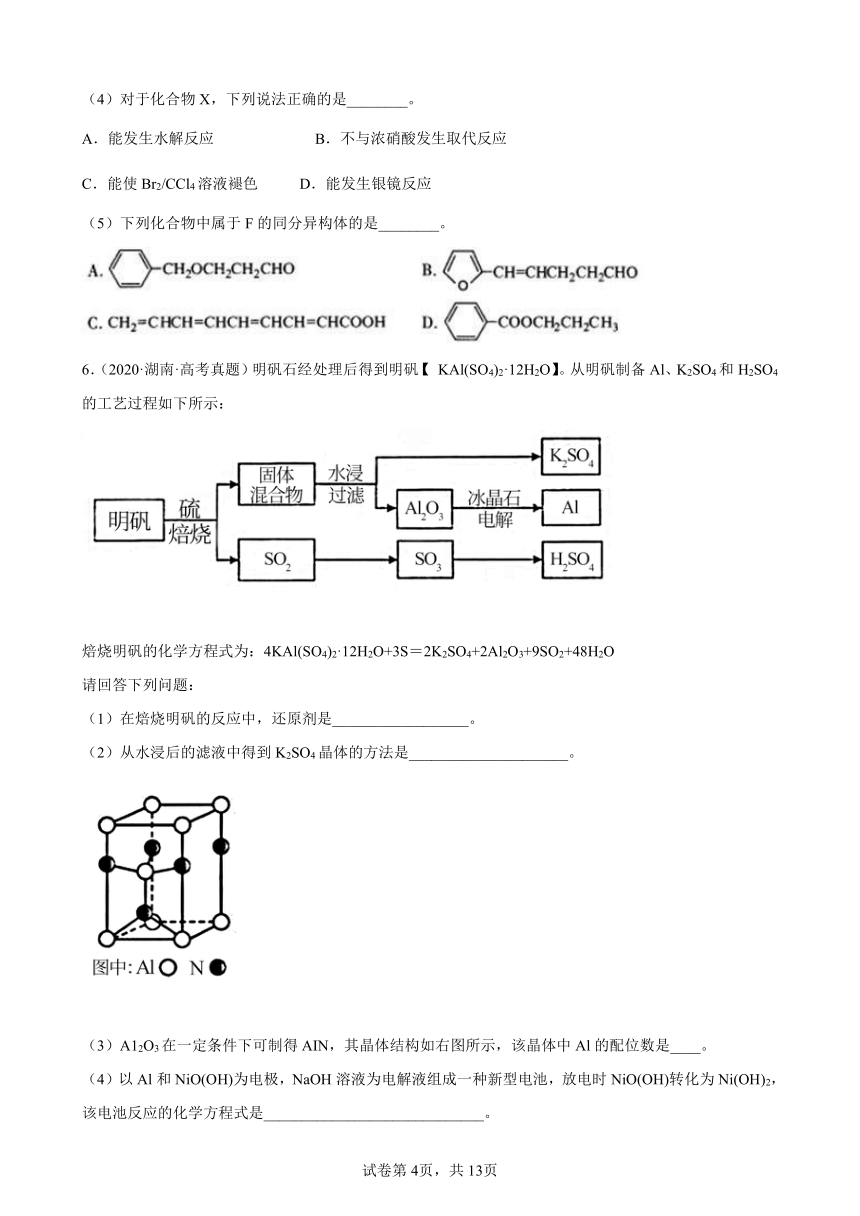
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是_____________________________。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g)2SO3(g) △H1= 一197 kJ/mol;
2H2O (g)=2H2O(1) △H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=一545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是__________________________。
焙烧948t明矾(M=474 g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫酸________t。
7.(2018·山东·高考真题)卤族元素包括F、Cl、Br等。
(1)下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是______。
(2)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为______,该功能陶瓷的化学式为______。
(3)BCl3和NCl3中心原子的杂化方式分别为______和______。第一电离能介于B、N之间的第二周期元素有______种。
(4)若BCl3与XYn通过B原子与X原子间的配位键结合形成配合物,则该配合物中提供孤对电子的原子是______。
8.(2018·全国·高考真题)〔化学—选修3:物质结构与性质〕
早期发现的一种天然准晶颗粒由三种Al、Cu、Fe元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_____________方法区分晶体、准晶体和非晶体。
(2)基态铁原子有________个未成对电子,三价铁离子的电子排布式为:___________可用硫氰化钾检验。
(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身还原成氧化亚铜,乙醛中碳原子的杂化轨道类型为_________;一摩尔乙醛分子中含有的σ键的数目为:______________。乙酸的沸点明显高于乙醛,其主要原因是:_______________________。氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有_____________个铜原子。
(4)铝单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为____________。列式表示铝单质的密度_______________g·cm-3(不必计算出结果)
9.(2019·全国·高考真题)A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是______(填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是_____(填分子式),原因是_______;A和B的氢化物所属的晶体类型分别为______和______。
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为______,中心原子的杂化轨道类型为______。
(4)化合物D2A的立体构型为___,中心原子的价层电子对数为______,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_________。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm,F的化学式为______:晶胞中A原子的配位数为_________;列式计算晶体F的密度(g.cm-3)_____。
10.(2017·北京·高考真题)某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
实验步骤 实验现象
将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。 产生气泡,析出疏松的红色固体,溶液逐渐变为无色。
反应结束后分离出溶液备用
红色固体用蒸馏水洗涤后,置于潮湿空气中。 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3]
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应_________________________________________;
化合反应_________________________________________。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可以观察到的现象是_________________________________________。
解释此现象的离子方程式是_________________________________________。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来。
①用铝与软锰矿冶炼锰的原理是(用化学方程式来表示)___________________________。
② MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是_________________________。
11.(2018·福建·高考真题)下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去)。已知A、B为气态单质,F是地壳中含量最多的金属元素的单质,E、H、I为氧化物,E为黑色固体,I为红棕色气体,M为红褐色沉淀。
请回答下列问题:
(1)B中所含元素位于周期表中第_______周期_______族。
(2)A在B中燃烧的现象是_______。
(3)D + E → B的反应中,被氧化与被还原的物质的量之比是_______。
(4)G + J → M的离子方程式是_______。
(5)Y受热分解的化学方程式是_______。
12.(2021·江苏·高考真题)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
回答下列问题:
(1)在一定条件下,转化为的反应为,该反应的平衡常数表达式为K= ______ ;过量的与溶液反应的化学方程式为______
(2)酸溶及后续过程中均需保持盐酸过量,其目的是______、______ 。
(3)通氯气氧化后时,发生的主要反应的离子方程式为______ ;该过程产生的为其可用碱溶液吸收,为其中污染空气的气体为 ______(写化学)。
13.(2018·全国·高考真题)〔化学—选修2:化学与技术〕
磷矿石主要以磷酸钙〔Ca3(PO4)2·H2O〕和磷灰石〔Ca3(OH)(PO4)3〕等形式存在。图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸。图(b)是热法磷酸生产过各中由磷灰石制单质磷的流程。
部分物质的相关性质如下:
熔点/℃ 沸点/℃ 备注
白磷 44 280.5
PH3 -133.8 -87.8 难溶于水,具有还原性
SiF4 -90 -86 易水解
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的 ℅。
(2)以磷灰石为原料,湿法磷酸过程中Ca3F(PO4)3反应的化学方程式为: 。现有1吨折合含有五氧化二磷约30%的磷灰石,最多可制得85℅的商品磷酸 吨。
(3)如图(b)所示,热法生产磷酸的第一步是将二氧化硅、过量焦炭与磷灰石混合,高温反应生成白磷。炉渣的主要成分是: (填化学式)冷凝塔1的主要沉积物是: 冷凝塔2的主要沉积物是:
(4)尾气中主要含有 ,还含有少量PH3、H2S和HF等,将尾气先通入纯碱溶液,可除去
再通入次氯酸钠溶液,可除去 (均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是: 。
14.(2019·北京·高考真题)顺丁橡胶、制备醇酸树脂的原料M以及杀菌剂N的合成路线如下:
(1)CH2=CH-CH=CH2的名称是_______;
(2)反应I的反应类型是(选填字母)_______;
a.加聚反应 b.缩聚反应
(3)顺式聚合物P的结构式是(选填字母)_______;
(4)A的相对分子质量为108.
①反应II的化学方程式是_____________________
②1molB完全转化为M所消耗的H2的质量是______g。
(5)反应III的化学方程式是______________________________。
(6)A的某些同分异构体在相同反应条件下也能生成B和C,写出其中一种同分异构体的结构简式__________。
15.(2021·天津·高考真题)黄铁矿主要成分是FeS2.某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量‘Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:SO2+2Fe3++2H2O=+2Fe2++4H+
Cr2O+6Fe2++14H+=2Cr3++6Fe3++7H2O
(1)样品中FeS2的质量分数是(假设杂质不参加反应)_______。
(2)若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式:_______。
(3)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为_______L,制得98%的硫酸质量为_______ t ,SO2全部转化为H2SO4时放出的热量是_______ kJ。
16.(2021·安徽·高考真题)LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:
已知:HCl的沸点是-85.0 ℃,HF的沸点是19.5 ℃。
(1)第①步反应中无水HF的作用是______、______。反应设备不能用玻璃材质的原因是______(用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的______溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PCl5极易水解,其产物为两种酸,写出PCl5水解的化学方程式:______。
(3)第④步分离采用的方法是______;第⑤步分离尾气中HF、HCl采用的方法是______。
(4)LiPF6产品中通常混有少量LiF.取样品wg。测得Li的物质的量为nmol,则该样品中LiPF6的物质的量为______mol(用含有w、n的代数式表示)。
17.(2020·江苏·高考真题)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)=6CaO(s)+P4(s)+10CO(g) H1=+3359.26kJ·mol-1
CaO(s)+SiO2(s)=CaSiO3(s) H2 =-89.61kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)=6CaSiO3(s)+P4(s)+10CO(g) H3
则 H3 =_______kJ·mol-1。
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4;60molCuSO4能氧化白磷的物质的量是_______。
(3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示。
①为获得尽可能纯的NaH2PO4,pH应控制在_______;pH=8时,溶液中主要含磷物种浓度大小关系为_______。
②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是_______(用离子方程式表示)。
(4)磷的化合物三氯氧磷()与季戊四醇()以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X 的核磁共振氢谱如图所示。
①酸性气体是_______(填化学式)。
②X的结构简式为_______。
18.(2020·海南·高考真题)反应A(g)B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
(1)上述反应的温度T1___ T2,平衡常数K(T1)___K(T2)。(填“大于”、“小于” 或“等于”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为_______。
②反应的平衡常数K=______。
③反应在0~5min区间的平均反应速率v(A)=_______。
19.(2020·全国·高考真题)化合物Ⅰ(C11H12O3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基。Ⅰ可以用E和H在一定条件下合成:
已知以下信息:
A的核磁共振氢谱表明其只有一种化学环境的氢;
R-CH=CH2R-CH2CH2OH;
化合物F苯环上的一氯代物只有两种;
通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
回答下列问题:
(1)A的化学名称为_________。
(2)D的结构简式为_________。
(3)E的分子式为___________。
(4)F生成G的化学方程式为________,该反应类型为__________。
(5)I的结构简式为___________。
(6)I的同系物J比I相对分子质量小14,J的同分异构体中能同时满足如下条件:
①苯环上只有两个取代基,②既能发生银镜反应,又能和饱和NaHCO3溶液反应放出CO2,共有______种(不考虑立体异构)。J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式______。
20.(2021·上海·高考真题)溴主要以Br-形式存在于海水中,海水呈弱碱性。工业上制备的Br2的操作步骤为:
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物
完成下列填空:
(1)Cl2氧化Br-应在_______条件下进行,目的是为了避免______。
(2)Br2可用热空气吹出,其原因是______。
(3)写出步骤③所发生的化学反应方程式。
用硫酸而不用盐酸酸化的原因可能是____________。步骤②的产品有时运输到目的地后再酸化,主要是因为_________
(4)为了除去工业Br2中微量的Cl2,可向工业Br2中______。
a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1. C5H10O2 羟基 醛基 b 、、、 、、(任写2个) CH3COOCH(CH3)2+H2OCH3COOH+(CH3)2CH-OH
2. bd Cu2S 4 H2 a 2H++NO3-+e-→NO2+H2O 做电解质溶液(或导电)
3. CD 石灰石 CaCO3CaO+CO2↑ CaO+SiO2CaSiO3 CO -355 ②③ ① 炉身 Fe2O3 + 3CO2Fe+3CO2 炉腹 用碱液吸收
4. 第二周期第VIA族 HClO4 H2S Cl2、O3、ClO2(任写两种,其他合理答案均可) H2S (g)+3/2O2(g)=SO2(g)+H2O(l) H=-akJ·mol-1 Na+[:H]- NaH+H2O=NaOH+H2↑ Fe2++2e-=Fe 钠 β-Al2O3
5. 醛基 AC BC
6. S 蒸发结晶 4 Al+3NiO(OH)+NaOH+H2O=3Ni(OH)2+NaAlO2 SO3(g)+H2O(l)=H2SO4(l)△H=-152kJ·mol-1 432
7. a 2 BN sp2 sp3 3 X
8. X射线衍射 4个 1s22s22p63s23p43d5 血红色 sp3、sp2 6NA 乙酸的分子间存在氢键,增加了分子之间的相互作用 16 12
9. O 1s22s22p63s23p3(或[Ne] 3s23p3) O3 O3相对分子质量较大,范德华力大 分子晶体 离子晶体 三角锥形 sp3 V形 4 2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl
(或2Cl2+2Na2CO3=Cl2O+CO2+2NaCl) Na2O 8 2.27g cm-3
10. 2Al+6H+=2Al3++3H2↑或2Al+3Cu2+=2Al3++3Cu 2Cu+O2+H2O+CO2=Cu2(OH)2CO3 白色沉淀生成,后沉淀逐渐溶解至消失 Al3++3OH-= Al(OH)3↓ Al(OH)3+OH-= AlO2-+2H2O 3MnO2+4Al 3Mn+2Al2O3 MnO2+H2O2+2H+=Mn2++O2↑+2H2O
11. 四 ⅦA 产生苍白色火焰 2∶1 3+Fe3++6H2O=3Al(OH)3↓+Fe(OH)3↓ 4Fe(NO3)32Fe2O3+ 12NO2↑+ 3O2↑
12. 提高铁元素的浸出率 抑制水解
13.(1)69; (2) Ca3F(PO4)3+5H2SO4=3H3PO4+ 5CaSO4+HF↑;0.49;(3)CaSiO3;液态白磷;固态白磷;(4)SiF4、CO;SiF4、HF、 H2S ;PH3 (5)产品纯度大(浓度大)
14. 3-丁二烯 a b 2CH2=CH-CH=CH2→ 6
15. 90.00% SO3(g) + H2O(1) = H2SO4(l) △H= -130.3 kJ/mol 3.36 × 106 15 3.43×107
16. 反应物 溶剂 SiO2+4HF=SiF4↑+2H2O NaHCO3 PCl5+4H2O=H3PO4+5HCl 过滤 冷凝
17. 2821. 6 3 mol 4~5. 5 c(HPO)>c(H2PO) 3Ca2++2HPO=Ca3(PO4)2↓+2H+ HCl
18. 小于 小于 0.085mol 0.082mol/L 0.007mol/(L·min)
19. 2-甲基-2-氯丙烷(或叔丁基氯) C4H8O2 +2Cl2+2HCl 取代反应 18
20. 酸性 溴中毒及生成的溴与碱发生反应(且碱性溶液中氯气与碱反应) Br2易挥发 3H2SO4+5NaBr+NaBrO3=3Na2SO4+3Br2+3H2O 溴酸能将Cl-氧化成Cl2,原因是Br2有强氧化性。 c
答案第1页,共2页
答案第1页,共2页
1.(2018·北京·高考真题)碳、氢、氧3种元素组成的有机物A,相对分子质量为102,含氢的质量分数为9.8%,分子氢原子个数为氧的5倍。
(1)A的分子式是_______。
(2)A有2个不同的含氧官能团,其名称是_______。
(3)一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团。
①A的结构简式是_______。
②A不能发生的反应是(填写序号字母)_______。
a.取代反应 b.消去反应 c.酯化反应 d.还原反应
(4)写出两个与A具有相同官能团、并带有支链的同分异构体的结构简式:_______、_______。
(5)A还有另一类酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,此反应的化学方程式是_______。
(6)已知环氧氯丙烷可与乙二醇发生如下聚合反应:
B也能与环氧氯丙烷发生类似反应生成高聚物,该高聚物的结构简式是_______。
2.(2018·山东·高考真题)金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是_________。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2H2O,该反应的还原剂是________,当1mol O2发生反应时,还原剂所失电子的物质的量为___mol;向CuSO4溶液中加入镁条时有气体生成,该气体是_________。
(3)下图为电解精炼银的示意图,______(填“a”或“b”)极为含有杂质的粗银,若b极 有少量红棕色气体产生,则生成该气体的电极反应式为________________。
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为____________________________________。
3.(2015·海南·高考真题)[选修2—化学与技术]
Ⅰ下列有关海水综合利用的说法正确的是__________
A.电解饱和食盐水可制得金属钠 B.海带提碘只涉及物理变化
C.海水提溴涉及到氧化还原反应 D.海水提镁涉及到复分解反应
Ⅱ
铁在自然界分别广泛,在工业、农业和国防科技中有重要应用。
回答下列问题:
(1)用铁矿石(赤铁矿)冶炼生铁的高炉如图(a)所示。原料中除铁矿石和焦炭外含有_____。除去铁矿石中脉石(主要成分为SiO2)的化学反应方程式为_________________、__________________;高炉排出气体的主要成分有N2、CO2和____(填化学式)。
(2)已知:①Fe2O3 (s)+3C(s)="2Fe(s)+3CO(g)" ΔH=+494kJ·mol-1
②CO(g)+O2(g)=CO2(g) ΔH=-283kJ·mol-1
③C(s)+ O2(g)=CO(g) ΔH=-110kJ·mol-1
则反应Fe2O3 (s)+3 C(s)+ O2(g)=2Fe(s)+3CO2 (g) 的ΔH=____kJ·mol-1。理论上反应_____放出的热量足以供给反应____所需的热量(填上述方程式序号)
(3)有人设计出“二步熔融还原法”炼铁工艺,其流程如图(b)所示,其中,还原竖炉相当于高炉的_____部分,主要反应的化学方程式为______________________;熔融造气炉相当于高炉的_____部分。
(4)铁矿石中常含有硫,使高炉气中混有SO2污染空气,脱SO2的方法是_________。
4.(2019·天津·高考真题)X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1) Y在元素周期表中的位置为_______。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______(写化学式),非金属气态氢化物还原性最强的是_______(写化学式)。
(3) Y、G的单质或两元素之间形成的化合物可作水消毒剂的有_______(写出其中两种物质的化学式)。
(4) X2M的燃烧热ΔH= -a kJ·mol-1,写出X2M燃烧反应的热化学方程式:_______。
(5)ZX的电子式为_______;ZX与水反应放出气体的化学方程式为_______。
(6) 熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如图),反应原理为:2Z+ FeG2 Fe+2ZG;放电时,电池的正极反应式为_______:充电时,_______(写物质名称)电极接电源的负极;该电池的电解质为_______。
5.(2019·浙江·高考真题)化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:
已知:RXROH;RCHO+CH3COOR’RCH=CHCOOR’
请回答:
(1)E中官能团的名称是________。
(2)B+D→F的化学方程式________。
(3)X的结构简式________。
(4)对于化合物X,下列说法正确的是________。
A.能发生水解反应 B.不与浓硝酸发生取代反应
C.能使Br2/CCl4溶液褪色 D.能发生银镜反应
(5)下列化合物中属于F的同分异构体的是________。
6.(2020·湖南·高考真题)明矾石经处理后得到明矾【 KAl(SO4)2·12H2O】。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是__________________。
(2)从水浸后的滤液中得到K2SO4晶体的方法是_____________________。
(3)A12O3在一定条件下可制得AIN,其晶体结构如右图所示,该晶体中Al的配位数是____。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是_____________________________。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g)2SO3(g) △H1= 一197 kJ/mol;
2H2O (g)=2H2O(1) △H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=一545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是__________________________。
焙烧948t明矾(M=474 g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫酸________t。
7.(2018·山东·高考真题)卤族元素包括F、Cl、Br等。
(1)下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是______。
(2)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为______,该功能陶瓷的化学式为______。
(3)BCl3和NCl3中心原子的杂化方式分别为______和______。第一电离能介于B、N之间的第二周期元素有______种。
(4)若BCl3与XYn通过B原子与X原子间的配位键结合形成配合物,则该配合物中提供孤对电子的原子是______。
8.(2018·全国·高考真题)〔化学—选修3:物质结构与性质〕
早期发现的一种天然准晶颗粒由三种Al、Cu、Fe元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_____________方法区分晶体、准晶体和非晶体。
(2)基态铁原子有________个未成对电子,三价铁离子的电子排布式为:___________可用硫氰化钾检验。
(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身还原成氧化亚铜,乙醛中碳原子的杂化轨道类型为_________;一摩尔乙醛分子中含有的σ键的数目为:______________。乙酸的沸点明显高于乙醛,其主要原因是:_______________________。氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有_____________个铜原子。
(4)铝单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为____________。列式表示铝单质的密度_______________g·cm-3(不必计算出结果)
9.(2019·全国·高考真题)A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是______(填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是_____(填分子式),原因是_______;A和B的氢化物所属的晶体类型分别为______和______。
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为______,中心原子的杂化轨道类型为______。
(4)化合物D2A的立体构型为___,中心原子的价层电子对数为______,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_________。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm,F的化学式为______:晶胞中A原子的配位数为_________;列式计算晶体F的密度(g.cm-3)_____。
10.(2017·北京·高考真题)某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
实验步骤 实验现象
将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。 产生气泡,析出疏松的红色固体,溶液逐渐变为无色。
反应结束后分离出溶液备用
红色固体用蒸馏水洗涤后,置于潮湿空气中。 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3]
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应_________________________________________;
化合反应_________________________________________。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可以观察到的现象是_________________________________________。
解释此现象的离子方程式是_________________________________________。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来。
①用铝与软锰矿冶炼锰的原理是(用化学方程式来表示)___________________________。
② MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是_________________________。
11.(2018·福建·高考真题)下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去)。已知A、B为气态单质,F是地壳中含量最多的金属元素的单质,E、H、I为氧化物,E为黑色固体,I为红棕色气体,M为红褐色沉淀。
请回答下列问题:
(1)B中所含元素位于周期表中第_______周期_______族。
(2)A在B中燃烧的现象是_______。
(3)D + E → B的反应中,被氧化与被还原的物质的量之比是_______。
(4)G + J → M的离子方程式是_______。
(5)Y受热分解的化学方程式是_______。
12.(2021·江苏·高考真题)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
回答下列问题:
(1)在一定条件下,转化为的反应为,该反应的平衡常数表达式为K= ______ ;过量的与溶液反应的化学方程式为______
(2)酸溶及后续过程中均需保持盐酸过量,其目的是______、______ 。
(3)通氯气氧化后时,发生的主要反应的离子方程式为______ ;该过程产生的为其可用碱溶液吸收,为其中污染空气的气体为 ______(写化学)。
13.(2018·全国·高考真题)〔化学—选修2:化学与技术〕
磷矿石主要以磷酸钙〔Ca3(PO4)2·H2O〕和磷灰石〔Ca3(OH)(PO4)3〕等形式存在。图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸。图(b)是热法磷酸生产过各中由磷灰石制单质磷的流程。
部分物质的相关性质如下:
熔点/℃ 沸点/℃ 备注
白磷 44 280.5
PH3 -133.8 -87.8 难溶于水,具有还原性
SiF4 -90 -86 易水解
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的 ℅。
(2)以磷灰石为原料,湿法磷酸过程中Ca3F(PO4)3反应的化学方程式为: 。现有1吨折合含有五氧化二磷约30%的磷灰石,最多可制得85℅的商品磷酸 吨。
(3)如图(b)所示,热法生产磷酸的第一步是将二氧化硅、过量焦炭与磷灰石混合,高温反应生成白磷。炉渣的主要成分是: (填化学式)冷凝塔1的主要沉积物是: 冷凝塔2的主要沉积物是:
(4)尾气中主要含有 ,还含有少量PH3、H2S和HF等,将尾气先通入纯碱溶液,可除去
再通入次氯酸钠溶液,可除去 (均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是: 。
14.(2019·北京·高考真题)顺丁橡胶、制备醇酸树脂的原料M以及杀菌剂N的合成路线如下:
(1)CH2=CH-CH=CH2的名称是_______;
(2)反应I的反应类型是(选填字母)_______;
a.加聚反应 b.缩聚反应
(3)顺式聚合物P的结构式是(选填字母)_______;
(4)A的相对分子质量为108.
①反应II的化学方程式是_____________________
②1molB完全转化为M所消耗的H2的质量是______g。
(5)反应III的化学方程式是______________________________。
(6)A的某些同分异构体在相同反应条件下也能生成B和C,写出其中一种同分异构体的结构简式__________。
15.(2021·天津·高考真题)黄铁矿主要成分是FeS2.某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量‘Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:SO2+2Fe3++2H2O=+2Fe2++4H+
Cr2O+6Fe2++14H+=2Cr3++6Fe3++7H2O
(1)样品中FeS2的质量分数是(假设杂质不参加反应)_______。
(2)若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式:_______。
(3)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为_______L,制得98%的硫酸质量为_______ t ,SO2全部转化为H2SO4时放出的热量是_______ kJ。
16.(2021·安徽·高考真题)LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:
已知:HCl的沸点是-85.0 ℃,HF的沸点是19.5 ℃。
(1)第①步反应中无水HF的作用是______、______。反应设备不能用玻璃材质的原因是______(用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的______溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PCl5极易水解,其产物为两种酸,写出PCl5水解的化学方程式:______。
(3)第④步分离采用的方法是______;第⑤步分离尾气中HF、HCl采用的方法是______。
(4)LiPF6产品中通常混有少量LiF.取样品wg。测得Li的物质的量为nmol,则该样品中LiPF6的物质的量为______mol(用含有w、n的代数式表示)。
17.(2020·江苏·高考真题)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)=6CaO(s)+P4(s)+10CO(g) H1=+3359.26kJ·mol-1
CaO(s)+SiO2(s)=CaSiO3(s) H2 =-89.61kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)=6CaSiO3(s)+P4(s)+10CO(g) H3
则 H3 =_______kJ·mol-1。
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4;60molCuSO4能氧化白磷的物质的量是_______。
(3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示。
①为获得尽可能纯的NaH2PO4,pH应控制在_______;pH=8时,溶液中主要含磷物种浓度大小关系为_______。
②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是_______(用离子方程式表示)。
(4)磷的化合物三氯氧磷()与季戊四醇()以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X 的核磁共振氢谱如图所示。
①酸性气体是_______(填化学式)。
②X的结构简式为_______。
18.(2020·海南·高考真题)反应A(g)B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
(1)上述反应的温度T1___ T2,平衡常数K(T1)___K(T2)。(填“大于”、“小于” 或“等于”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为_______。
②反应的平衡常数K=______。
③反应在0~5min区间的平均反应速率v(A)=_______。
19.(2020·全国·高考真题)化合物Ⅰ(C11H12O3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基。Ⅰ可以用E和H在一定条件下合成:
已知以下信息:
A的核磁共振氢谱表明其只有一种化学环境的氢;
R-CH=CH2R-CH2CH2OH;
化合物F苯环上的一氯代物只有两种;
通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
回答下列问题:
(1)A的化学名称为_________。
(2)D的结构简式为_________。
(3)E的分子式为___________。
(4)F生成G的化学方程式为________,该反应类型为__________。
(5)I的结构简式为___________。
(6)I的同系物J比I相对分子质量小14,J的同分异构体中能同时满足如下条件:
①苯环上只有两个取代基,②既能发生银镜反应,又能和饱和NaHCO3溶液反应放出CO2,共有______种(不考虑立体异构)。J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式______。
20.(2021·上海·高考真题)溴主要以Br-形式存在于海水中,海水呈弱碱性。工业上制备的Br2的操作步骤为:
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物
完成下列填空:
(1)Cl2氧化Br-应在_______条件下进行,目的是为了避免______。
(2)Br2可用热空气吹出,其原因是______。
(3)写出步骤③所发生的化学反应方程式。
用硫酸而不用盐酸酸化的原因可能是____________。步骤②的产品有时运输到目的地后再酸化,主要是因为_________
(4)为了除去工业Br2中微量的Cl2,可向工业Br2中______。
a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1. C5H10O2 羟基 醛基 b 、、、 、、(任写2个) CH3COOCH(CH3)2+H2OCH3COOH+(CH3)2CH-OH
2. bd Cu2S 4 H2 a 2H++NO3-+e-→NO2+H2O 做电解质溶液(或导电)
3. CD 石灰石 CaCO3CaO+CO2↑ CaO+SiO2CaSiO3 CO -355 ②③ ① 炉身 Fe2O3 + 3CO2Fe+3CO2 炉腹 用碱液吸收
4. 第二周期第VIA族 HClO4 H2S Cl2、O3、ClO2(任写两种,其他合理答案均可) H2S (g)+3/2O2(g)=SO2(g)+H2O(l) H=-akJ·mol-1 Na+[:H]- NaH+H2O=NaOH+H2↑ Fe2++2e-=Fe 钠 β-Al2O3
5. 醛基 AC BC
6. S 蒸发结晶 4 Al+3NiO(OH)+NaOH+H2O=3Ni(OH)2+NaAlO2 SO3(g)+H2O(l)=H2SO4(l)△H=-152kJ·mol-1 432
7. a 2 BN sp2 sp3 3 X
8. X射线衍射 4个 1s22s22p63s23p43d5 血红色 sp3、sp2 6NA 乙酸的分子间存在氢键,增加了分子之间的相互作用 16 12
9. O 1s22s22p63s23p3(或[Ne] 3s23p3) O3 O3相对分子质量较大,范德华力大 分子晶体 离子晶体 三角锥形 sp3 V形 4 2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl
(或2Cl2+2Na2CO3=Cl2O+CO2+2NaCl) Na2O 8 2.27g cm-3
10. 2Al+6H+=2Al3++3H2↑或2Al+3Cu2+=2Al3++3Cu 2Cu+O2+H2O+CO2=Cu2(OH)2CO3 白色沉淀生成,后沉淀逐渐溶解至消失 Al3++3OH-= Al(OH)3↓ Al(OH)3+OH-= AlO2-+2H2O 3MnO2+4Al 3Mn+2Al2O3 MnO2+H2O2+2H+=Mn2++O2↑+2H2O
11. 四 ⅦA 产生苍白色火焰 2∶1 3+Fe3++6H2O=3Al(OH)3↓+Fe(OH)3↓ 4Fe(NO3)32Fe2O3+ 12NO2↑+ 3O2↑
12. 提高铁元素的浸出率 抑制水解
13.(1)69; (2) Ca3F(PO4)3+5H2SO4=3H3PO4+ 5CaSO4+HF↑;0.49;(3)CaSiO3;液态白磷;固态白磷;(4)SiF4、CO;SiF4、HF、 H2S ;PH3 (5)产品纯度大(浓度大)
14. 3-丁二烯 a b 2CH2=CH-CH=CH2→ 6
15. 90.00% SO3(g) + H2O(1) = H2SO4(l) △H= -130.3 kJ/mol 3.36 × 106 15 3.43×107
16. 反应物 溶剂 SiO2+4HF=SiF4↑+2H2O NaHCO3 PCl5+4H2O=H3PO4+5HCl 过滤 冷凝
17. 2821. 6 3 mol 4~5. 5 c(HPO)>c(H2PO) 3Ca2++2HPO=Ca3(PO4)2↓+2H+ HCl
18. 小于 小于 0.085mol 0.082mol/L 0.007mol/(L·min)
19. 2-甲基-2-氯丙烷(或叔丁基氯) C4H8O2 +2Cl2+2HCl 取代反应 18
20. 酸性 溴中毒及生成的溴与碱发生反应(且碱性溶液中氯气与碱反应) Br2易挥发 3H2SO4+5NaBr+NaBrO3=3Na2SO4+3Br2+3H2O 溴酸能将Cl-氧化成Cl2,原因是Br2有强氧化性。 c
答案第1页,共2页
答案第1页,共2页
同课章节目录
