粤教版化学九年级上册同步课件:3.2 制取氧气第 2 课 时 高锰酸钾制氧气(共23张PPT内嵌视频)
文档属性
| 名称 | 粤教版化学九年级上册同步课件:3.2 制取氧气第 2 课 时 高锰酸钾制氧气(共23张PPT内嵌视频) |

|
|
| 格式 | pptx | ||
| 文件大小 | 61.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-22 17:33:58 | ||
图片预览




文档简介
(共23张PPT)
第三章 维持生命之气
—氧气
3.2 制取氧气
第 2 课 时
高锰酸钾制氧气
1.了解实验室制取氧气的主要方法和原理;
2.了解加热高锰酸钾制氧气的实验原理和操作步骤;
3.了解加热氯酸钾和二氧化锰混合物制取氧气的原理。
学习目标
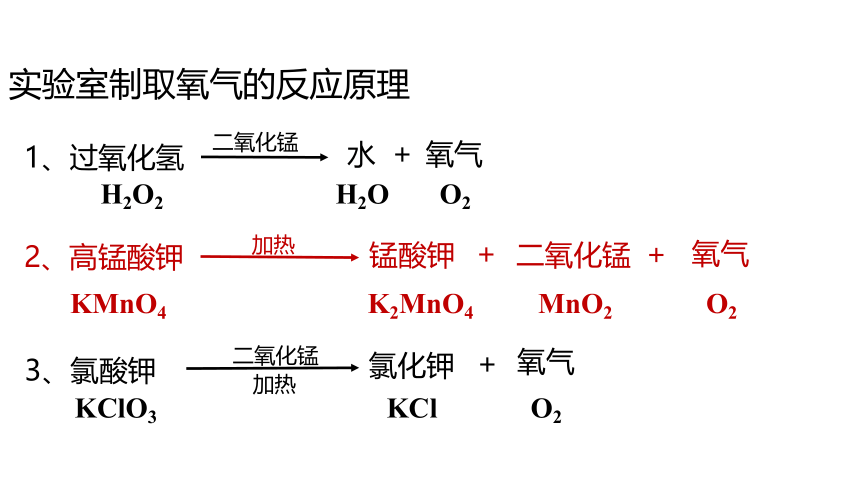
实验室制取氧气的反应原理
H2O2 H2O O2
KClO3 KCl O2
水
1、过氧化氢
氧气
+
二氧化锰
3、氯酸钾
氯化钾
+
氧气
二氧化锰
加热
2、高锰酸钾
锰酸钾
+
二氧化锰
+
氧气
加热
KMnO4 K2MnO4 MnO2 O2
新知导入
新知导入
加热高锰酸钾制取氧气—药品
高锰酸钾:暗紫色固体,可溶于水。
新知探究
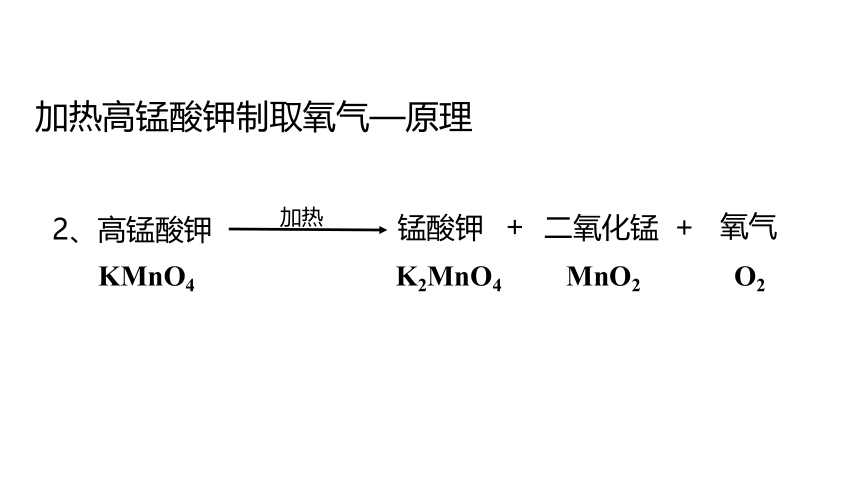
加热高锰酸钾制取氧气—原理
2、高锰酸钾
锰酸钾
+
二氧化锰
+
氧气
加热
KMnO4 K2MnO4 MnO2 O2
新知探究
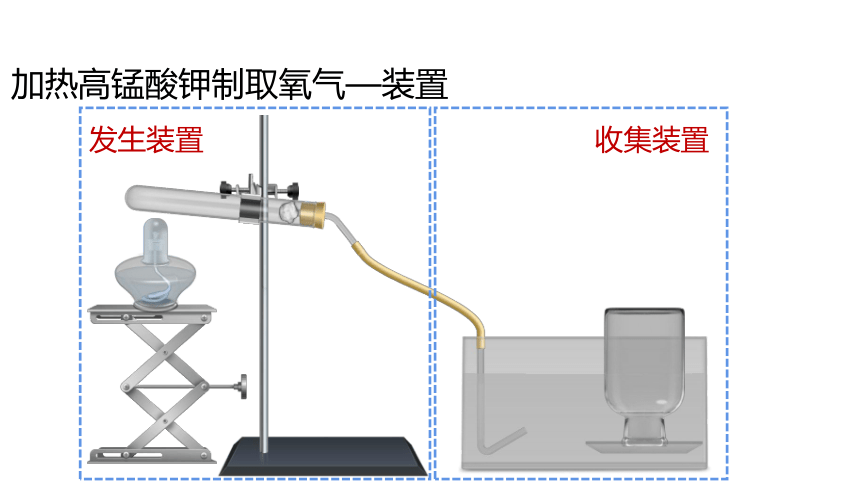
加热高锰酸钾制取氧气—装置
发生装置
收集装置
新知探究
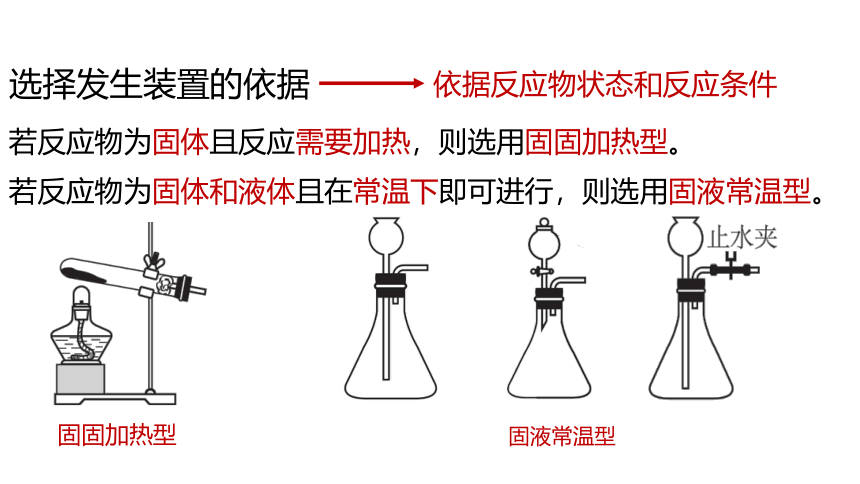
选择发生装置的依据
依据反应物状态和反应条件
若反应物为固体且反应需要加热,则选用固固加热型。
若反应物为固体和液体且在常温下即可进行,则选用固液常温型。
固固加热型
固液常温型
新知探究
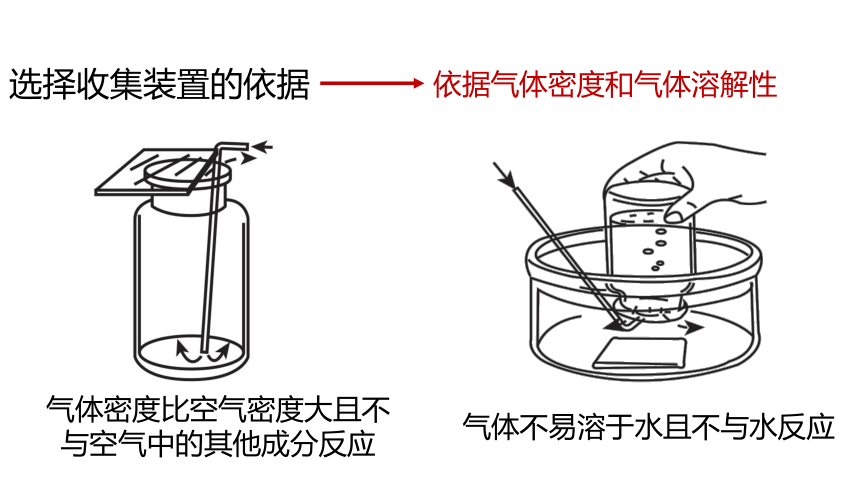
选择收集装置的依据
依据气体密度和气体溶解性
气体密度比空气密度大且不与空气中的其他成分反应
气体不易溶于水且不与水反应
新知探究
加热高锰酸钾制取氧气—步骤
1 、查(检查装置气密性)
2 、装(把药品装在试管底部)
3 、定(把试管固定在铁架台上)
4 、点(点燃酒精灯,先预热、后集中加热)
5 、收(收集气体)
6 、离(撤离导管)
7 、熄(熄灭酒精灯)
可简单归纳为:
茶、
庄、
定、
点、
收、
利、
息
新知探究
装置的气密性检查
将装置导管口的一端伸入水中,再用双手紧握住试管壁,手掌的温度高,使试管中的空气受热膨胀,经导管口排出气泡,手掌离开后导管中形成一段稳定的水柱。这一现象说明了装置不漏气,反之则装置漏气。
新知探究
加热高锰酸钾制取氧气
新知探究
①试管口要略向下倾斜,防止药品中的水分受热后变成水蒸气,再冷凝成水珠倒流回试管底部,使试管炸裂。
②试管内导管稍微露出橡皮塞即可,便于气体排出。
③用高锰酸钾制氧气时,试管口处应放一团棉花
④铁夹要夹在离试管口1/3处。
⑤要用酒精灯的外焰对准药品部位加热;加热时先要将酒精灯在试管下方来回移动,让试管均匀受热,然后对准药品部位加热。
新知探究
⑥用排水法集气时,集气瓶充满水后倒放入水槽中(瓶口要在水面下),导管伸到瓶口处即可;用向上排空气法集气时,集气瓶正放,导管口要接近集气瓶底部。
⑦用排水法集气时,应注意当气泡从导管口连续、均匀地放出时再收集,否则收集的气体中混有空气。当集气瓶口有气泡冒出时,证明已满。
⑧停止反应时,应先把导管从水槽里拿出,在熄灭酒精灯(防止水倒流到试管,导致试管炸裂)。
⑨收集满氧气的集气瓶应正放,瓶口处盖上玻璃片。
⑩用高锰酸钾制氧气时,试管口处应放一团棉花。
新知探究
检验方法
氧气的检验:用带火星木条伸入集气瓶内
氧气的验满:用带火星木条放在集气瓶口
新知探究
氧气的工业制法
空气
降温加压
液化
液态空气
-196℃
氮气
液氧
(贮存在蓝色钢瓶中)
氧气的工业制法是物理变化
升温
新知探究
工业制取氧气
新知探究
膜分离技术制取氧气
新知探究
课堂小结
制取氧气
原理:氮气和氧气的沸点不同
原理、装置、步骤、检验
工业制氧气
氯酸钾→氯化钾氧气
过氧化氢→水+氧气
高锰酸钾→锰酸钾+二氧化锰+氧气
方法:分离液态空气—物理变化
1、实验室可通过加热高锰酸钾固体制取氧气,下列实验操作正确的是( )
A
A.组装好装置后,检查装置的气密性
B.加入药品后,直接将酒精灯火焰对准药品加热
C.水槽中有气泡冒出时,立即收集气体
D.实验结束时,先移走酒精灯再从水槽中移出导管
课堂达标
2、工业上利用分离液态空气法制氧气的依据是( )
D
A. 氧气与氮气的化学性质不同
B. 氧气和氮气在水中的溶解性不同
C. 氧气与氮气的密度不同
D. 氧气与氮气的沸点不同
课堂达标
3、实验室用加热高锰酸钾制取氧气,选择发生装置时,
下列不需考虑的是( )
A.反应物的状态
B.质量
C.反应的条件
D.反应物是否为固体
B
课堂达标
谢 谢 观 看
第三章 维持生命之气
—氧气
3.2 制取氧气
第 2 课 时
高锰酸钾制氧气
1.了解实验室制取氧气的主要方法和原理;
2.了解加热高锰酸钾制氧气的实验原理和操作步骤;
3.了解加热氯酸钾和二氧化锰混合物制取氧气的原理。
学习目标
实验室制取氧气的反应原理
H2O2 H2O O2
KClO3 KCl O2
水
1、过氧化氢
氧气
+
二氧化锰
3、氯酸钾
氯化钾
+
氧气
二氧化锰
加热
2、高锰酸钾
锰酸钾
+
二氧化锰
+
氧气
加热
KMnO4 K2MnO4 MnO2 O2
新知导入
新知导入
加热高锰酸钾制取氧气—药品
高锰酸钾:暗紫色固体,可溶于水。
新知探究
加热高锰酸钾制取氧气—原理
2、高锰酸钾
锰酸钾
+
二氧化锰
+
氧气
加热
KMnO4 K2MnO4 MnO2 O2
新知探究
加热高锰酸钾制取氧气—装置
发生装置
收集装置
新知探究
选择发生装置的依据
依据反应物状态和反应条件
若反应物为固体且反应需要加热,则选用固固加热型。
若反应物为固体和液体且在常温下即可进行,则选用固液常温型。
固固加热型
固液常温型
新知探究
选择收集装置的依据
依据气体密度和气体溶解性
气体密度比空气密度大且不与空气中的其他成分反应
气体不易溶于水且不与水反应
新知探究
加热高锰酸钾制取氧气—步骤
1 、查(检查装置气密性)
2 、装(把药品装在试管底部)
3 、定(把试管固定在铁架台上)
4 、点(点燃酒精灯,先预热、后集中加热)
5 、收(收集气体)
6 、离(撤离导管)
7 、熄(熄灭酒精灯)
可简单归纳为:
茶、
庄、
定、
点、
收、
利、
息
新知探究
装置的气密性检查
将装置导管口的一端伸入水中,再用双手紧握住试管壁,手掌的温度高,使试管中的空气受热膨胀,经导管口排出气泡,手掌离开后导管中形成一段稳定的水柱。这一现象说明了装置不漏气,反之则装置漏气。
新知探究
加热高锰酸钾制取氧气
新知探究
①试管口要略向下倾斜,防止药品中的水分受热后变成水蒸气,再冷凝成水珠倒流回试管底部,使试管炸裂。
②试管内导管稍微露出橡皮塞即可,便于气体排出。
③用高锰酸钾制氧气时,试管口处应放一团棉花
④铁夹要夹在离试管口1/3处。
⑤要用酒精灯的外焰对准药品部位加热;加热时先要将酒精灯在试管下方来回移动,让试管均匀受热,然后对准药品部位加热。
新知探究
⑥用排水法集气时,集气瓶充满水后倒放入水槽中(瓶口要在水面下),导管伸到瓶口处即可;用向上排空气法集气时,集气瓶正放,导管口要接近集气瓶底部。
⑦用排水法集气时,应注意当气泡从导管口连续、均匀地放出时再收集,否则收集的气体中混有空气。当集气瓶口有气泡冒出时,证明已满。
⑧停止反应时,应先把导管从水槽里拿出,在熄灭酒精灯(防止水倒流到试管,导致试管炸裂)。
⑨收集满氧气的集气瓶应正放,瓶口处盖上玻璃片。
⑩用高锰酸钾制氧气时,试管口处应放一团棉花。
新知探究
检验方法
氧气的检验:用带火星木条伸入集气瓶内
氧气的验满:用带火星木条放在集气瓶口
新知探究
氧气的工业制法
空气
降温加压
液化
液态空气
-196℃
氮气
液氧
(贮存在蓝色钢瓶中)
氧气的工业制法是物理变化
升温
新知探究
工业制取氧气
新知探究
膜分离技术制取氧气
新知探究
课堂小结
制取氧气
原理:氮气和氧气的沸点不同
原理、装置、步骤、检验
工业制氧气
氯酸钾→氯化钾氧气
过氧化氢→水+氧气
高锰酸钾→锰酸钾+二氧化锰+氧气
方法:分离液态空气—物理变化
1、实验室可通过加热高锰酸钾固体制取氧气,下列实验操作正确的是( )
A
A.组装好装置后,检查装置的气密性
B.加入药品后,直接将酒精灯火焰对准药品加热
C.水槽中有气泡冒出时,立即收集气体
D.实验结束时,先移走酒精灯再从水槽中移出导管
课堂达标
2、工业上利用分离液态空气法制氧气的依据是( )
D
A. 氧气与氮气的化学性质不同
B. 氧气和氮气在水中的溶解性不同
C. 氧气与氮气的密度不同
D. 氧气与氮气的沸点不同
课堂达标
3、实验室用加热高锰酸钾制取氧气,选择发生装置时,
下列不需考虑的是( )
A.反应物的状态
B.质量
C.反应的条件
D.反应物是否为固体
B
课堂达标
谢 谢 观 看
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
