人教版化学九年级下册 第九单元 课题3 溶液的浓度(第2课时)学案
文档属性
| 名称 | 人教版化学九年级下册 第九单元 课题3 溶液的浓度(第2课时)学案 |

|
|
| 格式 | docx | ||
| 文件大小 | 246.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-22 00:00:00 | ||
图片预览


文档简介
课题3 溶液的浓度(第2课时)
一、自主学习
【学习目标】
1、能配制一定浓度的溶液。
2、能利用有关浓度知识解决生产生活中的实际问题。
3、能进行浓度与化学方程式相结合的综合运算。
重、难点:有关溶液中溶质的质量分数的计算。
【课前知识积累】
(一)配制一定浓度的溶液
注射用的生理盐水的浓度为0.9%,医用酒精的浓度为70%~75%,浓度一定的溶液是如何配制的呢?阅读教材,完成下列问题:
1、配制浓度一定的溶液的一般步骤是:① 、② 、③ 、④ 。
2、要配制100g5%的食盐水:①需要食盐 g,水 mL。②需要的主要仪器是 、 、 、药匙、玻璃棒等。
二、合作探究
(一)配制一定浓度的溶液的实验步骤
分小组完成【实验活动5】一定浓度的溶液的配制。
【实验步骤】
(1)配制浓度为6%的氯化钠溶液50g。
①计算:需氯化钠 g,需水 g。
②称量:用托盘天平称量所需的氯化钠,放入烧杯中。
③量取:用量筒量取所需的水,倒入烧杯中。
④溶解:用玻璃棒搅拌,使氯化钠溶解。
(2)配制浓度为3%的氯化钠溶液50g。
①计算:需6%的氯化钠溶液 g, mL,需水 g, mL。
②量取:用量筒量取所需的6%氯化钠溶液和水,倒入烧杯中。
③溶解:用玻璃棒搅拌,使混合均匀。
【实验分析与结论】
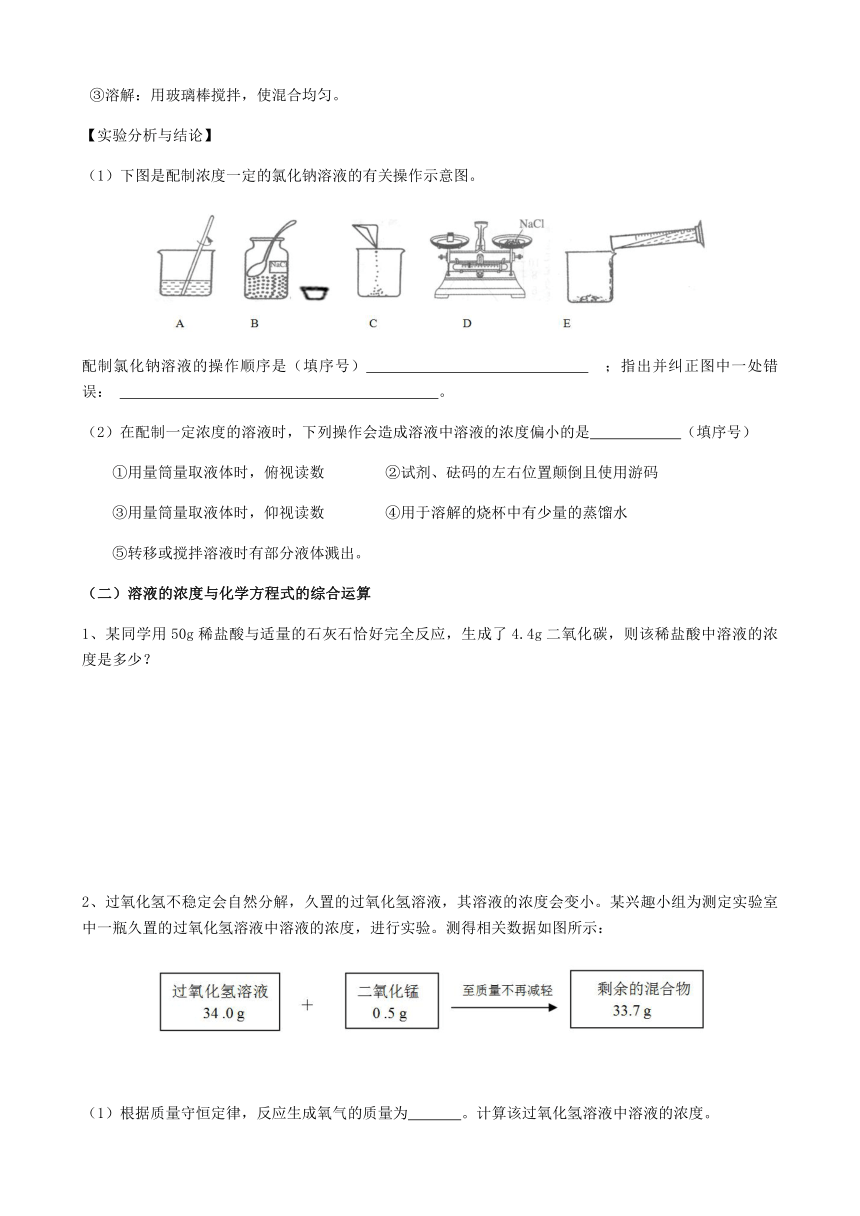
(1)下图是配制浓度一定的氯化钠溶液的有关操作示意图。
配制氯化钠溶液的操作顺序是(填序号) ;指出并纠正图中一处错误: 。
(2)在配制一定浓度的溶液时,下列操作会造成溶液中溶液的浓度偏小的是 (填序号)
①用量筒量取液体时,俯视读数 ②试剂、砝码的左右位置颠倒且使用游码
③用量筒量取液体时,仰视读数 ④用于溶解的烧杯中有少量的蒸馏水
⑤转移或搅拌溶液时有部分液体溅出。
(二)溶液的浓度与化学方程式的综合运算
1、某同学用50g稀盐酸与适量的石灰石恰好完全反应,生成了4.4g二氧化碳,则该稀盐酸中溶液的浓度是多少?
2、过氧化氢不稳定会自然分解,久置的过氧化氢溶液,其溶液的浓度会变小。某兴趣小组为测定实验室中一瓶久置的过氧化氢溶液中溶液的浓度,进行实验。测得相关数据如图所示:
(1)根据质量守恒定律,反应生成氧气的质量为 。计算该过氧化氢溶液中溶液的浓度。
3、实验室欲用浓度为37%,密度为1.18g/cm3的浓盐酸配制110g浓度为10%的稀盐酸。
(1)计算:需要浓盐酸 mL,水 mL。
(2)量取:用规格为 mL(填“50”或“100”)的量筒量取浓盐酸,倒入烧杯,再用规格为 mL(填“50”或“100”)的量筒量取水。
4、要配制100g浓度为10%的氯化钠溶液,下列操作中正确的是 ( )
A.将10g氯化钠固体直接放在天平的托盘上称量
B.量取90mL水时,俯视读数
C.为加快固体溶解,用温度计搅拌溶液
D.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签
5、制作“叶脉书签”需要100g浓度为10%的氢氧化钠溶液。请问:
(1)配制时需要氢氧化钠固体的质量是 g,水的质量是 g。
(2)若用20%的氢氧化钠溶液和水配制,需要20%的氢氧化钠溶液的质量是 g。
6、实验室有一瓶未知浓度的BaCl2溶液,某同学取出150g该溶液于烧杯中,向其中逐滴加入溶质质量分数为26.5%的Na2CO3溶液。反应过程中生成沉淀的质量与所用Na2CO3溶液质量的关系如下图所示。已知:BaCl2+Na2CO3=BaCO3↓+2NaCl ,请计算:
(1)配制26.5%的Na2CO3溶液80g,需要Na2CO3固体 g。
(2)BaCl2溶液的浓度是多少?(写出计算过程,结果保留到0.1%)
【反思与小结】
配制溶液一般要经过以下几步:
①通过计算求出溶质、溶剂的质量(或体积);②利用 称量固体物质质量;③用 量取液体体积;④将溶质、溶剂混合,并使其充分溶解;⑤将配制好的溶液装入试剂瓶,贴好标签,并注明试剂名称、溶质的化学式、溶液的浓度。
三、当堂测评:
1、某同学在实验室用氯化钠固体和蒸馏水配制100g浓度为15%的氯化钠溶液时,涉及以下操作:①称量、②溶解、③计算、④量取,正确的顺序是 (填序号)。
2、某同学欲配制6%的食盐水80g,在称量食盐时,他把食盐和砝码的位置放颠倒了(1g以下用游码),其它各步骤操作均正确,那么他实际上所配制的食盐水的浓度为( )
A.4.1% B.6.0% C.14.3% D.3.2%
3、无土栽培是一种在营养液中培育植物的农业高新技术,有良好的发展前景。某课外实验小组要配制150g浓度为1.4﹪的硝酸钾溶液用于配制营养液。
(1)需硝酸钾 g,需水 mL(水的密度是1.0g/cm3)
(2)配制此硝酸钾溶液的步骤为: 、 、 、溶解;配制过程中用到的仪器有 、 、 、烧杯、药匙和胶头滴管。
(3)若在量取水时俯视凹液面最低处,其它操作正确,则所得溶液的浓度为 1.4﹪(填“>”“<” 或 “=”)。
4、在一定的温度下,向一定量的饱和石灰水中加入少量生石灰(CaO),并恢复到原温度时,溶液中溶质的质量,溶剂的质量和溶液的质量及浓度会如何变化。 【已知CaO+ H2O=Ca(OH)2】
5、7.8g过氧化钠与足量的水反应,生成氧气的质量是多少 若反应后得到了40g氢氧化钠溶液,请计算氢氧化钠溶液的浓度。(化学方程式为:2Na2O2+2H2O=4NaOH+O2↑)
【中考直通车】
1.配制100g质量分数为10%的氢氧化钠溶液,称量氢氧化钠固体时除使用托盘天平(带砝码)和药匙外,还需要用到下列仪器中的 ( )
A.玻璃棒 B.烧杯 C.100 mL量筒 D.胶头滴管
2.实验室需要配制15%的氯化钠溶液50g。
(1)计算:需要氯化钠的质量为 。
(2)某同学按下图所示步骤依次操作:
其中操作错误的步骤是 (填字母序号);B中仪器的名称为 ;E中玻璃棒的作用是 。
(3)若上图A中砝码的质量为5g,游码为2.5g,则小明称得的氯化钠质量实际为 。
一、自主学习
【学习目标】
1、能配制一定浓度的溶液。
2、能利用有关浓度知识解决生产生活中的实际问题。
3、能进行浓度与化学方程式相结合的综合运算。
重、难点:有关溶液中溶质的质量分数的计算。
【课前知识积累】
(一)配制一定浓度的溶液
注射用的生理盐水的浓度为0.9%,医用酒精的浓度为70%~75%,浓度一定的溶液是如何配制的呢?阅读教材,完成下列问题:
1、配制浓度一定的溶液的一般步骤是:① 、② 、③ 、④ 。
2、要配制100g5%的食盐水:①需要食盐 g,水 mL。②需要的主要仪器是 、 、 、药匙、玻璃棒等。
二、合作探究
(一)配制一定浓度的溶液的实验步骤
分小组完成【实验活动5】一定浓度的溶液的配制。
【实验步骤】
(1)配制浓度为6%的氯化钠溶液50g。
①计算:需氯化钠 g,需水 g。
②称量:用托盘天平称量所需的氯化钠,放入烧杯中。
③量取:用量筒量取所需的水,倒入烧杯中。
④溶解:用玻璃棒搅拌,使氯化钠溶解。
(2)配制浓度为3%的氯化钠溶液50g。
①计算:需6%的氯化钠溶液 g, mL,需水 g, mL。
②量取:用量筒量取所需的6%氯化钠溶液和水,倒入烧杯中。
③溶解:用玻璃棒搅拌,使混合均匀。
【实验分析与结论】
(1)下图是配制浓度一定的氯化钠溶液的有关操作示意图。
配制氯化钠溶液的操作顺序是(填序号) ;指出并纠正图中一处错误: 。
(2)在配制一定浓度的溶液时,下列操作会造成溶液中溶液的浓度偏小的是 (填序号)
①用量筒量取液体时,俯视读数 ②试剂、砝码的左右位置颠倒且使用游码
③用量筒量取液体时,仰视读数 ④用于溶解的烧杯中有少量的蒸馏水
⑤转移或搅拌溶液时有部分液体溅出。
(二)溶液的浓度与化学方程式的综合运算
1、某同学用50g稀盐酸与适量的石灰石恰好完全反应,生成了4.4g二氧化碳,则该稀盐酸中溶液的浓度是多少?
2、过氧化氢不稳定会自然分解,久置的过氧化氢溶液,其溶液的浓度会变小。某兴趣小组为测定实验室中一瓶久置的过氧化氢溶液中溶液的浓度,进行实验。测得相关数据如图所示:
(1)根据质量守恒定律,反应生成氧气的质量为 。计算该过氧化氢溶液中溶液的浓度。
3、实验室欲用浓度为37%,密度为1.18g/cm3的浓盐酸配制110g浓度为10%的稀盐酸。
(1)计算:需要浓盐酸 mL,水 mL。
(2)量取:用规格为 mL(填“50”或“100”)的量筒量取浓盐酸,倒入烧杯,再用规格为 mL(填“50”或“100”)的量筒量取水。
4、要配制100g浓度为10%的氯化钠溶液,下列操作中正确的是 ( )
A.将10g氯化钠固体直接放在天平的托盘上称量
B.量取90mL水时,俯视读数
C.为加快固体溶解,用温度计搅拌溶液
D.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签
5、制作“叶脉书签”需要100g浓度为10%的氢氧化钠溶液。请问:
(1)配制时需要氢氧化钠固体的质量是 g,水的质量是 g。
(2)若用20%的氢氧化钠溶液和水配制,需要20%的氢氧化钠溶液的质量是 g。
6、实验室有一瓶未知浓度的BaCl2溶液,某同学取出150g该溶液于烧杯中,向其中逐滴加入溶质质量分数为26.5%的Na2CO3溶液。反应过程中生成沉淀的质量与所用Na2CO3溶液质量的关系如下图所示。已知:BaCl2+Na2CO3=BaCO3↓+2NaCl ,请计算:
(1)配制26.5%的Na2CO3溶液80g,需要Na2CO3固体 g。
(2)BaCl2溶液的浓度是多少?(写出计算过程,结果保留到0.1%)
【反思与小结】
配制溶液一般要经过以下几步:
①通过计算求出溶质、溶剂的质量(或体积);②利用 称量固体物质质量;③用 量取液体体积;④将溶质、溶剂混合,并使其充分溶解;⑤将配制好的溶液装入试剂瓶,贴好标签,并注明试剂名称、溶质的化学式、溶液的浓度。
三、当堂测评:
1、某同学在实验室用氯化钠固体和蒸馏水配制100g浓度为15%的氯化钠溶液时,涉及以下操作:①称量、②溶解、③计算、④量取,正确的顺序是 (填序号)。
2、某同学欲配制6%的食盐水80g,在称量食盐时,他把食盐和砝码的位置放颠倒了(1g以下用游码),其它各步骤操作均正确,那么他实际上所配制的食盐水的浓度为( )
A.4.1% B.6.0% C.14.3% D.3.2%
3、无土栽培是一种在营养液中培育植物的农业高新技术,有良好的发展前景。某课外实验小组要配制150g浓度为1.4﹪的硝酸钾溶液用于配制营养液。
(1)需硝酸钾 g,需水 mL(水的密度是1.0g/cm3)
(2)配制此硝酸钾溶液的步骤为: 、 、 、溶解;配制过程中用到的仪器有 、 、 、烧杯、药匙和胶头滴管。
(3)若在量取水时俯视凹液面最低处,其它操作正确,则所得溶液的浓度为 1.4﹪(填“>”“<” 或 “=”)。
4、在一定的温度下,向一定量的饱和石灰水中加入少量生石灰(CaO),并恢复到原温度时,溶液中溶质的质量,溶剂的质量和溶液的质量及浓度会如何变化。 【已知CaO+ H2O=Ca(OH)2】
5、7.8g过氧化钠与足量的水反应,生成氧气的质量是多少 若反应后得到了40g氢氧化钠溶液,请计算氢氧化钠溶液的浓度。(化学方程式为:2Na2O2+2H2O=4NaOH+O2↑)
【中考直通车】
1.配制100g质量分数为10%的氢氧化钠溶液,称量氢氧化钠固体时除使用托盘天平(带砝码)和药匙外,还需要用到下列仪器中的 ( )
A.玻璃棒 B.烧杯 C.100 mL量筒 D.胶头滴管
2.实验室需要配制15%的氯化钠溶液50g。
(1)计算:需要氯化钠的质量为 。
(2)某同学按下图所示步骤依次操作:
其中操作错误的步骤是 (填字母序号);B中仪器的名称为 ;E中玻璃棒的作用是 。
(3)若上图A中砝码的质量为5g,游码为2.5g,则小明称得的氯化钠质量实际为 。
同课章节目录
