中考复习专题课题4:科学探究
图片预览











文档简介
课件97张PPT。课题4 科学探究考点1:猜想与假设 常表现为对探究问题的肯定与否定,或者对样品成分的分析。考点2:方案设计与报告书写 方案设计要充分利用提供的资料和已有的知识进行综合考虑,同时还要注意方案的准确性、操作的简易性、现象的明显性。报告的书写重点考查三部分内容:1.方法与步骤
2.现象 3.结论考点3:反思与应用或评价类型一 探究物质的性质
类型二 探究物质的组成
类型三 探究物质的制取
类型四 实验创新
类型五 科学方法的考查
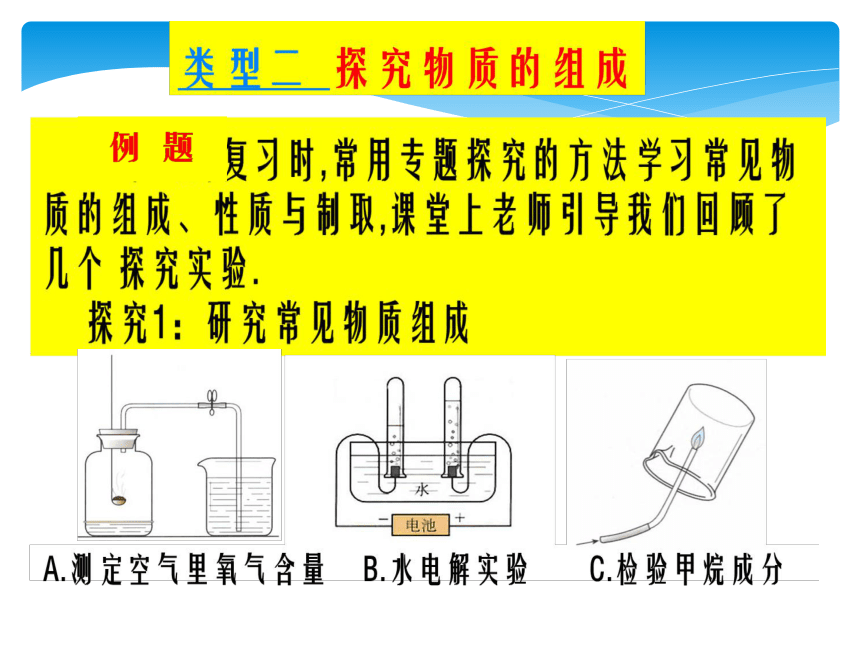
类型六 生活生产实际问题的考查 稀盐酸或稀硫酸(白色)沉淀(2) 验证:加入Zn粒(或加入CuO或加入Cu(OH)2或加入Na2CO3等)有气泡产生(或出现蓝色溶液或固体溶解,溶液变蓝或有气泡产生等)A.测定空气里氧气含量 B.水电解实验 C.检验甲烷成分氧气B元素种类或组成或成分或氢气、氧气或H2、O2取样品于试管中,滴加水,试管壁发烫,再滴加稀盐酸,有气泡产生,且溶液呈浑浊状。类型三 探究物质的制取碳酸钠溶液也能使无色酚酞试液变红(或碳酸钠溶液也显碱性)取少量样品于试管中,加入足量的BaCl2(或CaCl2)溶液过滤,在滤液中滴加几滴无色酚酞溶液生成白色沉淀,酚酞溶液变红我认为:小欢和小妮的实验是为了证实小京结论的可靠性,小京的结论不可靠,原因是
______________________________________。
显然小妮的实验可靠性比小欢的实验好,原因是 __________________________ 。 没有证明有氢氧化钠生成(或生成的不一定是氢氧化钠) 排除了干扰因素(或实验现象唯一或实验现象不同)类型四 实验创新改进 [2012·北京改编] 化学兴趣小组用图所示装置研究两个问题(夹持装置已略去)。燃烧需要与氧气接触 排出B中的空气类型五 科学方法的考查 不同地点溶质质量分数相同溶质质量分数不同 相同时间内收集的二氧化碳体积(或收集相同体积二氧化碳所需的时间)温度、溶液的溶质质量分数、溶液质量、压强[2012·邯郸一模] 有一种神奇的蜡烛,外表看上去和普通的蜡烛一样,但点燃后任你怎么吹也“吹不灭”,小明对这种蜡烛产生了兴趣,于是进行了下列探究。
[查阅资料]
普通蜡烛由石蜡和烛芯制成,吹不灭的蜡烛在烛芯外包裹了一层打火石粉末。打火石是在某种金属中掺入少量稀土元素制成的合金,它的着火点只有150 ℃。当吹“灭”蜡烛时,未冷却的金属接触到氧气就发生燃烧,从而使蜡烛复燃。隔绝氧气或剪除灯芯或用湿抹布盖灭、浇水等 铜 金属逐渐溶解,有无色气体产生,溶液为无色有红色物质析出 Mg+CuSO4===MgSO4+Cu或 2Al+3CuSO4===Al2(SO4)3+3Cu镁、铝都能与硫酸铜溶液反应,都有红色固体析出取少量打火石打磨后加入氯化铝溶液,如有固体析出,则是镁,反之则是铝CuSO4出现白色沉淀部分沉淀消失冒气泡[练习2]通过课堂上的学习,小静了解到:MnO2、土豆块都可以做H2O2分解的催化剂,于是萌生了寻找适合催化剂的想法.通过查阅资料,小静还了解到部分盐(溶液)也能对过氧化氢的分解具有催化作用,如CuCl2、CuSO4等盐(溶液).于是小静做了以下的探究。
①请你帮助她完成实验报告:②已知CuCl2在水中可解离出Cu2+和Cl-,同学们提出以下猜想:
小凯说:真正催化分解H2O2的是CuCl2溶液中的H2O
小毅说:真正催化分解H2O2的是CuCl2溶液中的Cu2+
小留说:真正催化分解H2O2的是CuCl2溶液中的Cl-;
你认为最不可能的是 同学的猜想,理由是 _________________________________.他们通过实验证明了是溶液中的Cu2+对H2O2分解起了催化作用。小凯过氧化氢溶液中本身就有水产生此气体的化学方程式可能是______________。BE③左图是收集该气体的装置,气体由???????? 端(填“a”或“b”)导入。
(2)我猜想此无色气体还可能是另外一种气体,可以产生它的化学方程式是???????? 。aCaCO3 + 2HCl = CaCl2 + H2O + CO2长进短出集重气;短进长出集轻气CO2能溶于水且与水反应,导致瓶内压强降低 将氢氧化钠溶液换成等体积的水,做同样的实验,看现象是否有差别(3)由此探究,我得到的启示是????????.有气泡产生CO2和NaOH确实发生了化学反应有沉淀产生向变瘪的瓶内加入氯化钙溶液(2)小余同学认为可利用与上述实验不同的原理,设计如下实验方案,我来帮他完成;写出方案2中所涉及的化学方程式????????????????? CO2+2NaOH=Na2CO3+H2O氢氧化钠(或NaOH)(3)小新取少量溶液于试管中,滴加过量稀盐酸,发现无气泡产生,说明情况_____(填序号)是不可能的。②CO2[练习7]常温常压下1体积水约溶解1体积二氧化碳气体,氢氧化钠溶液与二氧化碳反应时没有明显的现象变化。某研究小组设计了下列实验装置 (所有装置的气密性良好) ,试图通过观察现象来间接证明二氧化碳与氢氧化钠发生了反应。⑴请根据下图实验装置和下表的操作方法,将可能观察到的实验现象填入下表中:烧瓶内形成喷泉无明显的现象变化产生白色沉淀 ①阅读使用说明:使用时与面粉混合均匀,加水拌和,成型后直接焙制;
②观察到样品为白色粉末状物质;
③取少量样品加入水,发现其完全溶解;
④用pH试纸测溶液的酸碱度 pH=11;
⑤取少量样品,向其中加入稀盐酸,产生大量气泡;
⑥取适量样品放人试管加热,产生可以使澄清石灰水变浑浊的气体。(1)请你通过以上实验判断,碳酸氢钠的水溶液显____性,使面包、饼干形成小孔的气体应该是______ ,你猜测产生这种气体的原因有________________。碱CO2碳酸氢钠受热分解产生CO2气体白色粉末状的固体,能(易)溶于水CO2H2O② 加热碳酸氢钠至完全分解后,试管中仍有白色固体,白色固体是什么物质呢?我认为是一种盐;请你帮助我猜测这种盐是 。Na2CO3CO2H2[或O2……] 金属与盐溶液发生置换反应;
金属氧化物与酸溶液反应;
碱与酸溶液发生复分解反应;
氧化物(如CaO)与水发生化合反应
可溶于水的固体物质浓硫酸AD在这个实验中,图中a处的化学方程式为_____;
b处的试剂为 __________ ; c处的试剂为_______;无水硫酸铜(或无水CuSO4澄清石灰水在C的导管尾端点燃pH=7 pH>7 ②③ 组内同学进行如下实验:
甲同学:取pH试纸放在玻璃片上,用玻璃棒蘸取氯化钠溶液沾在pH试纸上,把pH试纸显示的颜色与标准比色卡比较,测得 pH=7.
乙同学:取pH试纸放在玻璃片上,先用蒸馏水将pH试纸湿润,然后用玻璃棒蘸取氯化钠溶液沾在pH试纸上,把pH试纸显示的颜色与标准比色卡比较,测得 pH=7.
丙同学:将pH试纸直接浸入氯化钠溶液中,然后取出,把pH试纸显示的颜色与标准比色卡比较,测得 pH=7.甲 不正确 Na2CO3是盐,但其溶液的PH大于7[练习15]某同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加了一定量的稀盐酸.
(1)充分反应后,你认为溶液中的溶质组成最多有 种情况,这几种情况中一定含有 .3NaClHCl + NaOH = NaCl + H2O恰好反应则溶质为NaClNaOH过量则溶质为NaCl和NaOHHCl过量则溶质为NaCl和HCl盐酸过量,酚酞也不变色不正确 (3)请你设计一个实验,探究上述烧杯中的溶液是否恰好完全中和.填写下表:[练习16 ] 酒精灯是中学实验中常用的加热仪器。某研究性学习小组对酒精灯燃烧产生的气体成分进行了探究。
提出问题:酒精燃烧产生的气体中会含有哪些物质?
猜想与验证:酒精燃烧产生的气体中含有二氧化碳,验证二氧化碳的方法是
,出现的现象是 ,验证二氧化碳的化学方程式是 。[练习17]学校实验室的废液缸中收集了同学们在实验室制取CO2后残留的废液.小红同学想探究废液中溶质的成分,请你一同参与探究并回答下列问题.
[提出问题] 废液中的溶质是什么物质?
[作出猜想] 小红认为废液中溶质只有CaCl2。
你认为还可能含有的溶质是 ① (填化学式)。
[查阅资料] CaCl2溶液呈中性。
[实验与结论]HCl①小红分别取少量该废液和CaCl2溶液加入到两支试管中,并向其中分别滴入无色酚酞溶液作对比实验,结果两试管中溶液均无色,于是小红认为自己的猜想是正确的.
②你认为小红的实验 ② (填“能”或“不能”)证明她的猜想,理由是 ③ 不能因为盐酸显酸性不能使酚酞试液变色③如果要证明你的猜想是正确的,你选择的试剂是 ④ ,
实验中可以看到的现象是 ⑤ .[拓展与应用]
①若实验证明你的猜想是正确的,要想使处理后的废液只有CaCl2溶液,应向废液中加入过量的 ⑥ ,反应完成后过滤。
②通过以上探究,你认为实验室的废液未经处理直接倒入下水道,可能造成的危害是⑦ (写一条)。腐蚀铁制品下水道(或造成水体污染)碳酸钙[练习18]竹子是“有节、中空、四季常绿”的植物。同学们对竹子中的气体成分展开了探究,测定其成分。
(1)他先将竹子浸在水里,钻个小孔,看到一串串气泡冒出,然后采用 ______法收集到了甲乙两瓶气体。 (3)检验气体中是否含有二氧化碳气体。(4)那么竹子里的气体含量与空气有什么区别呢?于是,他又用空气重复了上述实验.相比较后得出的结论是 .[练习19]某学校科学兴趣小组在研究“带火星木条复燃与氧气体积分数的关系”的课题中,采取了以下实验步骤:
①取5只250mL集气瓶,向5只集气瓶中分别装入25mL.50mL.75mL.100mL.125mL的水,并用毛玻璃片盖住,依次编号为1.2.3.4.5;另取一只250mL集气瓶(编号为0),里面不装水;
②用分解过氧化氢(H2O2)的方法制取氧气,用制取的氧气通过排水法将上述1~5号瓶中的水排去;③将带火星的木条依次插入0~5号瓶中,把观察到现象和计算数据,填入下表试回答下列问题:
(1)实验室中采用分解过氧化氢(H2O2)的方法制取氧气,其反应的化学方程式是 ; (2)根据以上实验事实,下列说法中正确的是______(填写相应的字母);
A.只有在纯氧中才能使带火星的木条复燃
B.集气瓶中氧气的体积分数≥52.6%时.带火星的木条就能复燃
C.只要有氧气存在就可使带火星的木条复燃。B(3)通过上述实验,你能得出的结论是:
;
(4)根据你所学过的反应,举一例说明你的结论:
。在空气中加热,铁丝红热,在氧气中燃烧火星四射。 氧气的浓度越大,燃烧越剧烈[练习20]现有一包白色固体混合物,可能由BaCl2.KNO3.CuSO4.FeCl3.Na2CO3.Na2SO4.NaCl等中的几种混合而成,为证明其组成,做如下实验:
(1)取一定量该固体混合物加入足量的水,充分搅拌,得到白色沉淀和无色溶液,过滤得到白色沉淀A,无色滤液B.
(2)向白色沉淀A中加入过量的盐酸溶液,沉淀部分溶解
(3)向无色滤液B中加入硝酸银溶液,产生不溶于稀硝酸的白色沉淀;
则:①该固体混合物中一定含有 ,可能含有 ;一定没有 .(用化学式填空)
②该混合物至少由 种物质构成,最多可能有 种物质(填数字)KNO3.NaCl35CuSO4.FeCl3BaCl2.Na2CO3.Na2SO4(1)小军取少量白色粉末溶于水,向所得溶液中滴加酚酞试液,溶液变为红色.由此小军认为白色粉末是NaOH.请判断小刚所得结论是否正确,并简述理由._______,
_________________________________不正确因为Na2CO3的水溶液也显碱性(2)小红取少量白色粉末溶于水,向所得溶液中滴加BaCl2试液,有白色沉淀产生.由此判断白色粉末中含有______.为了验证猜想③,小红继续向溶液中滴加BaCl2试液至不再产生沉淀,然后过滤.你认为她接下来还应进行的实验是___________________________________
在小红所做的实验中,若把BaCl2溶液换成Ba(OH)2溶液是否可行?请简述理由._ _,_______________________________________________________。Na2CO3取上层清夜,向里面滴加无色酚酞溶液,观察现象不行因为如换成Ba(OH)2溶液,就鉴别不出是否含有NaOH了23.某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验。
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明NaOH溶液与稀盐酸发生了化学反应.(1)用pH试纸测定溶液的pH时,正确的操作是:
。
(2)简述强调“测得的pH小于7”的理由: 。排除因稀释而使溶液pH减小的因素将PH试纸放在表面皿上,用玻璃棒蘸取少量待测液滴在试纸上,将试纸颜色与比色卡对照读出pH方案二:先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,可观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应.
该组同学在向NaOH溶液中滴加酚酞溶液时,发现了一个意外现象:氢氧化钠溶液中滴入酚酞溶液,溶液变成了红色,过了一会儿红色就消失了. 该小组对这种意外现象的原因作了如下猜想:
①可能是酚酞溶液与空气中的氧气反应,使红色消失;
②可能是氢氧化钠溶液与空气中的二氧化碳反应,使红色消失。(1)为验证猜想①,该组同学做了如下实验:将配制的氢氧化钠溶液加热,并在液面上方滴一些植物油,然后在冷却后的溶液中滴入酚酞溶液.实验中“加热”和“滴入植物油”目的是 。
实验结果表明酚酞溶液红色消失与空气中的氧气无关。除氧和隔氧(2)为验证猜想②,该组同学做了如下实验:取了一定量的Na2CO3溶液,在其中滴入酚酞溶液,发现溶液也呈现红色,由此可得出以下两点结论:
结论1:说明Na2CO3溶液呈 性;
结论2:说明酚酞溶液红色消失与空气中的二氧化碳无关。 碱 (3)该小组同学通过查阅资料得知:当氢氧化钠溶液浓度很大时,就会出现上述意外现象.请设计实验证明该方案中取用的NaOH溶液浓度过大:①实验方法
②观察到的现象 。溶液呈红色取上述溶液加水稀释后,再滴加无色酚酞24已知一种固体化合物由C、H、O、Cu四种元素组成。向盛有该化合物的试管中加入过量稀盐酸,产生大量气泡,固体逐渐溶解,得到蓝绿色溶液。己知这种蓝绿色是氯化铜溶液。
(1)探究产生的气体是什么。【猜想】①可能是氢气;②可能是甲烷;③还可能是 ……
【实验】请设计一个简单的验证你提出的猜想,写出操作方法和可能出现的实验现象。 二氧化碳将气体通入澄清的石灰水,石灰水变浑浊,证明是二氧化碳(2)从蓝绿色溶液中提取金属铜。现利用该溶液制取金属铜,过程如下:蓝绿色溶液固体M铜加入过量铁粉
操作a加入过量的B
操作a①操作a的名称是 ,完成该操作需要的玻璃仪器有烧杯、漏斗和 ;
②蓝绿色溶液中加入过量的铁粉后的生成物有___________
③确定固体M中加入B是否已经过量的方法有______________________________过滤玻璃棒FeCl2.Cu.H2再加入少量B,无气泡产生,则说明已经过量25.某化学兴趣小组制取并检验二氧化碳.实验过程中.可观察到试管里产生白色色沉淀.产生沉淀后继续通入二氧化碳.过一段时间后.发现沉淀溶解变成澄清溶液.为了确定沉淀溶解成澄清溶液的原因,小组的同学进行了相关探究.
提出问题 沉淀为什么能溶解变成澄清溶液?
查阅资料 碳酸盐溶于酸,碳酸氢钙[Ca(HCO3)2]溶于水。
猜想与假设 ①溶液呈酸性;②反应生成了碳酸氢钙。实验与结论 不成立见书略稀盐酸2HCl+Ca(HCO3)2 =
CaCl2+2H2O+2CO2↑ 通过探究得知,生成的沉淀会与二氧化碳、水反应生成了可溶于水的碳酸氢钙。
交流与反思 从探究中你得到的启示或感受是 不溶物在一定条件下可转化为可溶物
2.现象 3.结论考点3:反思与应用或评价类型一 探究物质的性质
类型二 探究物质的组成
类型三 探究物质的制取
类型四 实验创新
类型五 科学方法的考查
类型六 生活生产实际问题的考查 稀盐酸或稀硫酸(白色)沉淀(2) 验证:加入Zn粒(或加入CuO或加入Cu(OH)2或加入Na2CO3等)有气泡产生(或出现蓝色溶液或固体溶解,溶液变蓝或有气泡产生等)A.测定空气里氧气含量 B.水电解实验 C.检验甲烷成分氧气B元素种类或组成或成分或氢气、氧气或H2、O2取样品于试管中,滴加水,试管壁发烫,再滴加稀盐酸,有气泡产生,且溶液呈浑浊状。类型三 探究物质的制取碳酸钠溶液也能使无色酚酞试液变红(或碳酸钠溶液也显碱性)取少量样品于试管中,加入足量的BaCl2(或CaCl2)溶液过滤,在滤液中滴加几滴无色酚酞溶液生成白色沉淀,酚酞溶液变红我认为:小欢和小妮的实验是为了证实小京结论的可靠性,小京的结论不可靠,原因是
______________________________________。
显然小妮的实验可靠性比小欢的实验好,原因是 __________________________ 。 没有证明有氢氧化钠生成(或生成的不一定是氢氧化钠) 排除了干扰因素(或实验现象唯一或实验现象不同)类型四 实验创新改进 [2012·北京改编] 化学兴趣小组用图所示装置研究两个问题(夹持装置已略去)。燃烧需要与氧气接触 排出B中的空气类型五 科学方法的考查 不同地点溶质质量分数相同溶质质量分数不同 相同时间内收集的二氧化碳体积(或收集相同体积二氧化碳所需的时间)温度、溶液的溶质质量分数、溶液质量、压强[2012·邯郸一模] 有一种神奇的蜡烛,外表看上去和普通的蜡烛一样,但点燃后任你怎么吹也“吹不灭”,小明对这种蜡烛产生了兴趣,于是进行了下列探究。
[查阅资料]
普通蜡烛由石蜡和烛芯制成,吹不灭的蜡烛在烛芯外包裹了一层打火石粉末。打火石是在某种金属中掺入少量稀土元素制成的合金,它的着火点只有150 ℃。当吹“灭”蜡烛时,未冷却的金属接触到氧气就发生燃烧,从而使蜡烛复燃。隔绝氧气或剪除灯芯或用湿抹布盖灭、浇水等 铜 金属逐渐溶解,有无色气体产生,溶液为无色有红色物质析出 Mg+CuSO4===MgSO4+Cu或 2Al+3CuSO4===Al2(SO4)3+3Cu镁、铝都能与硫酸铜溶液反应,都有红色固体析出取少量打火石打磨后加入氯化铝溶液,如有固体析出,则是镁,反之则是铝CuSO4出现白色沉淀部分沉淀消失冒气泡[练习2]通过课堂上的学习,小静了解到:MnO2、土豆块都可以做H2O2分解的催化剂,于是萌生了寻找适合催化剂的想法.通过查阅资料,小静还了解到部分盐(溶液)也能对过氧化氢的分解具有催化作用,如CuCl2、CuSO4等盐(溶液).于是小静做了以下的探究。
①请你帮助她完成实验报告:②已知CuCl2在水中可解离出Cu2+和Cl-,同学们提出以下猜想:
小凯说:真正催化分解H2O2的是CuCl2溶液中的H2O
小毅说:真正催化分解H2O2的是CuCl2溶液中的Cu2+
小留说:真正催化分解H2O2的是CuCl2溶液中的Cl-;
你认为最不可能的是 同学的猜想,理由是 _________________________________.他们通过实验证明了是溶液中的Cu2+对H2O2分解起了催化作用。小凯过氧化氢溶液中本身就有水产生此气体的化学方程式可能是______________。BE③左图是收集该气体的装置,气体由???????? 端(填“a”或“b”)导入。
(2)我猜想此无色气体还可能是另外一种气体,可以产生它的化学方程式是???????? 。aCaCO3 + 2HCl = CaCl2 + H2O + CO2长进短出集重气;短进长出集轻气CO2能溶于水且与水反应,导致瓶内压强降低 将氢氧化钠溶液换成等体积的水,做同样的实验,看现象是否有差别(3)由此探究,我得到的启示是????????.有气泡产生CO2和NaOH确实发生了化学反应有沉淀产生向变瘪的瓶内加入氯化钙溶液(2)小余同学认为可利用与上述实验不同的原理,设计如下实验方案,我来帮他完成;写出方案2中所涉及的化学方程式????????????????? CO2+2NaOH=Na2CO3+H2O氢氧化钠(或NaOH)(3)小新取少量溶液于试管中,滴加过量稀盐酸,发现无气泡产生,说明情况_____(填序号)是不可能的。②CO2[练习7]常温常压下1体积水约溶解1体积二氧化碳气体,氢氧化钠溶液与二氧化碳反应时没有明显的现象变化。某研究小组设计了下列实验装置 (所有装置的气密性良好) ,试图通过观察现象来间接证明二氧化碳与氢氧化钠发生了反应。⑴请根据下图实验装置和下表的操作方法,将可能观察到的实验现象填入下表中:烧瓶内形成喷泉无明显的现象变化产生白色沉淀 ①阅读使用说明:使用时与面粉混合均匀,加水拌和,成型后直接焙制;
②观察到样品为白色粉末状物质;
③取少量样品加入水,发现其完全溶解;
④用pH试纸测溶液的酸碱度 pH=11;
⑤取少量样品,向其中加入稀盐酸,产生大量气泡;
⑥取适量样品放人试管加热,产生可以使澄清石灰水变浑浊的气体。(1)请你通过以上实验判断,碳酸氢钠的水溶液显____性,使面包、饼干形成小孔的气体应该是______ ,你猜测产生这种气体的原因有________________。碱CO2碳酸氢钠受热分解产生CO2气体白色粉末状的固体,能(易)溶于水CO2H2O② 加热碳酸氢钠至完全分解后,试管中仍有白色固体,白色固体是什么物质呢?我认为是一种盐;请你帮助我猜测这种盐是 。Na2CO3CO2H2[或O2……] 金属与盐溶液发生置换反应;
金属氧化物与酸溶液反应;
碱与酸溶液发生复分解反应;
氧化物(如CaO)与水发生化合反应
可溶于水的固体物质浓硫酸AD在这个实验中,图中a处的化学方程式为_____;
b处的试剂为 __________ ; c处的试剂为_______;无水硫酸铜(或无水CuSO4澄清石灰水在C的导管尾端点燃pH=7 pH>7 ②③ 组内同学进行如下实验:
甲同学:取pH试纸放在玻璃片上,用玻璃棒蘸取氯化钠溶液沾在pH试纸上,把pH试纸显示的颜色与标准比色卡比较,测得 pH=7.
乙同学:取pH试纸放在玻璃片上,先用蒸馏水将pH试纸湿润,然后用玻璃棒蘸取氯化钠溶液沾在pH试纸上,把pH试纸显示的颜色与标准比色卡比较,测得 pH=7.
丙同学:将pH试纸直接浸入氯化钠溶液中,然后取出,把pH试纸显示的颜色与标准比色卡比较,测得 pH=7.甲 不正确 Na2CO3是盐,但其溶液的PH大于7[练习15]某同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加了一定量的稀盐酸.
(1)充分反应后,你认为溶液中的溶质组成最多有 种情况,这几种情况中一定含有 .3NaClHCl + NaOH = NaCl + H2O恰好反应则溶质为NaClNaOH过量则溶质为NaCl和NaOHHCl过量则溶质为NaCl和HCl盐酸过量,酚酞也不变色不正确 (3)请你设计一个实验,探究上述烧杯中的溶液是否恰好完全中和.填写下表:[练习16 ] 酒精灯是中学实验中常用的加热仪器。某研究性学习小组对酒精灯燃烧产生的气体成分进行了探究。
提出问题:酒精燃烧产生的气体中会含有哪些物质?
猜想与验证:酒精燃烧产生的气体中含有二氧化碳,验证二氧化碳的方法是
,出现的现象是 ,验证二氧化碳的化学方程式是 。[练习17]学校实验室的废液缸中收集了同学们在实验室制取CO2后残留的废液.小红同学想探究废液中溶质的成分,请你一同参与探究并回答下列问题.
[提出问题] 废液中的溶质是什么物质?
[作出猜想] 小红认为废液中溶质只有CaCl2。
你认为还可能含有的溶质是 ① (填化学式)。
[查阅资料] CaCl2溶液呈中性。
[实验与结论]HCl①小红分别取少量该废液和CaCl2溶液加入到两支试管中,并向其中分别滴入无色酚酞溶液作对比实验,结果两试管中溶液均无色,于是小红认为自己的猜想是正确的.
②你认为小红的实验 ② (填“能”或“不能”)证明她的猜想,理由是 ③ 不能因为盐酸显酸性不能使酚酞试液变色③如果要证明你的猜想是正确的,你选择的试剂是 ④ ,
实验中可以看到的现象是 ⑤ .[拓展与应用]
①若实验证明你的猜想是正确的,要想使处理后的废液只有CaCl2溶液,应向废液中加入过量的 ⑥ ,反应完成后过滤。
②通过以上探究,你认为实验室的废液未经处理直接倒入下水道,可能造成的危害是⑦ (写一条)。腐蚀铁制品下水道(或造成水体污染)碳酸钙[练习18]竹子是“有节、中空、四季常绿”的植物。同学们对竹子中的气体成分展开了探究,测定其成分。
(1)他先将竹子浸在水里,钻个小孔,看到一串串气泡冒出,然后采用 ______法收集到了甲乙两瓶气体。 (3)检验气体中是否含有二氧化碳气体。(4)那么竹子里的气体含量与空气有什么区别呢?于是,他又用空气重复了上述实验.相比较后得出的结论是 .[练习19]某学校科学兴趣小组在研究“带火星木条复燃与氧气体积分数的关系”的课题中,采取了以下实验步骤:
①取5只250mL集气瓶,向5只集气瓶中分别装入25mL.50mL.75mL.100mL.125mL的水,并用毛玻璃片盖住,依次编号为1.2.3.4.5;另取一只250mL集气瓶(编号为0),里面不装水;
②用分解过氧化氢(H2O2)的方法制取氧气,用制取的氧气通过排水法将上述1~5号瓶中的水排去;③将带火星的木条依次插入0~5号瓶中,把观察到现象和计算数据,填入下表试回答下列问题:
(1)实验室中采用分解过氧化氢(H2O2)的方法制取氧气,其反应的化学方程式是 ; (2)根据以上实验事实,下列说法中正确的是______(填写相应的字母);
A.只有在纯氧中才能使带火星的木条复燃
B.集气瓶中氧气的体积分数≥52.6%时.带火星的木条就能复燃
C.只要有氧气存在就可使带火星的木条复燃。B(3)通过上述实验,你能得出的结论是:
;
(4)根据你所学过的反应,举一例说明你的结论:
。在空气中加热,铁丝红热,在氧气中燃烧火星四射。 氧气的浓度越大,燃烧越剧烈[练习20]现有一包白色固体混合物,可能由BaCl2.KNO3.CuSO4.FeCl3.Na2CO3.Na2SO4.NaCl等中的几种混合而成,为证明其组成,做如下实验:
(1)取一定量该固体混合物加入足量的水,充分搅拌,得到白色沉淀和无色溶液,过滤得到白色沉淀A,无色滤液B.
(2)向白色沉淀A中加入过量的盐酸溶液,沉淀部分溶解
(3)向无色滤液B中加入硝酸银溶液,产生不溶于稀硝酸的白色沉淀;
则:①该固体混合物中一定含有 ,可能含有 ;一定没有 .(用化学式填空)
②该混合物至少由 种物质构成,最多可能有 种物质(填数字)KNO3.NaCl35CuSO4.FeCl3BaCl2.Na2CO3.Na2SO4(1)小军取少量白色粉末溶于水,向所得溶液中滴加酚酞试液,溶液变为红色.由此小军认为白色粉末是NaOH.请判断小刚所得结论是否正确,并简述理由._______,
_________________________________不正确因为Na2CO3的水溶液也显碱性(2)小红取少量白色粉末溶于水,向所得溶液中滴加BaCl2试液,有白色沉淀产生.由此判断白色粉末中含有______.为了验证猜想③,小红继续向溶液中滴加BaCl2试液至不再产生沉淀,然后过滤.你认为她接下来还应进行的实验是___________________________________
在小红所做的实验中,若把BaCl2溶液换成Ba(OH)2溶液是否可行?请简述理由._ _,_______________________________________________________。Na2CO3取上层清夜,向里面滴加无色酚酞溶液,观察现象不行因为如换成Ba(OH)2溶液,就鉴别不出是否含有NaOH了23.某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验。
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明NaOH溶液与稀盐酸发生了化学反应.(1)用pH试纸测定溶液的pH时,正确的操作是:
。
(2)简述强调“测得的pH小于7”的理由: 。排除因稀释而使溶液pH减小的因素将PH试纸放在表面皿上,用玻璃棒蘸取少量待测液滴在试纸上,将试纸颜色与比色卡对照读出pH方案二:先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,可观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应.
该组同学在向NaOH溶液中滴加酚酞溶液时,发现了一个意外现象:氢氧化钠溶液中滴入酚酞溶液,溶液变成了红色,过了一会儿红色就消失了. 该小组对这种意外现象的原因作了如下猜想:
①可能是酚酞溶液与空气中的氧气反应,使红色消失;
②可能是氢氧化钠溶液与空气中的二氧化碳反应,使红色消失。(1)为验证猜想①,该组同学做了如下实验:将配制的氢氧化钠溶液加热,并在液面上方滴一些植物油,然后在冷却后的溶液中滴入酚酞溶液.实验中“加热”和“滴入植物油”目的是 。
实验结果表明酚酞溶液红色消失与空气中的氧气无关。除氧和隔氧(2)为验证猜想②,该组同学做了如下实验:取了一定量的Na2CO3溶液,在其中滴入酚酞溶液,发现溶液也呈现红色,由此可得出以下两点结论:
结论1:说明Na2CO3溶液呈 性;
结论2:说明酚酞溶液红色消失与空气中的二氧化碳无关。 碱 (3)该小组同学通过查阅资料得知:当氢氧化钠溶液浓度很大时,就会出现上述意外现象.请设计实验证明该方案中取用的NaOH溶液浓度过大:①实验方法
②观察到的现象 。溶液呈红色取上述溶液加水稀释后,再滴加无色酚酞24已知一种固体化合物由C、H、O、Cu四种元素组成。向盛有该化合物的试管中加入过量稀盐酸,产生大量气泡,固体逐渐溶解,得到蓝绿色溶液。己知这种蓝绿色是氯化铜溶液。
(1)探究产生的气体是什么。【猜想】①可能是氢气;②可能是甲烷;③还可能是 ……
【实验】请设计一个简单的验证你提出的猜想,写出操作方法和可能出现的实验现象。 二氧化碳将气体通入澄清的石灰水,石灰水变浑浊,证明是二氧化碳(2)从蓝绿色溶液中提取金属铜。现利用该溶液制取金属铜,过程如下:蓝绿色溶液固体M铜加入过量铁粉
操作a加入过量的B
操作a①操作a的名称是 ,完成该操作需要的玻璃仪器有烧杯、漏斗和 ;
②蓝绿色溶液中加入过量的铁粉后的生成物有___________
③确定固体M中加入B是否已经过量的方法有______________________________过滤玻璃棒FeCl2.Cu.H2再加入少量B,无气泡产生,则说明已经过量25.某化学兴趣小组制取并检验二氧化碳.实验过程中.可观察到试管里产生白色色沉淀.产生沉淀后继续通入二氧化碳.过一段时间后.发现沉淀溶解变成澄清溶液.为了确定沉淀溶解成澄清溶液的原因,小组的同学进行了相关探究.
提出问题 沉淀为什么能溶解变成澄清溶液?
查阅资料 碳酸盐溶于酸,碳酸氢钙[Ca(HCO3)2]溶于水。
猜想与假设 ①溶液呈酸性;②反应生成了碳酸氢钙。实验与结论 不成立见书略稀盐酸2HCl+Ca(HCO3)2 =
CaCl2+2H2O+2CO2↑ 通过探究得知,生成的沉淀会与二氧化碳、水反应生成了可溶于水的碳酸氢钙。
交流与反思 从探究中你得到的启示或感受是 不溶物在一定条件下可转化为可溶物
