4.1原电池(人教版高中化学选修四)
图片预览

文档简介
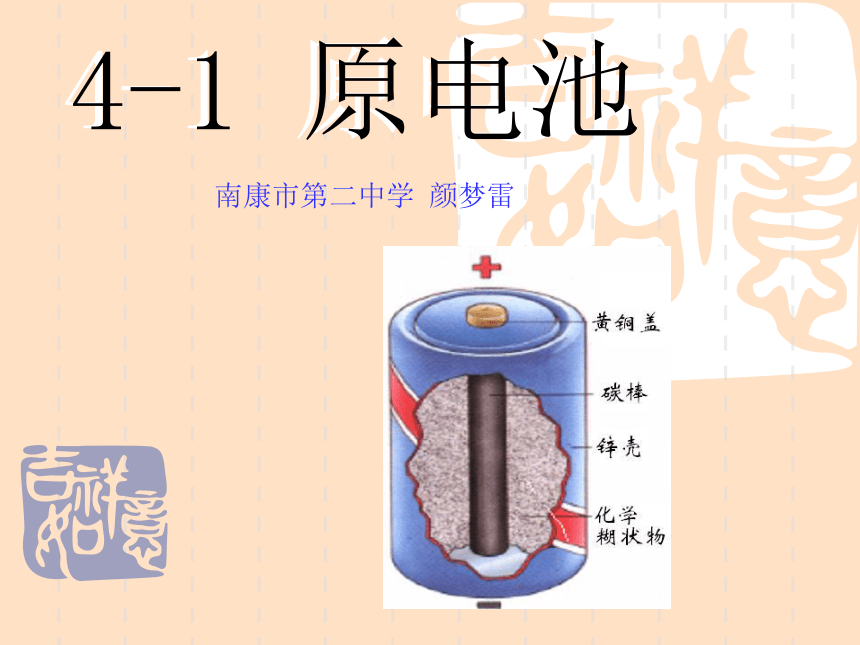
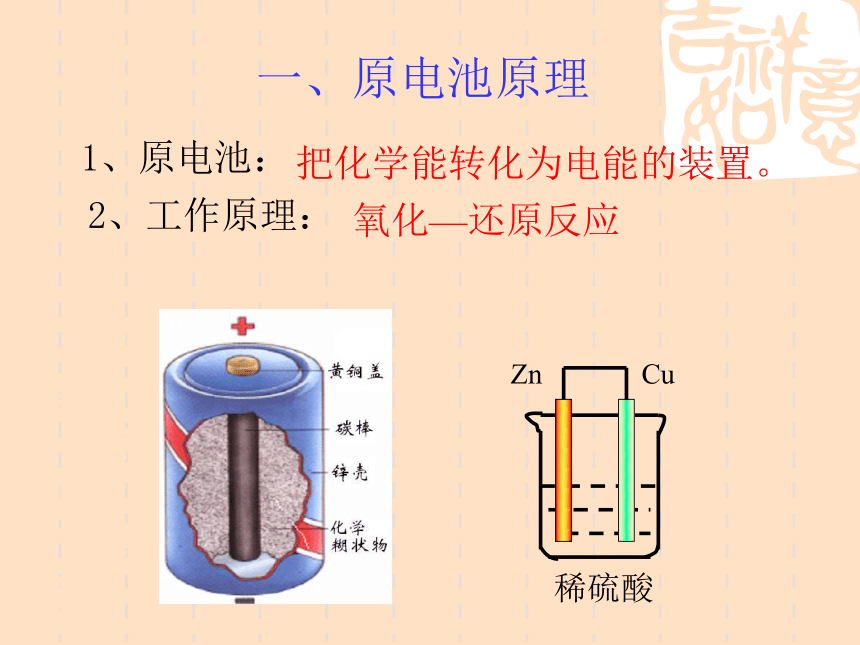
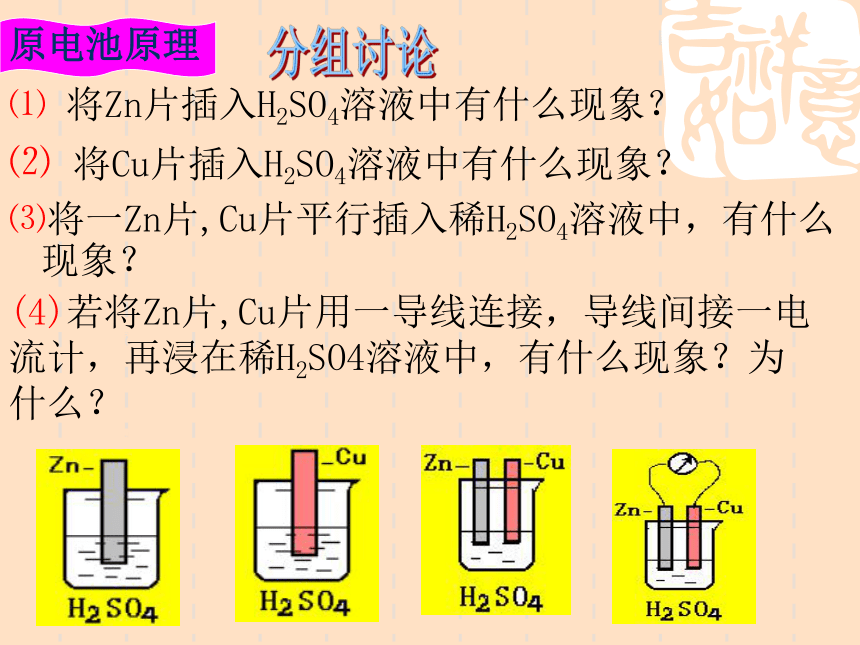
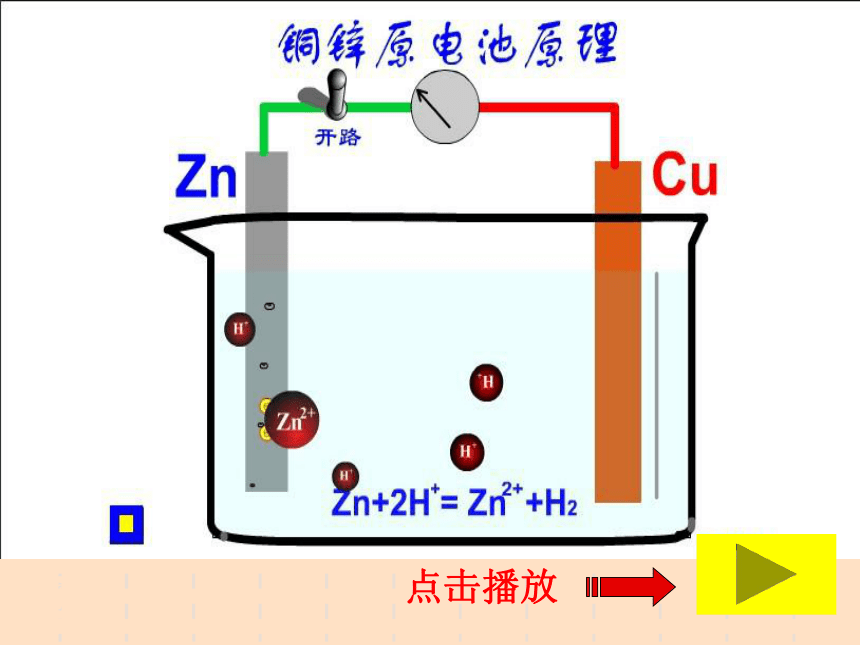
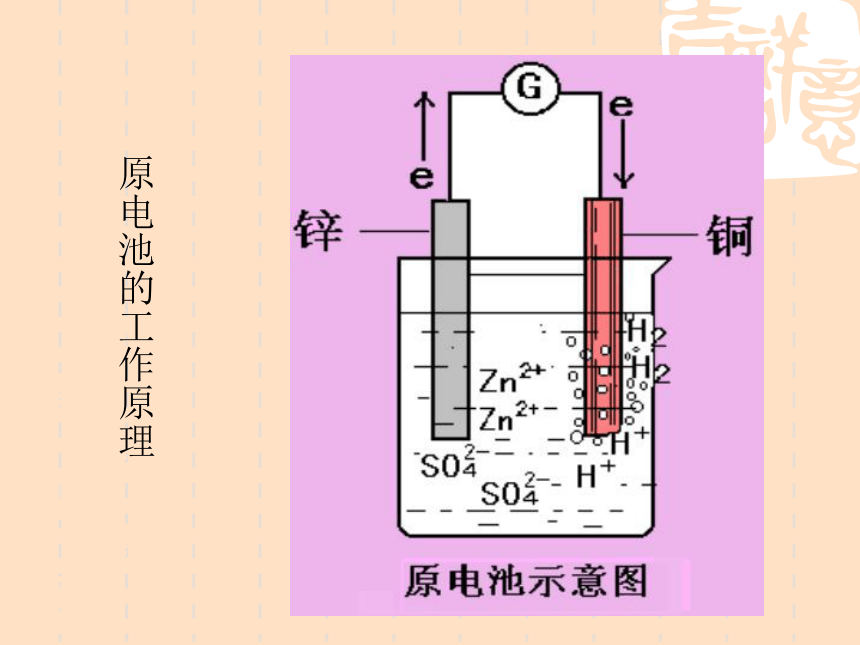
课件16张PPT。4-1 原电池 4-1 原电池南康市第二中学 颜梦雷1、原电池:2、工作原理:氧化—还原反应把化学能转化为电能的装置。一、原电池原理⑴ 将Zn片插入H2SO4溶液中有什么现象?⑵ 将Cu片插入H2SO4溶液中有什么现象?⑶将一Zn片,Cu片平行插入稀H2SO4溶液中,有什么现象?(4)若将Zn片,Cu片用一导线连接,导线间接一电流计,再浸在稀H2SO4溶液中,有什么现象?为什么?分组讨论点击播放原电池的工作原理[探讨]用一干电池连接电流计验证电子流向,确定Zn片, Cu片的正负极是怎样的?
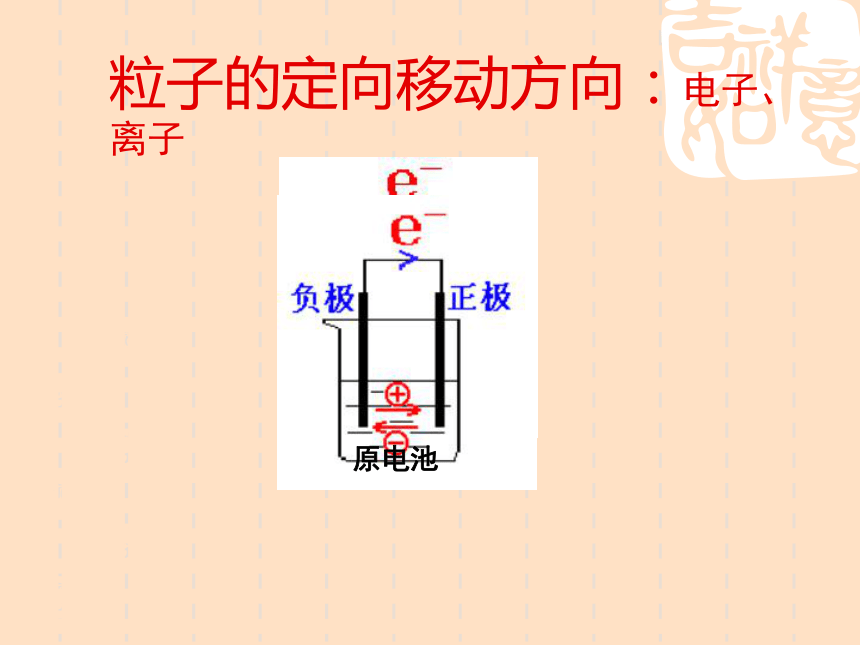
粒子的定向移动方向:电子、离子原电池二、电极名称判断电子流入的电极,通常是
不活泼金属或石墨电极电极电子流出的电极,通常是
活泼金属正极:负极:负极正极电子流入的电极,得到电子,发生还原反应电极电子流出的电极,失去电子,发生氧化反应正极:负极:三、电极反应式电极反应正极:还原反应 2H++2e-=H2↑负极:氧化反应 Zn-2e-=Zn2+四、构成原电池的条件⑴活泼性不同的两种金属(或金属与非金属)作电池的正、负极⑵形成闭和回路
⑶电解质溶液(4)自发的氧化还原反应 下列哪组装置能构成原电池(A)(B)(C)当堂检测动动脑判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式。(∨)(×)(∨)(×)(X)
(∨)写出下面原电池的正负极并写出电极反应练一练(—)(+)正极:还原反应 2H++2e-=H2↑负极:氧化反应 Zn-2e-=Zn2+(—)(+)负极: Zn-2e-=Zn2+
正极:Cu+2e-=Cu2 +
粒子的定向移动方向:电子、离子原电池二、电极名称判断电子流入的电极,通常是
不活泼金属或石墨电极电极电子流出的电极,通常是
活泼金属正极:负极:负极正极电子流入的电极,得到电子,发生还原反应电极电子流出的电极,失去电子,发生氧化反应正极:负极:三、电极反应式电极反应正极:还原反应 2H++2e-=H2↑负极:氧化反应 Zn-2e-=Zn2+四、构成原电池的条件⑴活泼性不同的两种金属(或金属与非金属)作电池的正、负极⑵形成闭和回路
⑶电解质溶液(4)自发的氧化还原反应 下列哪组装置能构成原电池(A)(B)(C)当堂检测动动脑判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式。(∨)(×)(∨)(×)(X)
(∨)写出下面原电池的正负极并写出电极反应练一练(—)(+)正极:还原反应 2H++2e-=H2↑负极:氧化反应 Zn-2e-=Zn2+(—)(+)负极: Zn-2e-=Zn2+
正极:Cu+2e-=Cu2 +
