粤教版化学九年级上册同步课件:3.2 制取氧气 第一课时过氧化氢制氧气(共21张PPT)
文档属性
| 名称 | 粤教版化学九年级上册同步课件:3.2 制取氧气 第一课时过氧化氢制氧气(共21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-24 11:47:52 | ||
图片预览







文档简介
(共21张PPT)
第三章 维持生命之气
—氧气
3.2 制取氧气
第 1 课 时
过氧化氢制氧气
1.认识过氧化氢溶液,以及制取氧气的优缺点;
2.了解催化剂和催化作用。
学习目标
氧气
新知导入
实验室制取氧气选择的药品有
药品 过氧化氢 氯酸钾 二氧化锰 高锰酸钾
颜色
状态
无色
暗紫色
白色
黑色
液体
固体
固体
粉末
新知探究
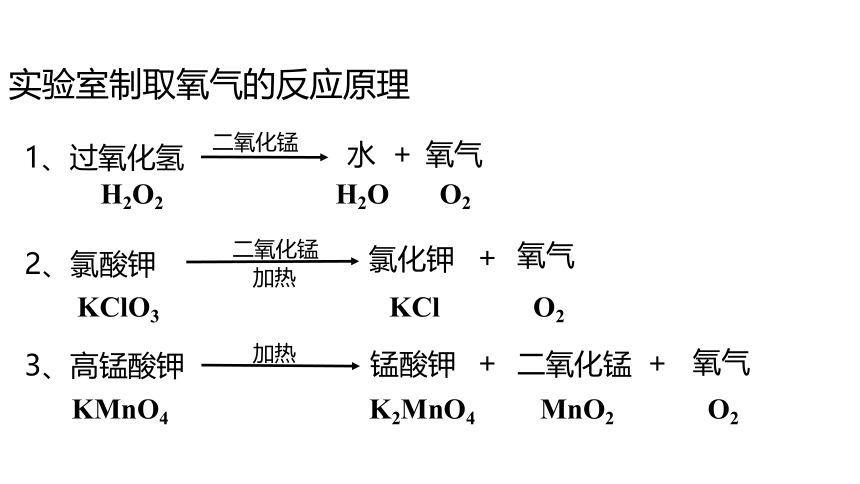
实验室制取氧气的反应原理
H2O2 H2O O2
KClO3 KCl O2
水
1、过氧化氢
氧气
+
二氧化锰
2、氯酸钾
氯化钾
+
氧气
二氧化锰
加热
3、高锰酸钾
锰酸钾
+
二氧化锰
+
氧气
加热
KMnO4 K2MnO4 MnO2 O2
新知探究
1、观察上述三个反应,除了都有氧气生成外,你还发现有什么共同的物质?
2、二氧化锰在这三个反应中分别扮演一个什么角色呢?
问题导向
新知探究
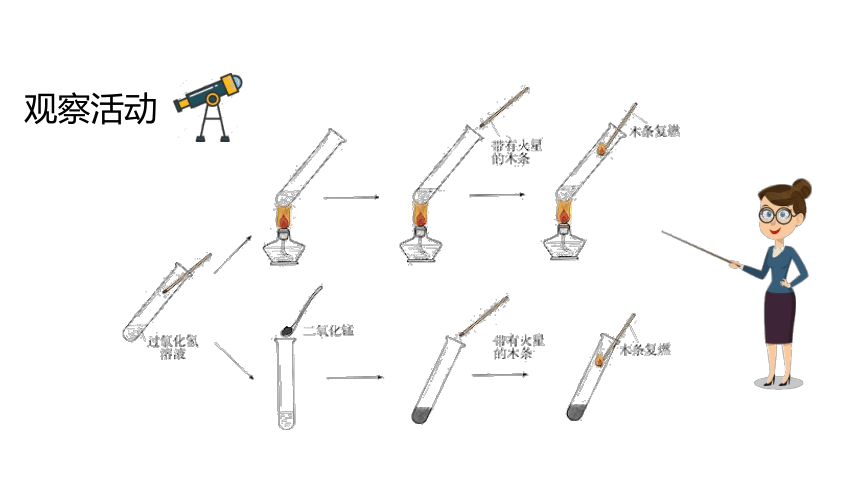
观察活动
新知探究
实验序号 图示 观察到的现象 推 断
(1)
(2)
(3)
(4)
常温下过氧化氢溶液放出氧气少
带火星的木条没有复燃
带火星的木条没有复燃
二氧化锰不能产生氧气
带火星的木条复燃
MnO2使过氧化氢在常温时迅速产生氧气
带火星的木条复燃
MnO2可以重复使用,使新加入的过氧化氢在常温时迅速产生氧气
新知探究
在化学反应中能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫催化剂(又叫触媒)。
催化剂
“一变”:改变其他物质的化学反应速率(改变≠加快)
“二不变”:本身的质量和化学性质在反应前后都没有改变
催化剂在化学反应中所起的作用叫催化作用
新知探究
①能改变其它物质的反应速率,这里的“改变”包括加快和减慢两种含义。
②催化剂的化学性质在化学反应前后没有改变,但是物理性质可能改变。
③催化剂是针对具体反应而言的,如二氧化锰在过氧化氢分解制取氧气时,能够起催化作用,是催化剂;但二氧化锰不是所有化学反应的催化剂。
④在某个化学反应中,可以选择不同的物质做为催化剂。如双氧水分解制取氧气时,既可以选择二氧化锰做催化剂,也可以选择氧化铁做催化剂。
新知探究
氧化铜、硫酸铜溶液、红砖粉等含金属元素的物质也可以做催化剂。
生物体中的酶也是一种生物催化剂。
新知探究
2. 使用催化剂,会影响反应速率,对生成物的总量没有影响。
3.要说某物质是催化剂,必须指明在哪个反应中。
4.对某一个反应能起催化作用的,不一定只有一种物质,也可能有多种物质。
1. 过氧化氢、氯酸钾等产生氧气的反应,不使用催化剂时,反应仍能发生。
新知探究
催化剂在生活中的作用
汽车尾气催化转换器
汽车尾气中含有一氧化氮和一氧化碳等有害气体,是造成城市空气污染的主要污染源。为了消除这些污染物,许多汽车都安装有催化转换器,利用贵金属(如铂、钯)催化剂,使污染物之间发生化学反应,转变为无毒气体二氧化碳和氮气。
新知探究
H2O2 H2O O2
KClO3 KCl O2
水
1、过氧化氢
氧气
+
二氧化锰
2、氯酸钾
氯化钾
+
氧气
二氧化锰
加热
3、高锰酸钾
锰酸钾
+
二氧化锰
+
氧气
加热
KMnO4 K2MnO4 MnO2 O2
讨论与交流
新知探究
讨论与交流
上述反应,从反应物和生成物的种数上分析,你又发现这三个反应有什么共同特点?
反应物:
都只有一种
生成物:
有两种或两种以上
由一种物质生成两种或两种以上其它物质的反应,叫做分解反应。
新知探究
分解反应
分解反应的特点:一变多
表示: AB→A+B
化合反应、分解反应都属于化学反应的基本类型。
氧化反应不属于基本反应类型。
新知探究
分解反应和化合反应的比较
分解反应 化合反应
定义 由一种物质生成两种或两种以上其它物质的反应 由两种或两种以上物质生成一种物质的反应
特点 一变多 多变一
通式 X→A+B+… A+B+…→X
举例
关系 都是化学反应的基本类型,二者属于并列关系 过氧化氢 水 + 氧气
氯酸钾 氯化钾+氧气
高锰酸钾 锰酸钾 + 二氧化锰 + 氧气
二氧化锰
二氧化锰
加热
加热
铁 + 氧气 四氧化三铁
点燃
硫 + 氧气 二氧化硫
点燃
碳 + 氧气 二氧化碳
点燃
新知探究
课堂小结
制取氧气
分解变多反应:一变多
催化剂:
一变二不变
氯酸钾→氯化钾氧气
过氧化氢→水+氧气
高锰酸钾→锰酸钾+二氧化锰+氧气
1、向过氧化氢溶液中加入少量二氧化锰,立即有大量的氧气产生,下列说法正确的是( )
C
A.过氧化氢中含有水和氧气
B.过氧化氢能使二氧化锰分解放出氧气
C.过氧化氢溶液分解可以产生水和氧气
D.反应产生的气体可以用燃着的小木条进行检验
课堂达标
2、下列反应属于分解反应的是( )
A
A.过氧化氢 水+氧气
B.二氧化碳+水 碳酸
C.碳+氧气 二氧化碳
D.氧化钙+水 氢氧化钙
二氧化锰
点燃
课堂达标
谢 谢 观 看
第三章 维持生命之气
—氧气
3.2 制取氧气
第 1 课 时
过氧化氢制氧气
1.认识过氧化氢溶液,以及制取氧气的优缺点;
2.了解催化剂和催化作用。
学习目标
氧气
新知导入
实验室制取氧气选择的药品有
药品 过氧化氢 氯酸钾 二氧化锰 高锰酸钾
颜色
状态
无色
暗紫色
白色
黑色
液体
固体
固体
粉末
新知探究
实验室制取氧气的反应原理
H2O2 H2O O2
KClO3 KCl O2
水
1、过氧化氢
氧气
+
二氧化锰
2、氯酸钾
氯化钾
+
氧气
二氧化锰
加热
3、高锰酸钾
锰酸钾
+
二氧化锰
+
氧气
加热
KMnO4 K2MnO4 MnO2 O2
新知探究
1、观察上述三个反应,除了都有氧气生成外,你还发现有什么共同的物质?
2、二氧化锰在这三个反应中分别扮演一个什么角色呢?
问题导向
新知探究
观察活动
新知探究
实验序号 图示 观察到的现象 推 断
(1)
(2)
(3)
(4)
常温下过氧化氢溶液放出氧气少
带火星的木条没有复燃
带火星的木条没有复燃
二氧化锰不能产生氧气
带火星的木条复燃
MnO2使过氧化氢在常温时迅速产生氧气
带火星的木条复燃
MnO2可以重复使用,使新加入的过氧化氢在常温时迅速产生氧气
新知探究
在化学反应中能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫催化剂(又叫触媒)。
催化剂
“一变”:改变其他物质的化学反应速率(改变≠加快)
“二不变”:本身的质量和化学性质在反应前后都没有改变
催化剂在化学反应中所起的作用叫催化作用
新知探究
①能改变其它物质的反应速率,这里的“改变”包括加快和减慢两种含义。
②催化剂的化学性质在化学反应前后没有改变,但是物理性质可能改变。
③催化剂是针对具体反应而言的,如二氧化锰在过氧化氢分解制取氧气时,能够起催化作用,是催化剂;但二氧化锰不是所有化学反应的催化剂。
④在某个化学反应中,可以选择不同的物质做为催化剂。如双氧水分解制取氧气时,既可以选择二氧化锰做催化剂,也可以选择氧化铁做催化剂。
新知探究
氧化铜、硫酸铜溶液、红砖粉等含金属元素的物质也可以做催化剂。
生物体中的酶也是一种生物催化剂。
新知探究
2. 使用催化剂,会影响反应速率,对生成物的总量没有影响。
3.要说某物质是催化剂,必须指明在哪个反应中。
4.对某一个反应能起催化作用的,不一定只有一种物质,也可能有多种物质。
1. 过氧化氢、氯酸钾等产生氧气的反应,不使用催化剂时,反应仍能发生。
新知探究
催化剂在生活中的作用
汽车尾气催化转换器
汽车尾气中含有一氧化氮和一氧化碳等有害气体,是造成城市空气污染的主要污染源。为了消除这些污染物,许多汽车都安装有催化转换器,利用贵金属(如铂、钯)催化剂,使污染物之间发生化学反应,转变为无毒气体二氧化碳和氮气。
新知探究
H2O2 H2O O2
KClO3 KCl O2
水
1、过氧化氢
氧气
+
二氧化锰
2、氯酸钾
氯化钾
+
氧气
二氧化锰
加热
3、高锰酸钾
锰酸钾
+
二氧化锰
+
氧气
加热
KMnO4 K2MnO4 MnO2 O2
讨论与交流
新知探究
讨论与交流
上述反应,从反应物和生成物的种数上分析,你又发现这三个反应有什么共同特点?
反应物:
都只有一种
生成物:
有两种或两种以上
由一种物质生成两种或两种以上其它物质的反应,叫做分解反应。
新知探究
分解反应
分解反应的特点:一变多
表示: AB→A+B
化合反应、分解反应都属于化学反应的基本类型。
氧化反应不属于基本反应类型。
新知探究
分解反应和化合反应的比较
分解反应 化合反应
定义 由一种物质生成两种或两种以上其它物质的反应 由两种或两种以上物质生成一种物质的反应
特点 一变多 多变一
通式 X→A+B+… A+B+…→X
举例
关系 都是化学反应的基本类型,二者属于并列关系 过氧化氢 水 + 氧气
氯酸钾 氯化钾+氧气
高锰酸钾 锰酸钾 + 二氧化锰 + 氧气
二氧化锰
二氧化锰
加热
加热
铁 + 氧气 四氧化三铁
点燃
硫 + 氧气 二氧化硫
点燃
碳 + 氧气 二氧化碳
点燃
新知探究
课堂小结
制取氧气
分解变多反应:一变多
催化剂:
一变二不变
氯酸钾→氯化钾氧气
过氧化氢→水+氧气
高锰酸钾→锰酸钾+二氧化锰+氧气
1、向过氧化氢溶液中加入少量二氧化锰,立即有大量的氧气产生,下列说法正确的是( )
C
A.过氧化氢中含有水和氧气
B.过氧化氢能使二氧化锰分解放出氧气
C.过氧化氢溶液分解可以产生水和氧气
D.反应产生的气体可以用燃着的小木条进行检验
课堂达标
2、下列反应属于分解反应的是( )
A
A.过氧化氢 水+氧气
B.二氧化碳+水 碳酸
C.碳+氧气 二氧化碳
D.氧化钙+水 氢氧化钙
二氧化锰
点燃
课堂达标
谢 谢 观 看
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
