粤教版化学九年级上册同步课件:2.1 空气的成分第一课时 空气中氧气含量的测定、空气的成分(共22张PPT内嵌视频)
文档属性
| 名称 | 粤教版化学九年级上册同步课件:2.1 空气的成分第一课时 空气中氧气含量的测定、空气的成分(共22张PPT内嵌视频) |  | |
| 格式 | pptx | ||
| 文件大小 | 15.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-24 12:09:42 | ||
图片预览








文档简介
(共22张PPT)
第二章 空气、物质的构成
2.1 空气的成分
第 1 课 时
空气中氧气含量的测定、空气的成分
1.认识身边最常见的物质——空气;
2.知道空气中各成分的含量以及纯净物和混合物;
3.初步学会如何测定空气中氧气的含量。
学习目标
说个宝,道个宝,说它宝贵到处有,看不见,摸不着,不香不臭没味道,万物生存离不了,在你身边看不见,越往高处它越少。”
空 气
学习目标
问题一 你有办法证明空气的存在吗?
1、空烧杯在盛满水的水槽中向下压
——烧杯内的水无法上升到顶部
2、扁的密封袋开袋后抖动,然后封好
——双手挤压有压力
3、扇子朝脸扇、树叶在动 ——有风
4、给车胎打气 ——鼓起来
新知导入
空气是由什么组成的?
→空气的发现史
18世纪70年代,瑞典科学家舍勒和英国化学家普利斯特里分别制得了氧气,但他们并没有意识到自己发现了氧气。
舍勒
普利斯特里
新知探究
空气是由什么组成的?
→拉瓦锡的贡献
1774年
法国化学家拉瓦锡第一次用实验证明了空气中有氧气和氮气。
新知探究
19世纪末
英国物理学家瑞利发现了稀有气体氩气,之后各个稀有气体陆续被发现。
→瑞利的贡献
空气是由什么组成的?
新知探究
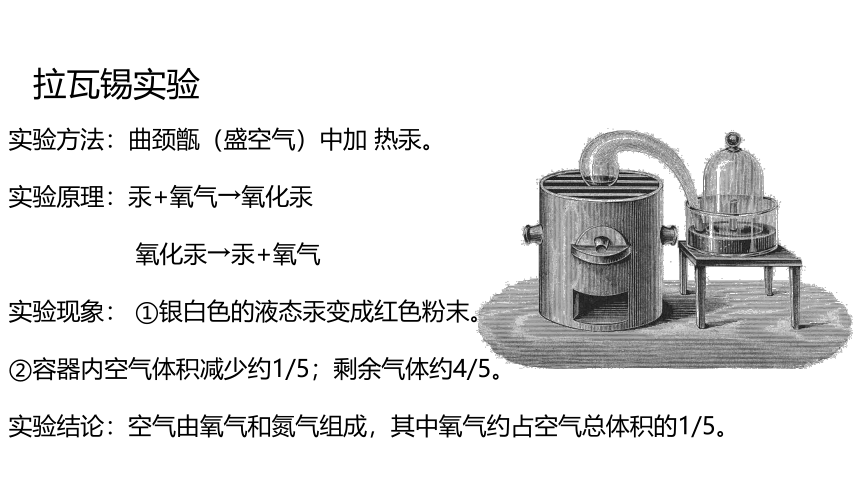
拉瓦锡实验
实验方法:曲颈甑(盛空气)中加 热汞。
实验原理:汞+氧气→氧化汞
氧化汞→汞+氧气
实验现象: ①银白色的液态汞变成红色粉末。
②容器内空气体积减少约1/5;剩余气体约4/5。
实验结论:空气由氧气和氮气组成,其中氧气约占空气总体积的1/5。
新知探究
实验原理
红磷在密闭容器内充分燃烧,消耗空气中的氧气,生成五氧化二磷固体。容器内压强减小,大气压将烧杯中的水压入集气瓶中,水的体积即为消耗氧气的体积,从而确定空气中氧气的体积分数。
空气中氧气含量的测定
新知探究
反应文字表达式:
红磷 + 氧气
五氧化二磷
点燃
测定空气中氧气的含量
新知探究
实验现象
1、红磷燃烧,产生大量白烟,放热;
2、冷却后,打开弹簧夹,烧杯中的水沿导管进入集气瓶内,进入瓶内的水的体积约占瓶内原空气总体积的1/5。
实验结论
(1)氧气约占空气总体积的五分之一。
(2)氮气不能燃烧,也不支持燃烧且不易溶于水。
新知探究
实验成功的关键是什么?
(1)装置气密性要好;
(2)红磷需过量;
(3)点燃后迅速伸入集气瓶,
立即塞紧瓶塞;
(4)待集气瓶冷却到室温后才
能打开止水夹进行读数。
新知探究
合作交流显身手
1.点燃红磷前打开止水夹,水不会倒流,为什么?
2.燃烧停止后,烧杯中的水进入集气瓶说明了什么?
3.是什么导致了集气瓶中的气体减少?减少的气体是什么?
4.减少的气体有多少?说明什么?
因为反应未发生,没有产生压强差。
说明产生了压强差,进而说明集气瓶中的气体减少。
减少的气体约占集气瓶体积的1/5,说明氧气约占空气总体积的1/5。
红磷燃烧消耗氧气导致了集气瓶中的气体减少,则减少气体是氧气
新知探究
如果在实际操作中, 水面上升的体积明显小于集气瓶总体积1/5 (即集气瓶中气体减少的体积会小于1/5 ),试分析可能的原因?
新知探究
1.装置气密性不好。
2.红磷的用量不足或集气瓶中的氧气没有消耗完。
3.导管中还残留有一些水。
4.装置没有冷却到室温就打开止水夹。
小于空气总体积的1/5的原因:
新知探究
大于空气总体积的1/5的原因:
(1)未夹紧弹簧夹,红磷燃烧时气体从导管逸出;(2)燃烧匙伸入过慢,瓶内空气受热逸出。
新知探究
交流讨论展悟性:
能否用木炭、硫代替红磷做实验?
不能,因为木炭和硫消耗掉氧气,但是又会产生气体,使得瓶内压强变化不大,水不会进入集气瓶;
新知探究
氮气(78%)
氧气(21%)
其他气体杂质(0.03%)
二氧化碳(0.03%)
稀有气体(0.94%)
空气的组成(体积分数)
巧 学 妙 记
氮七八,氧二一,零点九四是稀气,还有两个点零三,二氧化碳和杂气,体积分数要记清,莫与质量混一起。
新知探究
课堂小结
空气的成分
原理:密闭容器,压强变化
试剂:能与空气中的氧气反应,不与空气中的其他物质反应,产物不是气体
现象:白烟,水倒流1/5
结论:氧气约占空气体积的1/5
空气的成分:体积分数
测定空气中氧气的含量
1、(2020·甘孜中考)空气中各成分体积分数如右图所示,其中区域“a”代表的是( )
A.氮气 B.氧气
C.二氧化碳 D.氦气
A
课堂达标
2.(2020·邵阳中考)如图是“实验室测定空气中氧气含量”的实验装置图,下列有关说法错误的( )
A.可用木炭代替红磷进行实验
B.做该实验前,应检查装置的气密性
C.待装置冷却至室温后才能打开弹簧夹
D.若红磷不足,将导致测得氧气的含量小于五分之一
A
课堂达标
谢 谢 观 看
第二章 空气、物质的构成
2.1 空气的成分
第 1 课 时
空气中氧气含量的测定、空气的成分
1.认识身边最常见的物质——空气;
2.知道空气中各成分的含量以及纯净物和混合物;
3.初步学会如何测定空气中氧气的含量。
学习目标
说个宝,道个宝,说它宝贵到处有,看不见,摸不着,不香不臭没味道,万物生存离不了,在你身边看不见,越往高处它越少。”
空 气
学习目标
问题一 你有办法证明空气的存在吗?
1、空烧杯在盛满水的水槽中向下压
——烧杯内的水无法上升到顶部
2、扁的密封袋开袋后抖动,然后封好
——双手挤压有压力
3、扇子朝脸扇、树叶在动 ——有风
4、给车胎打气 ——鼓起来
新知导入
空气是由什么组成的?
→空气的发现史
18世纪70年代,瑞典科学家舍勒和英国化学家普利斯特里分别制得了氧气,但他们并没有意识到自己发现了氧气。
舍勒
普利斯特里
新知探究
空气是由什么组成的?
→拉瓦锡的贡献
1774年
法国化学家拉瓦锡第一次用实验证明了空气中有氧气和氮气。
新知探究
19世纪末
英国物理学家瑞利发现了稀有气体氩气,之后各个稀有气体陆续被发现。
→瑞利的贡献
空气是由什么组成的?
新知探究
拉瓦锡实验
实验方法:曲颈甑(盛空气)中加 热汞。
实验原理:汞+氧气→氧化汞
氧化汞→汞+氧气
实验现象: ①银白色的液态汞变成红色粉末。
②容器内空气体积减少约1/5;剩余气体约4/5。
实验结论:空气由氧气和氮气组成,其中氧气约占空气总体积的1/5。
新知探究
实验原理
红磷在密闭容器内充分燃烧,消耗空气中的氧气,生成五氧化二磷固体。容器内压强减小,大气压将烧杯中的水压入集气瓶中,水的体积即为消耗氧气的体积,从而确定空气中氧气的体积分数。
空气中氧气含量的测定
新知探究
反应文字表达式:
红磷 + 氧气
五氧化二磷
点燃
测定空气中氧气的含量
新知探究
实验现象
1、红磷燃烧,产生大量白烟,放热;
2、冷却后,打开弹簧夹,烧杯中的水沿导管进入集气瓶内,进入瓶内的水的体积约占瓶内原空气总体积的1/5。
实验结论
(1)氧气约占空气总体积的五分之一。
(2)氮气不能燃烧,也不支持燃烧且不易溶于水。
新知探究
实验成功的关键是什么?
(1)装置气密性要好;
(2)红磷需过量;
(3)点燃后迅速伸入集气瓶,
立即塞紧瓶塞;
(4)待集气瓶冷却到室温后才
能打开止水夹进行读数。
新知探究
合作交流显身手
1.点燃红磷前打开止水夹,水不会倒流,为什么?
2.燃烧停止后,烧杯中的水进入集气瓶说明了什么?
3.是什么导致了集气瓶中的气体减少?减少的气体是什么?
4.减少的气体有多少?说明什么?
因为反应未发生,没有产生压强差。
说明产生了压强差,进而说明集气瓶中的气体减少。
减少的气体约占集气瓶体积的1/5,说明氧气约占空气总体积的1/5。
红磷燃烧消耗氧气导致了集气瓶中的气体减少,则减少气体是氧气
新知探究
如果在实际操作中, 水面上升的体积明显小于集气瓶总体积1/5 (即集气瓶中气体减少的体积会小于1/5 ),试分析可能的原因?
新知探究
1.装置气密性不好。
2.红磷的用量不足或集气瓶中的氧气没有消耗完。
3.导管中还残留有一些水。
4.装置没有冷却到室温就打开止水夹。
小于空气总体积的1/5的原因:
新知探究
大于空气总体积的1/5的原因:
(1)未夹紧弹簧夹,红磷燃烧时气体从导管逸出;(2)燃烧匙伸入过慢,瓶内空气受热逸出。
新知探究
交流讨论展悟性:
能否用木炭、硫代替红磷做实验?
不能,因为木炭和硫消耗掉氧气,但是又会产生气体,使得瓶内压强变化不大,水不会进入集气瓶;
新知探究
氮气(78%)
氧气(21%)
其他气体杂质(0.03%)
二氧化碳(0.03%)
稀有气体(0.94%)
空气的组成(体积分数)
巧 学 妙 记
氮七八,氧二一,零点九四是稀气,还有两个点零三,二氧化碳和杂气,体积分数要记清,莫与质量混一起。
新知探究
课堂小结
空气的成分
原理:密闭容器,压强变化
试剂:能与空气中的氧气反应,不与空气中的其他物质反应,产物不是气体
现象:白烟,水倒流1/5
结论:氧气约占空气体积的1/5
空气的成分:体积分数
测定空气中氧气的含量
1、(2020·甘孜中考)空气中各成分体积分数如右图所示,其中区域“a”代表的是( )
A.氮气 B.氧气
C.二氧化碳 D.氦气
A
课堂达标
2.(2020·邵阳中考)如图是“实验室测定空气中氧气含量”的实验装置图,下列有关说法错误的( )
A.可用木炭代替红磷进行实验
B.做该实验前,应检查装置的气密性
C.待装置冷却至室温后才能打开弹簧夹
D.若红磷不足,将导致测得氧气的含量小于五分之一
A
课堂达标
谢 谢 观 看
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
