粤教版化学九年级下册同步课件:6.2 金属的化学性质(第二课时)(共21张PPT)
文档属性
| 名称 | 粤教版化学九年级下册同步课件:6.2 金属的化学性质(第二课时)(共21张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-24 15:55:26 | ||
图片预览






文档简介
(共21张PPT)
第六章 金属
6.2 金属的化学性质
第2课时 金属活动性顺序的应用
学习目标
1.能够判断一种金属能否与另一种金属的化合物溶液发生反应,并会书写相关的化学方程式。
2.记忆金属活动性顺序并会应用。
新知探究
新知探究
金属与金属化合物溶液的反应
新知探究
金属与金属化合物溶液的反应
新知探究
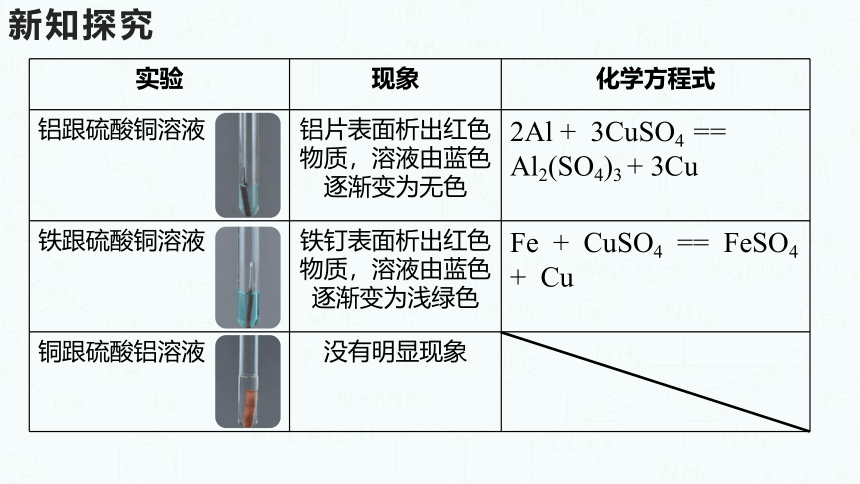
实验 现象 化学方程式
铝跟硫酸铜溶液 铝片表面析出红色物质,溶液由蓝色逐渐变为无色 2Al + 3CuSO4 == Al2(SO4)3 + 3Cu
铁跟硫酸铜溶液 铁钉表面析出红色物质,溶液由蓝色逐渐变为浅绿色 Fe + CuSO4 == FeSO4 + Cu
铜跟硫酸铝溶液 没有明显现象
新知探究
1.实验前用砂纸将金属丝表面打磨光亮,以免表面的氧化膜影响实验。
2.描述反应现象时要注意:一是置换出的金属附着在原金属的表面,二是要注意溶液颜色的变化。
3.铁与金属化合物溶液发生置换反应时,生成物中铁元素呈+2价。
4.此类反应必须在溶液中进行,即金属化合物要能溶于水,不溶于水的金属化合物一般不与金属反应,如:Fe与AgCl(不溶于水)不反应
特别提醒!
新知探究
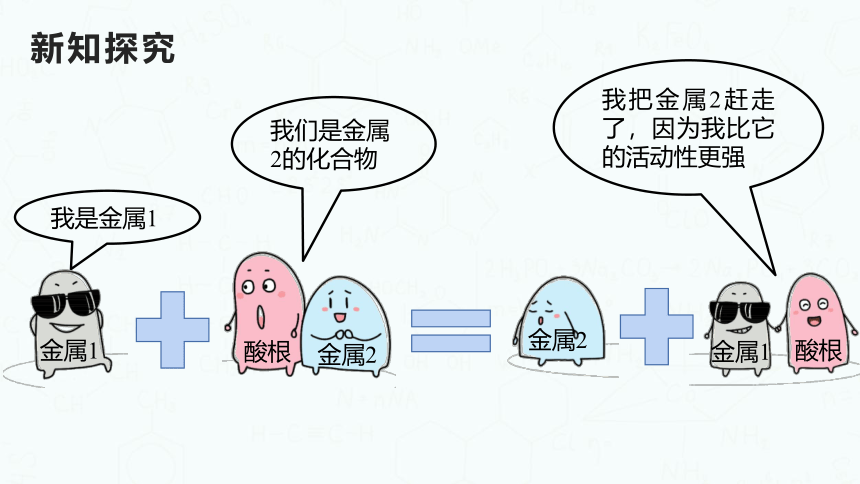
我们是金属2的化合物
我是金属1
金属2
酸根
金属2
金属1
酸根
我把金属2赶走了,因为我比它的活动性更强
金属1
新知探究
归纳结论
判断金属活动性的方法:
可根据金属能不能把另一种金属从其金属化合物溶液中
置换出来,判断金属活动性的强弱。
金属化合物必须溶于水
新知探究
通过刚刚的学习我们知道,铝、铁都能与硫酸铜溶液反应,而铜不能与硫酸铝溶液反应,大家知道这是为什么吗?
这也与金属的活动性强弱有关,较活泼的金属能将不如它活泼的金属从其化合物溶液中置换出来。
那么如何比较金属的活动性顺序呢?
新知探究
科学家经过多方面的研究,对金属的活动性进行排列如下,称为金属活动性顺序。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
K、Ca、Na、Mg、Al (见个大美女)
Zn、Fe、Sn、Pb、(H) (身体细纤轻)
Cu、Hg、Ag、Pt、Au (统共一百斤)
谐音
新知探究
想一想:从金属活动性顺序中我们能得出什么结论?
1.在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。
2.在金属活动性顺序里,位于氢前面的金属能置换出酸中的氢。
3.在金属活动顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液中置换出来。
2Al + 6HCl = 2AlCl3 + 3H2↑
Fe + H2SO4=== FeSO4+H2↑
Cu + HCl
===不反应
2Al + 3CuSO4 == Al2(SO4)3 + 3Cu
Fe + CuSO4 == FeSO4 + Cu
Cu + Al2(SO)3
===不反应
新知探究
1.金属活动性是指金属原子在溶液中失去电子的能力。
2.酸一般指稀硫酸、盐酸等不具有强氧化性的酸。浓硫酸、硝酸因具有强氧化性与金属反应不产生氢气。
3.铁与酸或金属化合物溶液发生置换反应时,生成亚铁化合物。
4.钾、钙、钠三种金属非常活泼,常温下能和水反应,因此这三种金属不能将位于它们后面的金属从其化合物溶液中置换出来。
特 别 说 明
前换后,盐可溶,钾钙钠,要除外
新知探究
金属活动性顺序的应用:
1.判断金属能否跟酸反应及反应的快慢;
(1)只有位于氢前面的金属才能置换出酸中的氢;
(2)这里的酸是指稀盐酸、稀硫酸等稀酸,不包含浓硫酸、硝酸;
(3)在金属活动性顺序表中越靠前的金属与酸反应越剧烈,反应速率越快;
新知探究
金属活动性顺序的应用:
2.判断金属能否与盐溶液反应;
(1)只有位于前面的金属能把位于后面的金属从它们的化合物的盐溶液中置换出来。
(2)这里的盐溶液必须是可溶的;
(3)这里的金属单质不能是钾、钙、钠。
新知探究
金属活动性顺序的应用:
3.判断金属与混合盐溶液的反应先后顺序;
在金属活动性顺序表中越靠后的金属越容易被其他活泼金属从其盐溶液中置换出来。
新知探究
浪漫的表白
课堂小结
2Al+3CuSO4 Al2(SO4)3+3Cu
金属与金属化合物溶液反应
金属的化学性质
Cu+2AgNO3 Cu(NO3)2+2Ag
金属活动性顺序的应用
1.比较金属的活动性强弱
2.判断金属与酸能否发生置换反应
3.判断金属和金属化合物溶液能否发生置换反应
课堂达标
1.验证镁、铜的金属活动性顺序,下列试剂不能选用的是( )
A.MgSO4溶液 B.KCl溶液
C.稀盐酸 D.ZnCl2溶液
B
课堂达标
2.在金属活动性顺序:
中,①②③处的金属依次是( )
A.Zn Mg Cu B.Mg Cu Zn
C.Mg Zn Cu D.Cu Zn Mg
C
谢 谢 观 看
第六章 金属
6.2 金属的化学性质
第2课时 金属活动性顺序的应用
学习目标
1.能够判断一种金属能否与另一种金属的化合物溶液发生反应,并会书写相关的化学方程式。
2.记忆金属活动性顺序并会应用。
新知探究
新知探究
金属与金属化合物溶液的反应
新知探究
金属与金属化合物溶液的反应
新知探究
实验 现象 化学方程式
铝跟硫酸铜溶液 铝片表面析出红色物质,溶液由蓝色逐渐变为无色 2Al + 3CuSO4 == Al2(SO4)3 + 3Cu
铁跟硫酸铜溶液 铁钉表面析出红色物质,溶液由蓝色逐渐变为浅绿色 Fe + CuSO4 == FeSO4 + Cu
铜跟硫酸铝溶液 没有明显现象
新知探究
1.实验前用砂纸将金属丝表面打磨光亮,以免表面的氧化膜影响实验。
2.描述反应现象时要注意:一是置换出的金属附着在原金属的表面,二是要注意溶液颜色的变化。
3.铁与金属化合物溶液发生置换反应时,生成物中铁元素呈+2价。
4.此类反应必须在溶液中进行,即金属化合物要能溶于水,不溶于水的金属化合物一般不与金属反应,如:Fe与AgCl(不溶于水)不反应
特别提醒!
新知探究
我们是金属2的化合物
我是金属1
金属2
酸根
金属2
金属1
酸根
我把金属2赶走了,因为我比它的活动性更强
金属1
新知探究
归纳结论
判断金属活动性的方法:
可根据金属能不能把另一种金属从其金属化合物溶液中
置换出来,判断金属活动性的强弱。
金属化合物必须溶于水
新知探究
通过刚刚的学习我们知道,铝、铁都能与硫酸铜溶液反应,而铜不能与硫酸铝溶液反应,大家知道这是为什么吗?
这也与金属的活动性强弱有关,较活泼的金属能将不如它活泼的金属从其化合物溶液中置换出来。
那么如何比较金属的活动性顺序呢?
新知探究
科学家经过多方面的研究,对金属的活动性进行排列如下,称为金属活动性顺序。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
K、Ca、Na、Mg、Al (见个大美女)
Zn、Fe、Sn、Pb、(H) (身体细纤轻)
Cu、Hg、Ag、Pt、Au (统共一百斤)
谐音
新知探究
想一想:从金属活动性顺序中我们能得出什么结论?
1.在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。
2.在金属活动性顺序里,位于氢前面的金属能置换出酸中的氢。
3.在金属活动顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液中置换出来。
2Al + 6HCl = 2AlCl3 + 3H2↑
Fe + H2SO4=== FeSO4+H2↑
Cu + HCl
===不反应
2Al + 3CuSO4 == Al2(SO4)3 + 3Cu
Fe + CuSO4 == FeSO4 + Cu
Cu + Al2(SO)3
===不反应
新知探究
1.金属活动性是指金属原子在溶液中失去电子的能力。
2.酸一般指稀硫酸、盐酸等不具有强氧化性的酸。浓硫酸、硝酸因具有强氧化性与金属反应不产生氢气。
3.铁与酸或金属化合物溶液发生置换反应时,生成亚铁化合物。
4.钾、钙、钠三种金属非常活泼,常温下能和水反应,因此这三种金属不能将位于它们后面的金属从其化合物溶液中置换出来。
特 别 说 明
前换后,盐可溶,钾钙钠,要除外
新知探究
金属活动性顺序的应用:
1.判断金属能否跟酸反应及反应的快慢;
(1)只有位于氢前面的金属才能置换出酸中的氢;
(2)这里的酸是指稀盐酸、稀硫酸等稀酸,不包含浓硫酸、硝酸;
(3)在金属活动性顺序表中越靠前的金属与酸反应越剧烈,反应速率越快;
新知探究
金属活动性顺序的应用:
2.判断金属能否与盐溶液反应;
(1)只有位于前面的金属能把位于后面的金属从它们的化合物的盐溶液中置换出来。
(2)这里的盐溶液必须是可溶的;
(3)这里的金属单质不能是钾、钙、钠。
新知探究
金属活动性顺序的应用:
3.判断金属与混合盐溶液的反应先后顺序;
在金属活动性顺序表中越靠后的金属越容易被其他活泼金属从其盐溶液中置换出来。
新知探究
浪漫的表白
课堂小结
2Al+3CuSO4 Al2(SO4)3+3Cu
金属与金属化合物溶液反应
金属的化学性质
Cu+2AgNO3 Cu(NO3)2+2Ag
金属活动性顺序的应用
1.比较金属的活动性强弱
2.判断金属与酸能否发生置换反应
3.判断金属和金属化合物溶液能否发生置换反应
课堂达标
1.验证镁、铜的金属活动性顺序,下列试剂不能选用的是( )
A.MgSO4溶液 B.KCl溶液
C.稀盐酸 D.ZnCl2溶液
B
课堂达标
2.在金属活动性顺序:
中,①②③处的金属依次是( )
A.Zn Mg Cu B.Mg Cu Zn
C.Mg Zn Cu D.Cu Zn Mg
C
谢 谢 观 看
