粤教版化学九年级下册同步课件:6.4 珍惜和保护金属资源(共27张PPT)
文档属性
| 名称 | 粤教版化学九年级下册同步课件:6.4 珍惜和保护金属资源(共27张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-24 15:49:59 | ||
图片预览








文档简介
(共27张PPT)
第六章 金属
6.4 珍惜和保护金属资源
学习目标
1.了解铁生锈的条件,体验铁生锈条件的探究活动过程和方法。
2.认识防锈的几类简单方法。
3.初步形成保护金属资源的意识。
新知导入
地球上金属矿物的开采剩余年限
新知导入
金属生锈
新知探究
为什么暴露在空气中的铁制品会生锈?什么条件下才会生锈呢?
【提出问题】钢铁锈蚀的因素有哪些?
【猜想与假设】
铁生锈与氧气?水分?有关
【实验与事实】
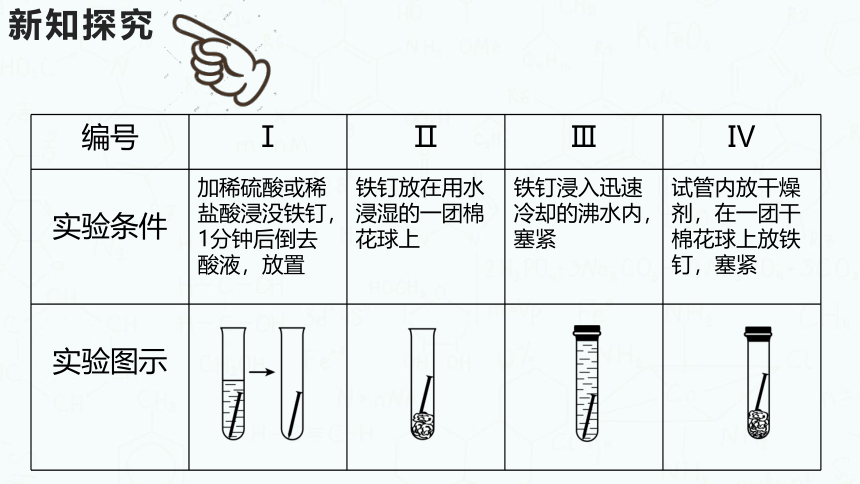
[实验]取4枚无锈的清洁铁钉,如下表所示,分别装在不同条件的试管内,并按下表要求观察记录:
新知探究
编号 Ⅰ Ⅱ Ⅲ Ⅳ
实验条件 加稀硫酸或稀盐酸浸没铁钉,1分钟后倒去酸液,放置 铁钉放在用水浸湿的一团棉花球上 铁钉浸入迅速冷却的沸水内,塞紧 试管内放干燥剂,在一团干棉花球上放铁钉,塞紧
实验图示
新知探究
一周后的实验现象 生锈 表面开 始生锈 无明显 现象 无明显
现象
实验条件分析 与酸、氧气、水接触 与氧气、水接触 只与水接触 只与氧气
接触
实验结论 实验Ⅱ和实验Ⅲ对比,说明铁生锈需要与氧气接触;实验Ⅱ和实验Ⅳ对比,说明铁生锈需要与水接触;实验Ⅰ和实验Ⅱ对比,说明铁在接触能与之反应的物质时,生锈速率加快,即铁生锈的条件是铁与水、氧气同时接触;铁遇易与它发生反应的化学物质(如酸溶液等)锈蚀速率更快。 新知探究
【思考与讨论】
1.通过实验现象分析,造成钢铁锈蚀的因素有哪些?
铁必须与氧气、水同时接触,缺一不可。
2.铁主要跟哪些物质反应而发生锈蚀,生成了什么?
铁
铁锈
与空气(氧气)反应
与水反应
新知探究
铁生锈的条件
新知探究
铁生锈的过程,实际上是铁与氧气、水蒸气等发生缓慢氧化反应的过程。生成的铁锈(铁锈的主要成分是Fe2O3 xH2O )为红棕色,疏松多孔,不能阻碍里层的铁继续与氧气、水等反应,因此铁制品可以全部锈蚀。
新知探究
1.铁的纯度,环境的温度、湿度、酸碱性等影响铁锈蚀的速率。
2.铜生锈的条件:铜与空气(或氧气)、水和二氧化碳同时接触,铜锈的主要成分是Cu2(OH)2CO3,俗称铜绿。
3.铁生锈原理的应用:
①利用铁粉缓慢氧化放热制成防寒暖贴;
②利用铁生锈吸收氧气和水蒸气制成
铁粉双吸剂,即食品中的防腐剂和干燥剂。
新知探究
典例训练
探究铁生锈的条件,有利于寻找防止铁制品锈蚀的方法。下列对比实验设计与所探究的条件(蒸馏水经煮沸并迅速冷却),对应关系正确的是( )
A.甲和乙:水 B.乙和丙:空气
C.甲和丙:空气 D.甲和丁:水
D
新知探究
家里如何防止菜刀生锈?家里用的铝壶为什么不容易锈蚀?
洗净、擦干、涂油
铝具有很好的抗腐蚀性能是因为铝与空气中的氧气反应生成一层致密的氧化铝薄膜,阻止铝进一步被氧化。
新知探究
钢铁防锈
新知探究
防止铁制品锈蚀的原理:破坏铁制品锈蚀的条件,使铁制品隔绝空气或水。
(只要破坏其中一个条件,铁就不能生锈)
新知探究
防止铁生锈的方法
干
膜
改
镀
烤
保持铁制品表面洁净和干燥
在钢铁表面覆盖保护层
防锈五字诀
在钢铁表面镀一层其他金属
用化学方法使钢铁表面形成致密的氧化膜
加入其他金属,改变其组成
新知探究
防止铁生锈的措施
1.将铁制品放置在干燥的环境中;
2.在铁制品表面涂上一层保护膜,如可涂油、刷漆;
3.在铁制品表面镀上其他金属;
4.用化学方法使钢铁表面形成致密的氧化膜,例如烤蓝;
5.改变金属内部结构制成合金,如将铁制成不锈钢。
新知探究
刷油漆
涂油
搪瓷
烤蓝
电镀
不锈钢
新知探究
金属除锈的方法
打磨
酸洗法
新知探究
我们应从哪些方面保护金属资源呢?
1.金属资源的合理开采
2.金属资源的回收利用
3.防止金属的锈蚀
4.努力需找金属替代品
新知探究
新知探究
新知探究
课堂小结
珍惜和保护金属资源
钢铁腐蚀
防锈措施
金属资源保护
原因:铁与氧气、水等发生化学反应
铁锈的主要成分为Fe2O3,疏松多孔,不能阻止反应的继续进行
保持铁制品表面清洁干燥
建立保护层,隔绝氧气与水分
改变内部结构,制成不锈钢
从资源的采掘与开发方面
从保护金属材料和制品方面
课堂达标
1.按如图装置进行实验,一周后发现铁钉锈蚀最严重的位置是( )
A.a处 B.b处
C.c处 D.三处同样严重
B
课堂达标
2.金属在生产生活中有广泛应用。
(1)我国深水钻井平台“981“用钢量达3万吨,露出平台的钢铁很容易生锈,钢铁生锈的条件是 。
(2)根据你所学的知识,为深水钻井平台“981”提出一种防止钢铁生锈的方法 。
潮湿的空气
在钢铁表面涂油、刷漆等
谢 谢 观 看
第六章 金属
6.4 珍惜和保护金属资源
学习目标
1.了解铁生锈的条件,体验铁生锈条件的探究活动过程和方法。
2.认识防锈的几类简单方法。
3.初步形成保护金属资源的意识。
新知导入
地球上金属矿物的开采剩余年限
新知导入
金属生锈
新知探究
为什么暴露在空气中的铁制品会生锈?什么条件下才会生锈呢?
【提出问题】钢铁锈蚀的因素有哪些?
【猜想与假设】
铁生锈与氧气?水分?有关
【实验与事实】
[实验]取4枚无锈的清洁铁钉,如下表所示,分别装在不同条件的试管内,并按下表要求观察记录:
新知探究
编号 Ⅰ Ⅱ Ⅲ Ⅳ
实验条件 加稀硫酸或稀盐酸浸没铁钉,1分钟后倒去酸液,放置 铁钉放在用水浸湿的一团棉花球上 铁钉浸入迅速冷却的沸水内,塞紧 试管内放干燥剂,在一团干棉花球上放铁钉,塞紧
实验图示
新知探究
一周后的实验现象 生锈 表面开 始生锈 无明显 现象 无明显
现象
实验条件分析 与酸、氧气、水接触 与氧气、水接触 只与水接触 只与氧气
接触
实验结论 实验Ⅱ和实验Ⅲ对比,说明铁生锈需要与氧气接触;实验Ⅱ和实验Ⅳ对比,说明铁生锈需要与水接触;实验Ⅰ和实验Ⅱ对比,说明铁在接触能与之反应的物质时,生锈速率加快,即铁生锈的条件是铁与水、氧气同时接触;铁遇易与它发生反应的化学物质(如酸溶液等)锈蚀速率更快。 新知探究
【思考与讨论】
1.通过实验现象分析,造成钢铁锈蚀的因素有哪些?
铁必须与氧气、水同时接触,缺一不可。
2.铁主要跟哪些物质反应而发生锈蚀,生成了什么?
铁
铁锈
与空气(氧气)反应
与水反应
新知探究
铁生锈的条件
新知探究
铁生锈的过程,实际上是铁与氧气、水蒸气等发生缓慢氧化反应的过程。生成的铁锈(铁锈的主要成分是Fe2O3 xH2O )为红棕色,疏松多孔,不能阻碍里层的铁继续与氧气、水等反应,因此铁制品可以全部锈蚀。
新知探究
1.铁的纯度,环境的温度、湿度、酸碱性等影响铁锈蚀的速率。
2.铜生锈的条件:铜与空气(或氧气)、水和二氧化碳同时接触,铜锈的主要成分是Cu2(OH)2CO3,俗称铜绿。
3.铁生锈原理的应用:
①利用铁粉缓慢氧化放热制成防寒暖贴;
②利用铁生锈吸收氧气和水蒸气制成
铁粉双吸剂,即食品中的防腐剂和干燥剂。
新知探究
典例训练
探究铁生锈的条件,有利于寻找防止铁制品锈蚀的方法。下列对比实验设计与所探究的条件(蒸馏水经煮沸并迅速冷却),对应关系正确的是( )
A.甲和乙:水 B.乙和丙:空气
C.甲和丙:空气 D.甲和丁:水
D
新知探究
家里如何防止菜刀生锈?家里用的铝壶为什么不容易锈蚀?
洗净、擦干、涂油
铝具有很好的抗腐蚀性能是因为铝与空气中的氧气反应生成一层致密的氧化铝薄膜,阻止铝进一步被氧化。
新知探究
钢铁防锈
新知探究
防止铁制品锈蚀的原理:破坏铁制品锈蚀的条件,使铁制品隔绝空气或水。
(只要破坏其中一个条件,铁就不能生锈)
新知探究
防止铁生锈的方法
干
膜
改
镀
烤
保持铁制品表面洁净和干燥
在钢铁表面覆盖保护层
防锈五字诀
在钢铁表面镀一层其他金属
用化学方法使钢铁表面形成致密的氧化膜
加入其他金属,改变其组成
新知探究
防止铁生锈的措施
1.将铁制品放置在干燥的环境中;
2.在铁制品表面涂上一层保护膜,如可涂油、刷漆;
3.在铁制品表面镀上其他金属;
4.用化学方法使钢铁表面形成致密的氧化膜,例如烤蓝;
5.改变金属内部结构制成合金,如将铁制成不锈钢。
新知探究
刷油漆
涂油
搪瓷
烤蓝
电镀
不锈钢
新知探究
金属除锈的方法
打磨
酸洗法
新知探究
我们应从哪些方面保护金属资源呢?
1.金属资源的合理开采
2.金属资源的回收利用
3.防止金属的锈蚀
4.努力需找金属替代品
新知探究
新知探究
新知探究
课堂小结
珍惜和保护金属资源
钢铁腐蚀
防锈措施
金属资源保护
原因:铁与氧气、水等发生化学反应
铁锈的主要成分为Fe2O3,疏松多孔,不能阻止反应的继续进行
保持铁制品表面清洁干燥
建立保护层,隔绝氧气与水分
改变内部结构,制成不锈钢
从资源的采掘与开发方面
从保护金属材料和制品方面
课堂达标
1.按如图装置进行实验,一周后发现铁钉锈蚀最严重的位置是( )
A.a处 B.b处
C.c处 D.三处同样严重
B
课堂达标
2.金属在生产生活中有广泛应用。
(1)我国深水钻井平台“981“用钢量达3万吨,露出平台的钢铁很容易生锈,钢铁生锈的条件是 。
(2)根据你所学的知识,为深水钻井平台“981”提出一种防止钢铁生锈的方法 。
潮湿的空气
在钢铁表面涂油、刷漆等
谢 谢 观 看
