粤教版化学九年级下册同步课件:7.2 物质溶解的量(第2课时)(共27张PPT)
文档属性
| 名称 | 粤教版化学九年级下册同步课件:7.2 物质溶解的量(第2课时)(共27张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-24 15:48:22 | ||
图片预览




文档简介
(共27张PPT)
第七章 溶液
7.2 物质溶解的量
第2课时 固体、气体物质的溶解度 溶解度曲线
学习目标
1.知道气体溶解度的表示方法及其影响因素。
2.知道溶解度的意义并会应用物质的溶解度及溶解度曲线解决问题。
3.认识溶解量、溶解性与溶解度的关系。
新知导入
你知道为什么“冬天捞碱,夏天晒盐”吗?
通过上节课的学习我们知道:溶质在溶剂中的溶解量是有限度的,那么科学上是如何量度这种溶解限度的呢?
新知探究
怎样比较物质的溶解能力呢?应该控制哪些条件?
NaCl
KNO3
10℃
40℃
这样可以吗?
应该在同一温度下
新知探究
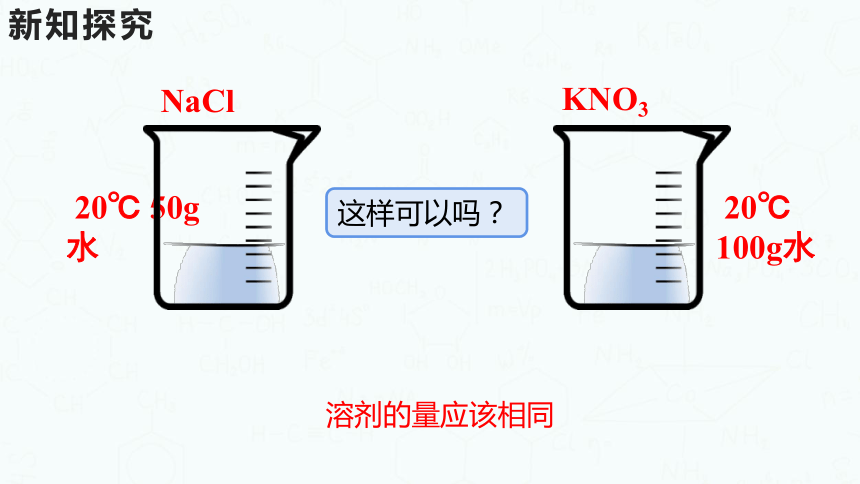
20℃ 100g水
20℃ 50g水
溶剂的量应该相同
这样可以吗?
NaCl
KNO3
新知探究
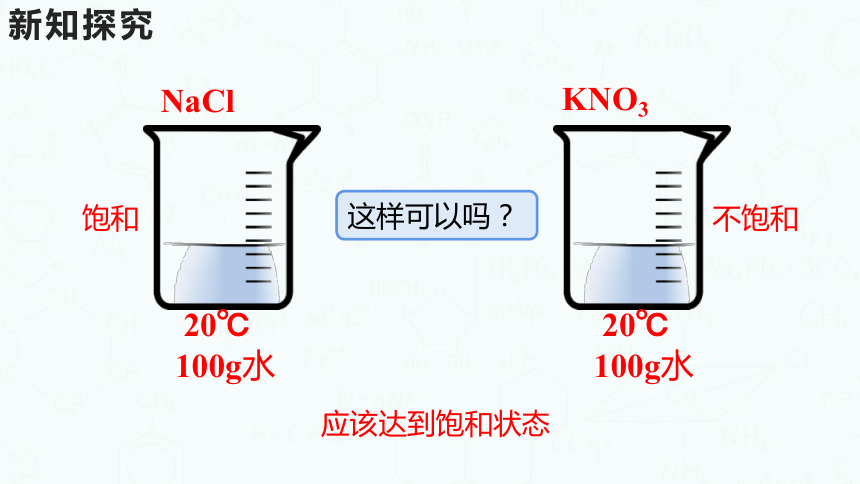
NaCl
KNO3
20℃ 100g水
20℃ 100g水
应该达到饱和状态
饱和
不饱和
这样可以吗?
新知探究
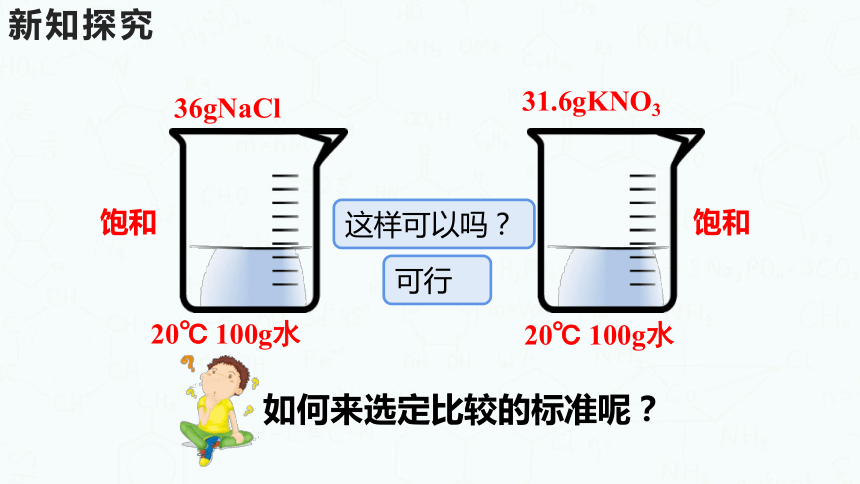
36gNaCl
31.6gKNO3
20℃ 100g水
20℃ 100g水
饱和
饱和
如何来选定比较的标准呢?
这样可以吗?
可行
新知探究
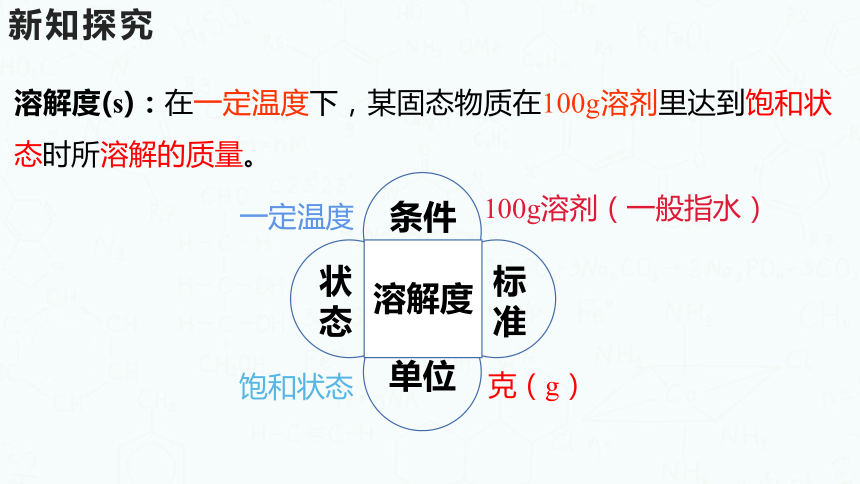
溶解度(s):在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量。
溶解度
条件
标准
状态
单位
100g溶剂(一般指水)
克(g)
一定温度
饱和状态
新知探究
讨论思考
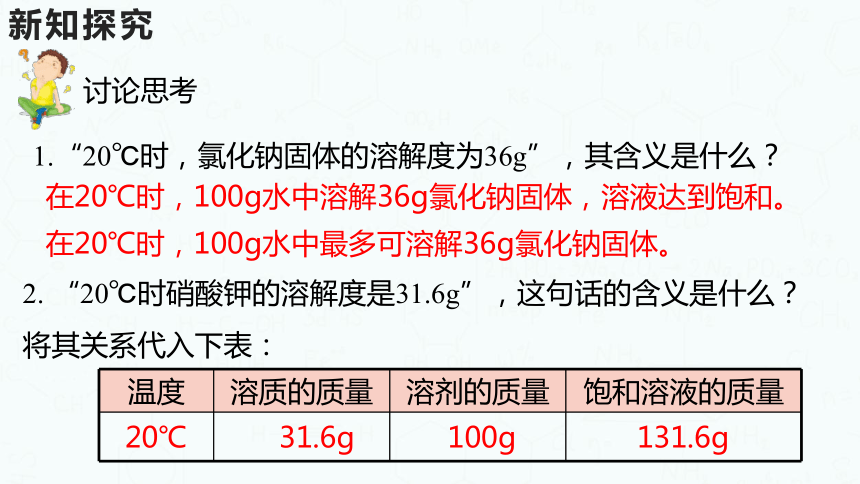
1.“20℃时,氯化钠固体的溶解度为36g”,其含义是什么?
2. “20℃时硝酸钾的溶解度是31.6g”,这句话的含义是什么?将其关系代入下表:
在20℃时,100g水中溶解36g氯化钠固体,溶液达到饱和。
在20℃时,100g水中最多可溶解36g氯化钠固体。
温度 溶质的质量 溶剂的质量 饱和溶液的质量
20℃
31.6g
100g
131.6g
新知探究
易错点:
1.溶解度一定要标明温度,温度不同,溶解度不同;
2.溶解度是100g水中溶解的最大溶质质量(饱和状态),而不是100g溶液。
3.如果不指明溶剂,通常所说的溶解度是指物质在水中的溶解度;
4.影响固体物质溶解度大小的主要因素是温度以及溶质、溶剂的性质,而与溶质、溶剂的质量多少无关。
新知探究
固体物质溶解度与溶解性的关系
根据物质在20℃时溶解度大小,人们把物质在水中的溶解能力(又称为溶解性)分为了以下几个等级:
溶解度/g(20℃) <0.01 0.01~1 1~10 >10
溶解性 难溶 微溶 可溶 易溶
举例 AgCl、CaCO3 Ca(OH)2 KClO3 KNO3、NaCl
其中,难溶物又称为不溶物,不溶是相对的,绝对不溶的物质是没有的。
新知探究
溶解度的表示方法
(2)列表法:
(1)语言直叙法:
温度/℃ 0 10 20 30 40 50 60 70 80 90 100
溶 解 度 /g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4 39.0 39.8
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110 138 169 202 246
新知探究
(3)溶解度曲线图法
用横坐标表示温度,纵坐标表示溶解度,根据实验测得的某物质在不同温度下的溶解度数据,在直角坐标系上描点并用平滑的曲线连接起来,即可绘制出溶解度随温度变化的曲线,这种曲线叫做溶解度曲线。
新知探究
溶解度曲线的意义
内容 表示意义
点 曲线上的点 表示某物质在对应温度下的溶解度
两曲线的交点 表示两物质在该点对应温度下的溶解度相等
线 表示某物质在不同温度下的溶解度以及溶解度随温度的变化规律
面 曲线以上的区域 表示溶液中有溶质剩余,得到的是对应温度下该溶质的饱和溶液
曲线以下的区域 表示溶液是对应温度下该溶质的不饱和溶液
新知探究
溶解度曲线的变化规律
a.陡升型。大多数固体物质的溶解度随温度的升高而增大,表现为曲线坡度陡增,如KNO3、NH4NO3等。
b.缓升型。少数固体物质的溶解度受温度变化的影响较小,表现为曲线坡度比较平缓,如NaCl。
c.下降型。极少数固体物质的溶解度随温度的升高而减小,表现为曲线坡度下降,如Ca(OH)2。
新知探究
①溶解度曲线上每一点表示某物质在某温度下的溶解度,且溶液是饱和溶液。
②在溶解度曲线下方的点表示溶液是不饱和溶液。
③在溶解度曲线上方的点表示溶液是饱和溶液(且溶液中还有未溶解的溶质存在)。
溶解度曲线上的点和上方、下方的点分别代表什么意思?
新知探究
归纳总结
如图,已知曲线a,b分别为两种固体物质甲、乙的溶解度曲线。
曲线a:物质甲的溶解度随温度的升高而增大,受温度变化影响较大。
曲线b:物质乙的溶解度随温度的升高而缓慢增大,受温度变化影响较小。
N点:物质甲在t1℃时的溶解度为S1g。
P点:物质乙在t3℃时的溶解度为S3g。
M点:在t2℃时物质甲和物质乙的溶解度相等,都为S2g。
新知探究
当甲中含有少量乙(如KNO3中含有少量的NaCl)时,可采用冷却热饱和溶液(降温结晶)法分离(或提纯)出物质甲。
当乙中含有少量甲(如NaCl中含有少量的KNO3)时,可采用蒸发结晶法分离(或提纯)出物质乙。
归纳总结
如图,已知曲线a,b分别为两种固体物质甲、乙的溶解度曲线。
新知探究
观察一瓶汽水(或啤酒),未能发现有气泡,打开瓶盖后,会发现有大量气泡,这是为什么?
开盖前的啤酒
开盖后的啤酒
新知探究
这与二氧化碳气体的溶解度有关系,打开汽水的瓶盖,瓶内压强减小,会导致气体的溶解度减小,气体逸出。
那么什么是气体的溶解度,它与哪些因素有关呢?
气体溶解度:在压强为101KPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积。
气体溶解度的五要素:
(1)压强为101kPa (2)一定温度 (3)1体积水
(4)达到饱和 (5)气体的体积
新知探究
0℃时,氧气的溶解度为0.049的含义是什么?
在0℃,压强为101kPa时,1体积水最多能溶解0. 049体积氧气
气体溶解度的影响因素
(1)压强。压强大,溶解气体多。
(2)温度。温度高,溶解少
新知探究
固体溶解度与气体溶解度异同
固体溶解度(S) 气体溶解度
条件 在一定温度下 在一定温度,101KPa时
标准 100g 溶剂(水) 1体积溶剂(水)
状态 饱和 饱和
单位 g 比值的单位为 1
影响因素 温度 温度和压强
变化规律 固体溶质一般随温度的升高溶解度增大,除熟石灰例外 气体的溶解度随温度的升高而减小;随压强的增大而增大
课堂小结
固体溶解度
溶解度
气体溶解度
条件:温度
标准:100g溶剂
状态:饱和状态溶质的质量以“克(g)”为单位
影响因素:温度
溶解度曲线
影响因素:温度和压强
课堂达标
1.20℃时,把36克氯化钠放入64克水中,使其充分溶解(20℃时氯化钠的溶解度为36克)。对所得溶液的有关说法错误的是( )
A.该溶液是饱和溶液
B.溶液中Na+和Cl﹣个数一定相等
C.溶液质量为100克
D.溶质与溶剂质量比为9:25
C
课堂达标
2.如图为甲、乙、丙三种固体物质(不含结晶水)的溶解度曲线。下列相关说法中正确的是( )
A.将甲和乙两物质的饱和溶液从t3℃降温至t2℃时,析出
晶体质量:甲>乙
B.将接近饱和的丙溶液变为饱和溶液,可以采用升高溶液温度的方法
C.甲中含少量乙时,可采用蒸发溶剂的方法提纯甲
D.t1℃时,将30g丙物质加入到50g水中形成溶液的质量为80g
B
课堂达标
3.汽水中溶有一定量的二氧化碳气体,打开瓶盖时,你会发现汽水会自动喷出来,喝了汽水后又常常会打嗝。这说明气体在水中的溶解度与压强和温度有关。下列关于气体溶解度的说法,正确的是( )
压强减小,气体溶解度增大
压强减小,气体溶解度减小
C. 温度升高,气体溶解度增大
D. 温度降低,气体溶解度减小
B
谢 谢 观 看
第七章 溶液
7.2 物质溶解的量
第2课时 固体、气体物质的溶解度 溶解度曲线
学习目标
1.知道气体溶解度的表示方法及其影响因素。
2.知道溶解度的意义并会应用物质的溶解度及溶解度曲线解决问题。
3.认识溶解量、溶解性与溶解度的关系。
新知导入
你知道为什么“冬天捞碱,夏天晒盐”吗?
通过上节课的学习我们知道:溶质在溶剂中的溶解量是有限度的,那么科学上是如何量度这种溶解限度的呢?
新知探究
怎样比较物质的溶解能力呢?应该控制哪些条件?
NaCl
KNO3
10℃
40℃
这样可以吗?
应该在同一温度下
新知探究
20℃ 100g水
20℃ 50g水
溶剂的量应该相同
这样可以吗?
NaCl
KNO3
新知探究
NaCl
KNO3
20℃ 100g水
20℃ 100g水
应该达到饱和状态
饱和
不饱和
这样可以吗?
新知探究
36gNaCl
31.6gKNO3
20℃ 100g水
20℃ 100g水
饱和
饱和
如何来选定比较的标准呢?
这样可以吗?
可行
新知探究
溶解度(s):在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量。
溶解度
条件
标准
状态
单位
100g溶剂(一般指水)
克(g)
一定温度
饱和状态
新知探究
讨论思考
1.“20℃时,氯化钠固体的溶解度为36g”,其含义是什么?
2. “20℃时硝酸钾的溶解度是31.6g”,这句话的含义是什么?将其关系代入下表:
在20℃时,100g水中溶解36g氯化钠固体,溶液达到饱和。
在20℃时,100g水中最多可溶解36g氯化钠固体。
温度 溶质的质量 溶剂的质量 饱和溶液的质量
20℃
31.6g
100g
131.6g
新知探究
易错点:
1.溶解度一定要标明温度,温度不同,溶解度不同;
2.溶解度是100g水中溶解的最大溶质质量(饱和状态),而不是100g溶液。
3.如果不指明溶剂,通常所说的溶解度是指物质在水中的溶解度;
4.影响固体物质溶解度大小的主要因素是温度以及溶质、溶剂的性质,而与溶质、溶剂的质量多少无关。
新知探究
固体物质溶解度与溶解性的关系
根据物质在20℃时溶解度大小,人们把物质在水中的溶解能力(又称为溶解性)分为了以下几个等级:
溶解度/g(20℃) <0.01 0.01~1 1~10 >10
溶解性 难溶 微溶 可溶 易溶
举例 AgCl、CaCO3 Ca(OH)2 KClO3 KNO3、NaCl
其中,难溶物又称为不溶物,不溶是相对的,绝对不溶的物质是没有的。
新知探究
溶解度的表示方法
(2)列表法:
(1)语言直叙法:
温度/℃ 0 10 20 30 40 50 60 70 80 90 100
溶 解 度 /g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4 39.0 39.8
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110 138 169 202 246
新知探究
(3)溶解度曲线图法
用横坐标表示温度,纵坐标表示溶解度,根据实验测得的某物质在不同温度下的溶解度数据,在直角坐标系上描点并用平滑的曲线连接起来,即可绘制出溶解度随温度变化的曲线,这种曲线叫做溶解度曲线。
新知探究
溶解度曲线的意义
内容 表示意义
点 曲线上的点 表示某物质在对应温度下的溶解度
两曲线的交点 表示两物质在该点对应温度下的溶解度相等
线 表示某物质在不同温度下的溶解度以及溶解度随温度的变化规律
面 曲线以上的区域 表示溶液中有溶质剩余,得到的是对应温度下该溶质的饱和溶液
曲线以下的区域 表示溶液是对应温度下该溶质的不饱和溶液
新知探究
溶解度曲线的变化规律
a.陡升型。大多数固体物质的溶解度随温度的升高而增大,表现为曲线坡度陡增,如KNO3、NH4NO3等。
b.缓升型。少数固体物质的溶解度受温度变化的影响较小,表现为曲线坡度比较平缓,如NaCl。
c.下降型。极少数固体物质的溶解度随温度的升高而减小,表现为曲线坡度下降,如Ca(OH)2。
新知探究
①溶解度曲线上每一点表示某物质在某温度下的溶解度,且溶液是饱和溶液。
②在溶解度曲线下方的点表示溶液是不饱和溶液。
③在溶解度曲线上方的点表示溶液是饱和溶液(且溶液中还有未溶解的溶质存在)。
溶解度曲线上的点和上方、下方的点分别代表什么意思?
新知探究
归纳总结
如图,已知曲线a,b分别为两种固体物质甲、乙的溶解度曲线。
曲线a:物质甲的溶解度随温度的升高而增大,受温度变化影响较大。
曲线b:物质乙的溶解度随温度的升高而缓慢增大,受温度变化影响较小。
N点:物质甲在t1℃时的溶解度为S1g。
P点:物质乙在t3℃时的溶解度为S3g。
M点:在t2℃时物质甲和物质乙的溶解度相等,都为S2g。
新知探究
当甲中含有少量乙(如KNO3中含有少量的NaCl)时,可采用冷却热饱和溶液(降温结晶)法分离(或提纯)出物质甲。
当乙中含有少量甲(如NaCl中含有少量的KNO3)时,可采用蒸发结晶法分离(或提纯)出物质乙。
归纳总结
如图,已知曲线a,b分别为两种固体物质甲、乙的溶解度曲线。
新知探究
观察一瓶汽水(或啤酒),未能发现有气泡,打开瓶盖后,会发现有大量气泡,这是为什么?
开盖前的啤酒
开盖后的啤酒
新知探究
这与二氧化碳气体的溶解度有关系,打开汽水的瓶盖,瓶内压强减小,会导致气体的溶解度减小,气体逸出。
那么什么是气体的溶解度,它与哪些因素有关呢?
气体溶解度:在压强为101KPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积。
气体溶解度的五要素:
(1)压强为101kPa (2)一定温度 (3)1体积水
(4)达到饱和 (5)气体的体积
新知探究
0℃时,氧气的溶解度为0.049的含义是什么?
在0℃,压强为101kPa时,1体积水最多能溶解0. 049体积氧气
气体溶解度的影响因素
(1)压强。压强大,溶解气体多。
(2)温度。温度高,溶解少
新知探究
固体溶解度与气体溶解度异同
固体溶解度(S) 气体溶解度
条件 在一定温度下 在一定温度,101KPa时
标准 100g 溶剂(水) 1体积溶剂(水)
状态 饱和 饱和
单位 g 比值的单位为 1
影响因素 温度 温度和压强
变化规律 固体溶质一般随温度的升高溶解度增大,除熟石灰例外 气体的溶解度随温度的升高而减小;随压强的增大而增大
课堂小结
固体溶解度
溶解度
气体溶解度
条件:温度
标准:100g溶剂
状态:饱和状态溶质的质量以“克(g)”为单位
影响因素:温度
溶解度曲线
影响因素:温度和压强
课堂达标
1.20℃时,把36克氯化钠放入64克水中,使其充分溶解(20℃时氯化钠的溶解度为36克)。对所得溶液的有关说法错误的是( )
A.该溶液是饱和溶液
B.溶液中Na+和Cl﹣个数一定相等
C.溶液质量为100克
D.溶质与溶剂质量比为9:25
C
课堂达标
2.如图为甲、乙、丙三种固体物质(不含结晶水)的溶解度曲线。下列相关说法中正确的是( )
A.将甲和乙两物质的饱和溶液从t3℃降温至t2℃时,析出
晶体质量:甲>乙
B.将接近饱和的丙溶液变为饱和溶液,可以采用升高溶液温度的方法
C.甲中含少量乙时,可采用蒸发溶剂的方法提纯甲
D.t1℃时,将30g丙物质加入到50g水中形成溶液的质量为80g
B
课堂达标
3.汽水中溶有一定量的二氧化碳气体,打开瓶盖时,你会发现汽水会自动喷出来,喝了汽水后又常常会打嗝。这说明气体在水中的溶解度与压强和温度有关。下列关于气体溶解度的说法,正确的是( )
压强减小,气体溶解度增大
压强减小,气体溶解度减小
C. 温度升高,气体溶解度增大
D. 温度降低,气体溶解度减小
B
谢 谢 观 看
