人教版化学九年级下册 第九单元 课题3 溶质的质量分数(第1课时)学案
文档属性
| 名称 | 人教版化学九年级下册 第九单元 课题3 溶质的质量分数(第1课时)学案 |
|
|
| 格式 | doc | ||
| 文件大小 | 45.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-24 00:00:00 | ||
图片预览

文档简介
课题3溶质的质量分数(第1课时)
【学习目标】
1、掌握溶液中溶质的质量分数的概念。并将质量分数与溶解度进行对比,加深对这两个概念的理解。
2、掌握有关溶液中溶质的质量分数的基本计算。
【学习重点】溶质的质量分数的概念及其基本计算。
【学习难点】溶质的质量分数的概念及其基本计算。
【学习过程】
一、定向入境
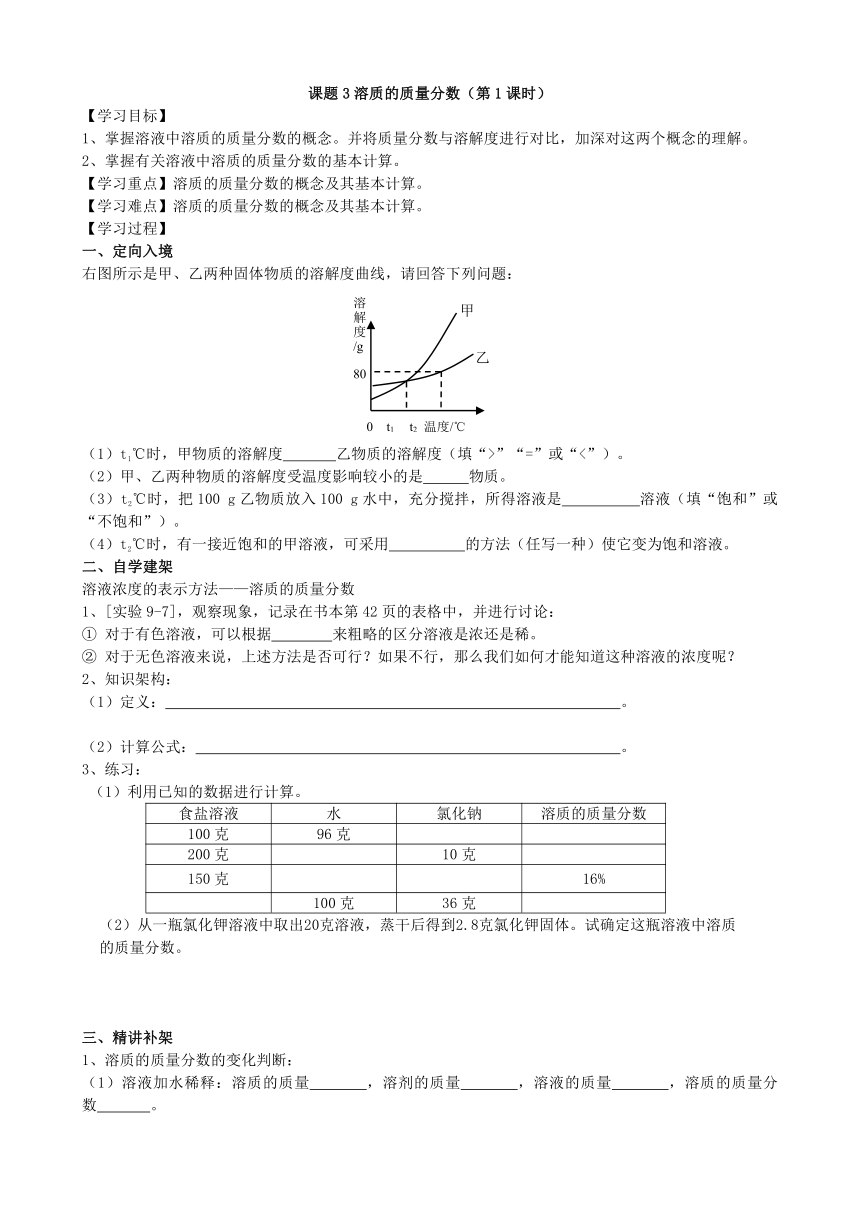
右图所示是甲、乙两种固体物质的溶解度曲线,请回答下列问题:
(1)t1℃时,甲物质的溶解度 乙物质的溶解度(填“>”“=”或“<”)。
(2)甲、乙两种物质的溶解度受温度影响较小的是 物质。
(3)t2℃时,把100 g乙物质放入100 g水中,充分搅拌,所得溶液是 溶液(填“饱和”或“不饱和”)。
(4)t2℃时,有一接近饱和的甲溶液,可采用 的方法(任写一种)使它变为饱和溶液。
二、自学建架
溶液浓度的表示方法——溶质的质量分数
1、[实验9-7],观察现象,记录在书本第42页的表格中,并进行讨论:
① 对于有色溶液,可以根据 来粗略的区分溶液是浓还是稀。
② 对于无色溶液来说,上述方法是否可行?如果不行,那么我们如何才能知道这种溶液的浓度呢?
2、知识架构:
(1)定义: 。
(2)计算公式: 。
3、练习:
(1)利用已知的数据进行计算。
食盐溶液 水 氯化钠 溶质的质量分数
100克 96克
200克 10克
150克 16%
100克 36克
(2)从一瓶氯化钾溶液中取出20克溶液,蒸干后得到2.8克氯化钾固体。试确定这瓶溶液中溶质的质量分数。
三、精讲补架
1、溶质的质量分数的变化判断:
(1)溶液加水稀释:溶质的质量 ,溶剂的质量 ,溶液的质量 ,溶质的质量分数 。
(2)溶液加溶质:
①对于不饱和溶液,溶质的质量 ,溶剂的质量 ,溶液的质量 ,溶质的质量分数 。
②对于饱和溶液,溶质的质量 ,溶剂的质量 ,溶液的质量 ,溶质的质量分数 。
2、溶质的质量分数与溶解度的区别和联系:
溶解度(S) 溶质的质量分数(w)
区别 条件
状态
计算公式
单位
联系
[例题1]已知40℃时氯化钾的溶解度是40g,计算40 ℃时氯化钾饱和溶液的溶质的质量分数?
四、达标巩固
1、某溶液加水稀释前后,溶液中保持不变的是 ( )
A.溶液中溶质的质量分数 B.溶液的质量 C.溶质的质量 D.溶剂的质量
2、现有ag某溶液,其中含溶剂bg,则此溶液的溶质的质量分数为 ( )
3、在一定温度下,从100gNaOH饱和溶液中倒出20g溶液,对于倒出的溶液。其数值不发生变化的是( )
A.溶质的质量分数 B.溶液的质量 C.溶质的质量 D.NaOH的溶解度
4、下列条件下的熟石灰溶液,溶质的质量分数最大的是( )
A.80℃的饱和溶液 B.20℃的饱和溶液
C.8O℃的不饱和溶液 D.20℃的不饱和溶液
5、向90 g 10%的硝酸钠溶液中加入 10 g硫酸钾并搅拌至完全溶解,则所得溶液中硝酸钠的溶质的质量分数是( )
A.19% B.10% C.9% D.无法计算
甲
乙
0 t1 t2 温度/℃
溶解度/g
80
【学习目标】
1、掌握溶液中溶质的质量分数的概念。并将质量分数与溶解度进行对比,加深对这两个概念的理解。
2、掌握有关溶液中溶质的质量分数的基本计算。
【学习重点】溶质的质量分数的概念及其基本计算。
【学习难点】溶质的质量分数的概念及其基本计算。
【学习过程】
一、定向入境
右图所示是甲、乙两种固体物质的溶解度曲线,请回答下列问题:
(1)t1℃时,甲物质的溶解度 乙物质的溶解度(填“>”“=”或“<”)。
(2)甲、乙两种物质的溶解度受温度影响较小的是 物质。
(3)t2℃时,把100 g乙物质放入100 g水中,充分搅拌,所得溶液是 溶液(填“饱和”或“不饱和”)。
(4)t2℃时,有一接近饱和的甲溶液,可采用 的方法(任写一种)使它变为饱和溶液。
二、自学建架
溶液浓度的表示方法——溶质的质量分数
1、[实验9-7],观察现象,记录在书本第42页的表格中,并进行讨论:
① 对于有色溶液,可以根据 来粗略的区分溶液是浓还是稀。
② 对于无色溶液来说,上述方法是否可行?如果不行,那么我们如何才能知道这种溶液的浓度呢?
2、知识架构:
(1)定义: 。
(2)计算公式: 。
3、练习:
(1)利用已知的数据进行计算。
食盐溶液 水 氯化钠 溶质的质量分数
100克 96克
200克 10克
150克 16%
100克 36克
(2)从一瓶氯化钾溶液中取出20克溶液,蒸干后得到2.8克氯化钾固体。试确定这瓶溶液中溶质的质量分数。
三、精讲补架
1、溶质的质量分数的变化判断:
(1)溶液加水稀释:溶质的质量 ,溶剂的质量 ,溶液的质量 ,溶质的质量分数 。
(2)溶液加溶质:
①对于不饱和溶液,溶质的质量 ,溶剂的质量 ,溶液的质量 ,溶质的质量分数 。
②对于饱和溶液,溶质的质量 ,溶剂的质量 ,溶液的质量 ,溶质的质量分数 。
2、溶质的质量分数与溶解度的区别和联系:
溶解度(S) 溶质的质量分数(w)
区别 条件
状态
计算公式
单位
联系
[例题1]已知40℃时氯化钾的溶解度是40g,计算40 ℃时氯化钾饱和溶液的溶质的质量分数?
四、达标巩固
1、某溶液加水稀释前后,溶液中保持不变的是 ( )
A.溶液中溶质的质量分数 B.溶液的质量 C.溶质的质量 D.溶剂的质量
2、现有ag某溶液,其中含溶剂bg,则此溶液的溶质的质量分数为 ( )
3、在一定温度下,从100gNaOH饱和溶液中倒出20g溶液,对于倒出的溶液。其数值不发生变化的是( )
A.溶质的质量分数 B.溶液的质量 C.溶质的质量 D.NaOH的溶解度
4、下列条件下的熟石灰溶液,溶质的质量分数最大的是( )
A.80℃的饱和溶液 B.20℃的饱和溶液
C.8O℃的不饱和溶液 D.20℃的不饱和溶液
5、向90 g 10%的硝酸钠溶液中加入 10 g硫酸钾并搅拌至完全溶解,则所得溶液中硝酸钠的溶质的质量分数是( )
A.19% B.10% C.9% D.无法计算
甲
乙
0 t1 t2 温度/℃
溶解度/g
80
同课章节目录
