鲁教版化学九年级下册 第七单元 第四节 酸碱中和反应课件(共21张PPT)
文档属性
| 名称 | 鲁教版化学九年级下册 第七单元 第四节 酸碱中和反应课件(共21张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 27.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-24 16:23:38 | ||
图片预览




文档简介
(共21张PPT)
第四节 酸碱中和反应
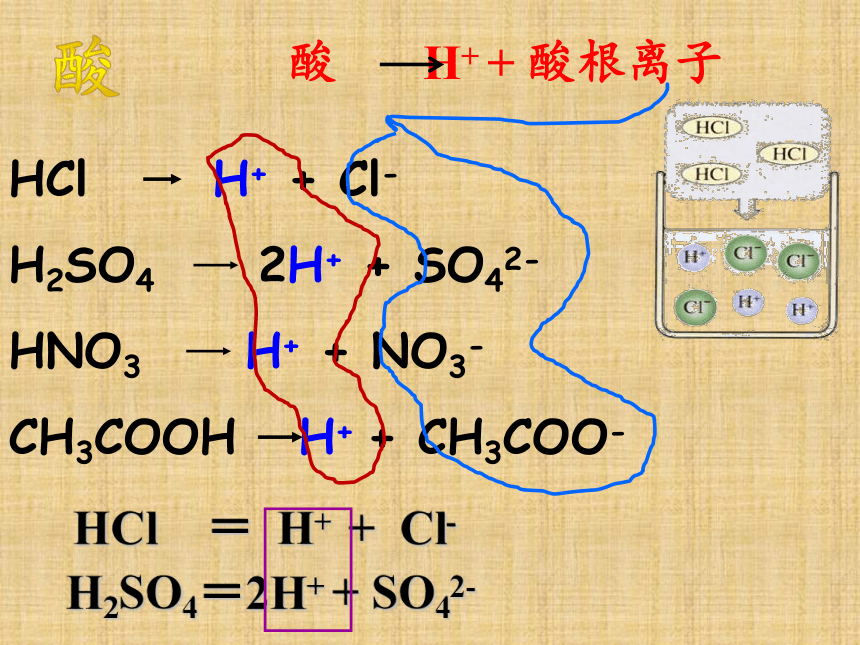
HCl H+ + Cl-
H2SO4 2H+ + SO42-
HNO3 H+ + NO3-
CH3COOH H+ + CH3COO-
HCl = H+ + Cl-
H2SO4=2H+ + SO42-
酸 H+ + 酸根离子
酸
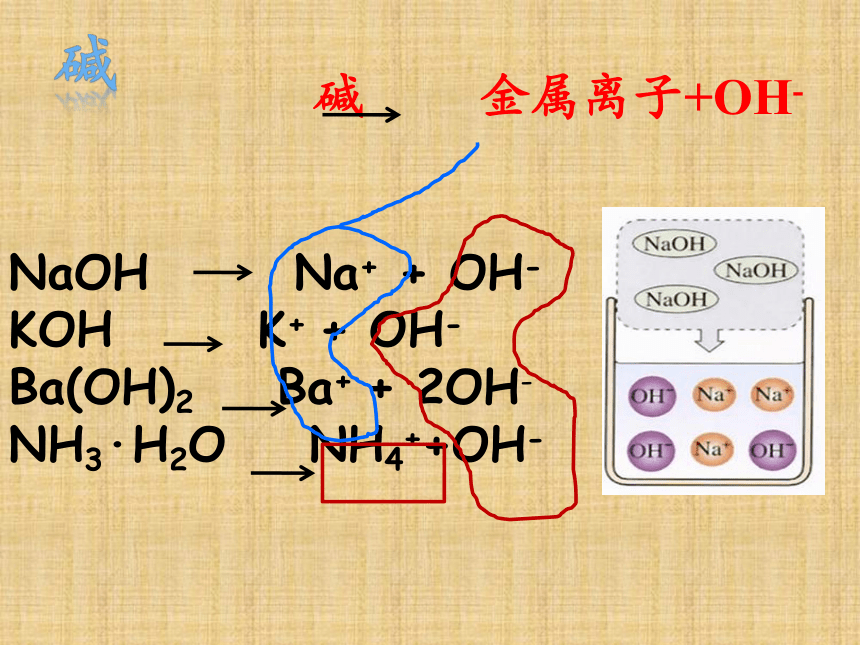
碱 金属离子+OH-
NaOH Na+ + OH-
KOH K+ + OH-
Ba(OH)2 Ba+ + 2OH-
NH3·H2O NH4++OH-
碱
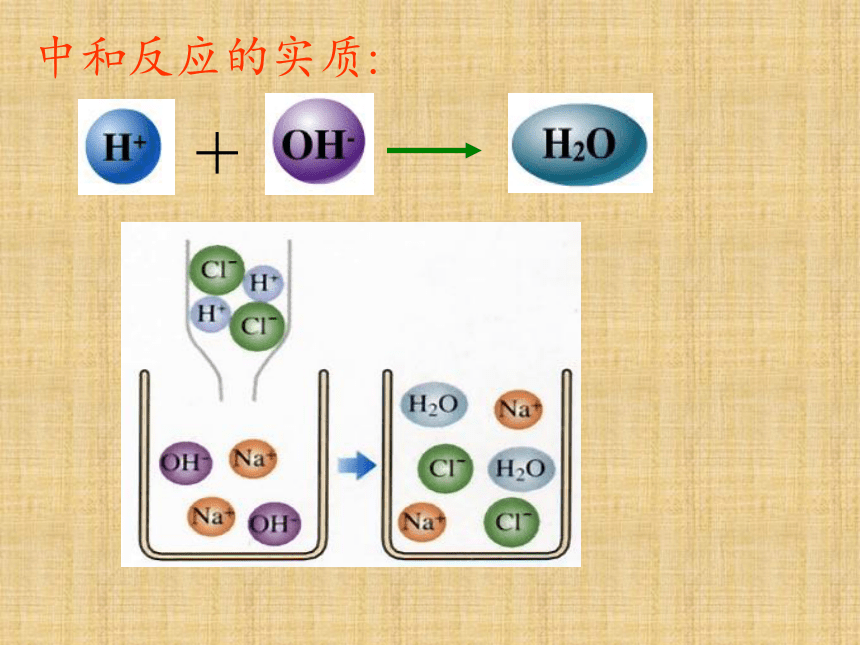
重新组合
HCl + NaOH
NaCl + H2O
微观世界
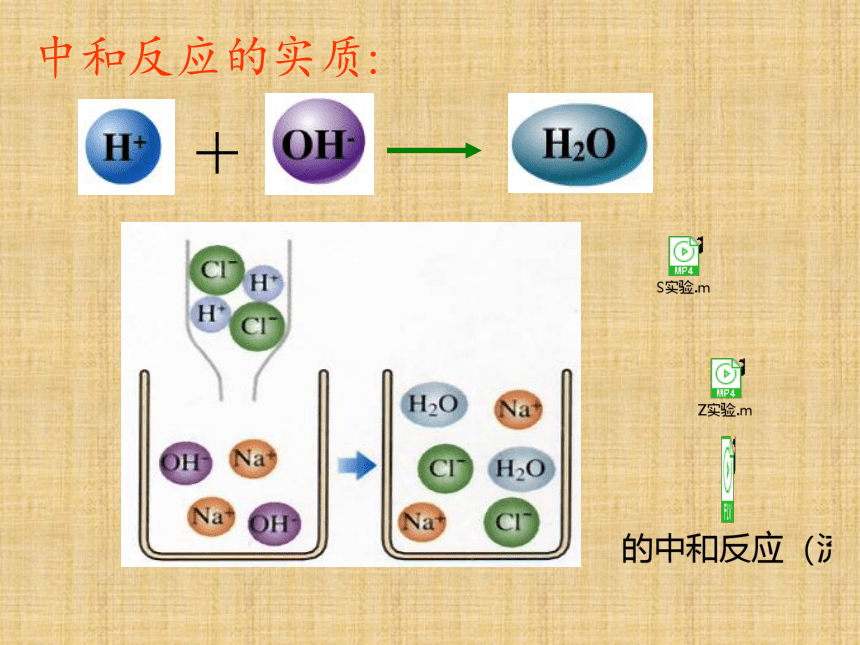
中和反应的实质:
+
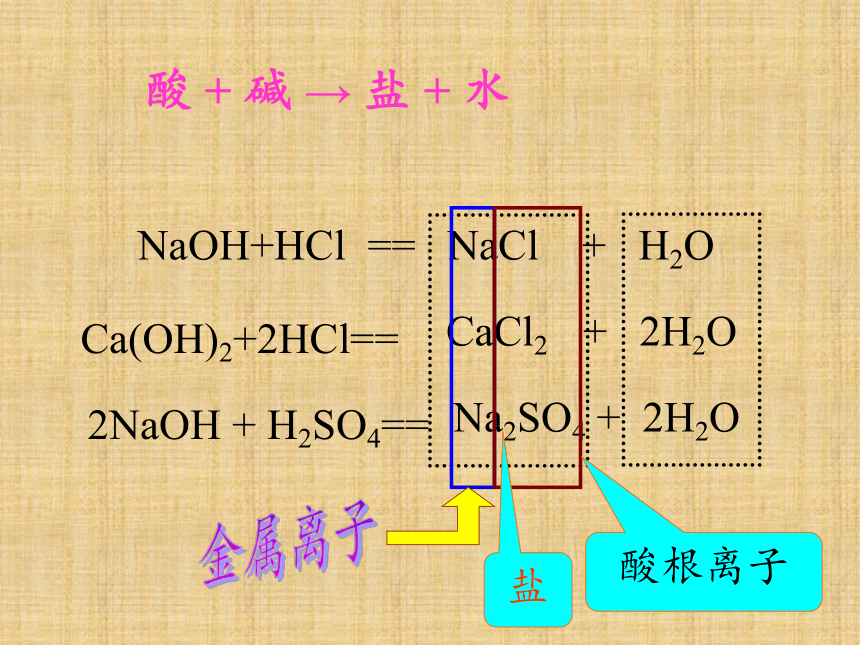
NaOH+HCl == NaCl + H2O
Ca(OH)2+2HCl==
CaCl2 + 2H2O
2NaOH + H2SO4==
Na2SO4 + 2H2O
金属离子
酸根离子
盐
酸 + 碱 → 盐 + 水
盐 金属离子(或NH4+)+酸根离子
NaCl Na+ + Cl-
Na2CO3 Na+ + CO32-
K2SO4 2K+ + SO42-
NH4NO3 NH4++NO3-
盐
中和反应的实质:
+
张扬扬同学做的盐酸和NaOH溶液
的中和反应实验,忘了向NaOH溶液中
滴加酚酞,请同学们推断反应后溶液中
的溶质可能是什么?
猜想一:NaCl
猜想三:NaCl、NaOH
猜想二:NaCl、HCl
猜想四: NaCl、NaOH、HCl
HCl + NaOH=NaCl+H2O
A
B
C
准备:仪器、药品及用品
仪器:烧杯、试管、镊子、
玻璃片
药品:待测液、酚酞、石蕊、
生锈的铁钉、大理石、锌粒
用品:PH试纸、抹布
酸
指
示
剂
金属
氧化物
碱
盐
金属
非金属
氧化物
盐
操作步骤 现象 分析及结论
方法一
方法二
1.实验室里有两瓶失去标签的无色溶液,分别是稀硫酸和澄清石灰水,请你用两种方法,加以鉴别,完成下表。
请你思考
2.实验桌上有下列七种物质:Zn、CuO、CO2、H2SO4、NaOH、BaCl2、CuSO4。他们分别属于什么类别的物质?
写出两两反应的化学方程式?
Zn、CuO、CO2、H2SO4、NaOH、BaCl2、CuSO4
H2SO4
我能尝试
3.某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动。以下是教学片段,请你参与学习并帮助填写空格。
【演示实验】将一定量的稀H2SO4加入到盛有
NaOH溶液的小烧杯中。
【学生板演】该反应的化学方程式 。
【提出问题】实验中未观察到明显现象,部分同
学产生了疑问:反应后溶液中的溶质是什么呢
NaOH溶液
稀H2SO4
【假设猜想】针对疑问,大家纷纷提出猜想。
甲组同学的猜想如下:
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH
猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种
猜想是不合理的。不合理的猜想是 。
NaOH溶液
稀H2SO4
H2SO4 +2NaOH= 2H2O+Na2SO4
【实验探究】(1)丙组同学取烧杯中的溶液少量于
试管中,滴加几滴CuSO4溶液,无明显变化,溶
液中一定没有 。
(2)为了验证其余猜想,各学习小组利用烧杯中的
溶液,并选用老师提供的pH试纸、铜片、BaC12
溶液、Na2CO3溶液,进行如下三个方案的探究。
NaOH溶液
稀H2SO4
我能尝试
【得出结论】通过探究,全班同学一致确定猜想
二(即有Na2SO4和H2SO4 )是正确的。
NaOH溶液
稀H2SO4
我能尝试
【评价反思】老师对同学们能用多种方法进行探究,并
且得出正确结论给予肯定。同时指出【实验探究】(2)中
存在两处明显错误,请大家反思。同学们经过反思发现
了这两处错误:
①实验操作中的错误是 。
②实验方案中也有一个是错误的,错误的原因是 。
我能尝试
4.下列各组物质通常借助指示剂才能证明是否反应的是( )
A.氢氧化铜和稀盐酸
B.石灰石和稀盐酸
C.氢氧化钠与硫酸铜反应
D.烧碱和稀硫酸
D
谢 谢
第四节 酸碱中和反应
HCl H+ + Cl-
H2SO4 2H+ + SO42-
HNO3 H+ + NO3-
CH3COOH H+ + CH3COO-
HCl = H+ + Cl-
H2SO4=2H+ + SO42-
酸 H+ + 酸根离子
酸
碱 金属离子+OH-
NaOH Na+ + OH-
KOH K+ + OH-
Ba(OH)2 Ba+ + 2OH-
NH3·H2O NH4++OH-
碱
重新组合
HCl + NaOH
NaCl + H2O
微观世界
中和反应的实质:
+
NaOH+HCl == NaCl + H2O
Ca(OH)2+2HCl==
CaCl2 + 2H2O
2NaOH + H2SO4==
Na2SO4 + 2H2O
金属离子
酸根离子
盐
酸 + 碱 → 盐 + 水
盐 金属离子(或NH4+)+酸根离子
NaCl Na+ + Cl-
Na2CO3 Na+ + CO32-
K2SO4 2K+ + SO42-
NH4NO3 NH4++NO3-
盐
中和反应的实质:
+
张扬扬同学做的盐酸和NaOH溶液
的中和反应实验,忘了向NaOH溶液中
滴加酚酞,请同学们推断反应后溶液中
的溶质可能是什么?
猜想一:NaCl
猜想三:NaCl、NaOH
猜想二:NaCl、HCl
猜想四: NaCl、NaOH、HCl
HCl + NaOH=NaCl+H2O
A
B
C
准备:仪器、药品及用品
仪器:烧杯、试管、镊子、
玻璃片
药品:待测液、酚酞、石蕊、
生锈的铁钉、大理石、锌粒
用品:PH试纸、抹布
酸
指
示
剂
金属
氧化物
碱
盐
金属
非金属
氧化物
盐
操作步骤 现象 分析及结论
方法一
方法二
1.实验室里有两瓶失去标签的无色溶液,分别是稀硫酸和澄清石灰水,请你用两种方法,加以鉴别,完成下表。
请你思考
2.实验桌上有下列七种物质:Zn、CuO、CO2、H2SO4、NaOH、BaCl2、CuSO4。他们分别属于什么类别的物质?
写出两两反应的化学方程式?
Zn、CuO、CO2、H2SO4、NaOH、BaCl2、CuSO4
H2SO4
我能尝试
3.某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动。以下是教学片段,请你参与学习并帮助填写空格。
【演示实验】将一定量的稀H2SO4加入到盛有
NaOH溶液的小烧杯中。
【学生板演】该反应的化学方程式 。
【提出问题】实验中未观察到明显现象,部分同
学产生了疑问:反应后溶液中的溶质是什么呢
NaOH溶液
稀H2SO4
【假设猜想】针对疑问,大家纷纷提出猜想。
甲组同学的猜想如下:
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH
猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种
猜想是不合理的。不合理的猜想是 。
NaOH溶液
稀H2SO4
H2SO4 +2NaOH= 2H2O+Na2SO4
【实验探究】(1)丙组同学取烧杯中的溶液少量于
试管中,滴加几滴CuSO4溶液,无明显变化,溶
液中一定没有 。
(2)为了验证其余猜想,各学习小组利用烧杯中的
溶液,并选用老师提供的pH试纸、铜片、BaC12
溶液、Na2CO3溶液,进行如下三个方案的探究。
NaOH溶液
稀H2SO4
我能尝试
【得出结论】通过探究,全班同学一致确定猜想
二(即有Na2SO4和H2SO4 )是正确的。
NaOH溶液
稀H2SO4
我能尝试
【评价反思】老师对同学们能用多种方法进行探究,并
且得出正确结论给予肯定。同时指出【实验探究】(2)中
存在两处明显错误,请大家反思。同学们经过反思发现
了这两处错误:
①实验操作中的错误是 。
②实验方案中也有一个是错误的,错误的原因是 。
我能尝试
4.下列各组物质通常借助指示剂才能证明是否反应的是( )
A.氢氧化铜和稀盐酸
B.石灰石和稀盐酸
C.氢氧化钠与硫酸铜反应
D.烧碱和稀硫酸
D
谢 谢
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
