粤教版化学九年级下册同步课时练习:8.4 第2课时 盐的化学性质 复分解反应发生的条件(word版有答案)
文档属性
| 名称 | 粤教版化学九年级下册同步课时练习:8.4 第2课时 盐的化学性质 复分解反应发生的条件(word版有答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 152.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-24 16:31:26 | ||
图片预览


文档简介
第2课时 盐的化学性质 复分解反应发生的条件
知识点 1 盐的化学性质
1.甲同学学习了常见的盐后,总结出盐能发生的化学反应如图示。请回答下列问题。
(1)某些盐能和酸反应,请写出:①有气体生成的反应的化学方程式:
;
②有沉淀生成的反应的化学方程式: 。
(2)某些盐能和某些碱反应,请写出:①生成氢氧化钠的反应的化学方程式:
;
②生成蓝色沉淀的反应的化学方程式: 。
(3)盐和盐能反应,生成两种新盐。将氯化钡溶液滴入碳酸钠溶液中,观察到的现象是
,反应的化学方程式为 。
(4)盐溶液能与金属反应,置换出另一种金属。写出铁与硫酸铜溶液反应的化学方程式:
。
2.将X溶液分别加入AgNO3溶液、Na2CO3溶液、Na2SO4溶液中,均有白色沉淀生成,则X可能是 ( )
A.BaCl2 B.HCl C.NaOH D.Ca(NO3)2
3.将下列试剂分别滴入Ca(OH)2、H2SO4、Na2SO4三种溶液中,会出现三种不同现象的是 ( )
A.Na2CO3溶液 B.MgCl2溶液 C.Ba(NO3)2溶液 D.酚酞溶液
知识点 2 判断复分解反应能否发生
4.下列关于复分解反应的说法一定正确的是 ( )
A.反应物为酸和碱 B.伴随有明显现象
C.生成物为盐和水 D.元素化合价不变
5.下列各组物质中,不能发生复分解反应的是( )
A.稀盐酸和氧化铜 B.碳酸钠溶液和稀硫酸
C.石灰水和碳酸钠溶液 D.氯化钾溶液和硫酸铜溶液
6.将下列物质混合,能发生复分解反应且现象不明显的是 ( )
A.澄清石灰水与硫酸铜溶液 B.氢氧化钠溶液与稀硫酸
C.稀盐酸与碳酸钠 D.硫酸钠溶液与氯化钡溶液
7.盐中含有金属离子(或N)和酸根离子,组成相似的盐具有一些相似的化学性质。
(1)硫酸铜、硝酸铜两种物质的溶液均显 色,因为它们都具有铜离子。向这两种物质的溶液中分别加入NaOH溶液,有相同的实验现象发生,写出其中一个反应的化学方程式:
。
(2)向硫酸铜、硝酸铜两种物质的溶液中分别加入氯化钡溶液,能与氯化钡溶液发生反应的物质是 (填化学式),另外一种物质不反应。
(3)向硫酸铜溶液中加入某纯净物的溶液,能同时将铜离子和硫酸根离子转变成沉淀,该纯净物的化学式为 。
8.下列对化学反应X+Na2CO32Y+CaCO3↓的分析错误的是 ( )
A.该反应属于复分解反应 B.Y中一定含有钠元素
C.X一定是熟石灰 D.X中阴离子的化合价是-1
9.现有Fe、Fe2O3、Na2CO3、Ca(OH)2、稀硫酸等五种物质,在常温下它们两两相互可以发生的化学反应有 ( )
A.7个 B.6个 C.5个 D.4个
10.下列四组物质,从左至右能发生化学反应的是(即a+b能反应,b+c能反应,c+d能反应)( )
序号 a b c d
① CO2 Ca(OH)2 HCl AgNO3
② Ba(NO3)2 K2CO3 NaCl FeCl3
③ CuO HCl NaOH Cu(NO3)2
④ CaCl2 H2SO4 MgSO4 Mg(OH)2
A.①③ B.①②③
C.①④ D.①②③④
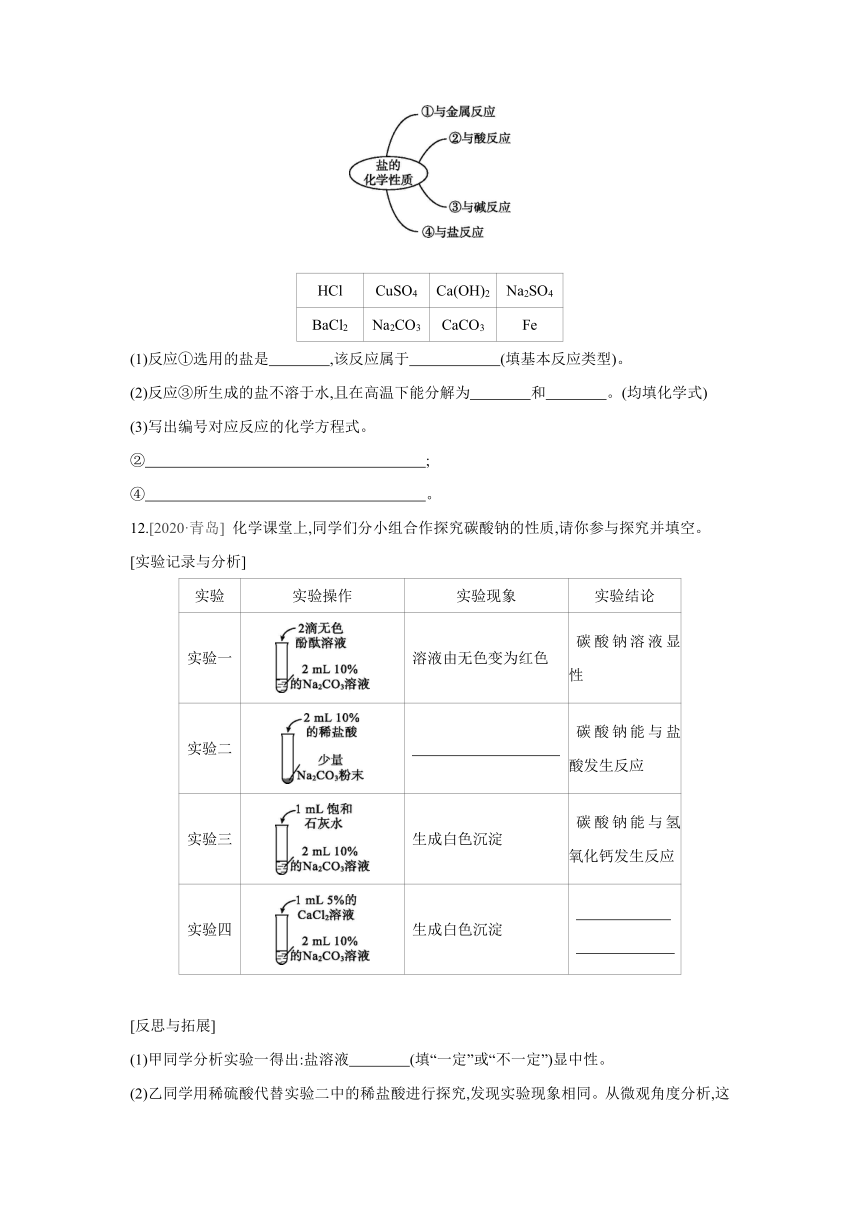
11.如图“盐的化学性质”思维导图。请根据图示,选择下表给出的物质完成填空。(每种物质只能选用一次)
HCl CuSO4 Ca(OH)2 Na2SO4
BaCl2 Na2CO3 CaCO3 Fe
(1)反应①选用的盐是 ,该反应属于 (填基本反应类型)。
(2)反应③所生成的盐不溶于水,且在高温下能分解为 和 。(均填化学式)
(3)写出编号对应反应的化学方程式。
② ;
④ 。
12.[2020·青岛] 化学课堂上,同学们分小组合作探究碳酸钠的性质,请你参与探究并填空。
[实验记录与分析]
实验 实验操作 实验现象 实验结论
实验一 溶液由无色变为红色 碳酸钠溶液显 性
实验二 碳酸钠能与盐酸发生反应
实验三 生成白色沉淀 碳酸钠能与氢氧化钙发生反应
实验四 生成白色沉淀
[反思与拓展]
(1)甲同学分析实验一得出:盐溶液 (填“一定”或“不一定”)显中性。
(2)乙同学用稀硫酸代替实验二中的稀盐酸进行探究,发现实验现象相同。从微观角度分析,这是因为稀盐酸和稀硫酸中都含有 。
(3)丙同学对比实验三和实验四的现象,从微观角度分析,两个反应的实质相同,溶液中相互结合的离子都是 。
13.[2020·山西] 农业生产上常用一定溶质质量分数的氯化钠溶液进行选种。实验小组取该溶液36 g,向其中滴加硝酸银溶液至不再产生沉淀为止,过滤、洗涤、干燥后,用电子秤称得沉淀质量为14.35 g。计算该氯化钠溶液中溶质的质量分数。
14.[2020·滨州] 下列各组离子在水中能大量共存且形成无色溶液的是 ( )
A.Fe2+ Na+ S Cl- B.K+ Na+ OH- N
C.Ba2+ Cl- S OH- D.H+ K+ N C
15.[2021·株洲] 下列选项中各溶质的溶液混合,无明显现象的是 ( )
A.NaCl、BaCl2、KNO3 B.CuSO4、NaOH、KCl
C.BaCl2、Na2SO4、HCl D.CaCl2、Na2CO3、KNO3
第2课时 盐的化学性质 复分解反应发生的条件
1.(1)①Na2CO3+2HCl2NaCl+H2O+CO2↑(合理即可)
②BaCl2+H2SO4BaSO4↓+2HCl(合理即可)
(2)①Na2CO3+Ca(OH)2CaCO3↓+2NaOH(合理即可)
②CuSO4+2NaOHCu(OH)2↓+Na2SO4(合理即可)
(3)有白色沉淀生成 BaCl2+Na2CO3BaCO3↓+2NaCl
(4)Fe+CuSO4FeSO4+Cu
2.A
3.A 将Na2CO3溶液分别滴入Ca(OH)2、H2SO4、Na2SO4三种溶液中,现象分别为产生白色沉淀、产生气泡、无明显现象;将MgCl2溶液分别滴入Ca(OH)2、H2SO4、Na2SO4三种溶液中,现象分别为产生白色沉淀、无明显现象、无明显现象; 将Ba(NO3)2溶液分别滴入Ca(OH)2、H2SO4、Na2SO4三种溶液中,现象分别为无明显现象、产生白色沉淀、产生白色沉淀;将酚酞溶液分别滴入Ca(OH)2、H2SO4、Na2SO4三种溶液中,现象分别为溶液变红、无明显现象、无明显现象。
4.D 碱和盐、酸和盐、酸和碱等物质之间均能发生复分解反应;有的复分解反应没有明显现象,如图稀盐酸和氢氧化钠溶液的反应;复分解反应的生成物不一定是盐和水,也可以是盐和碱等。
5.D KCl和CuSO4相互交换成分没有沉淀、气体或水生成,不能发生复分解反应。
6.B 澄清石灰水与硫酸铜溶液反应生成氢氧化铜蓝色沉淀和硫酸钙,稀盐酸与碳酸钠反应生成氯化钠、水和二氧化碳气体,硫酸钠溶液与氯化钡溶液交换成分生成硫酸钡白色沉淀和氯化钠,均能发生反应,且现象明显;氢氧化钠溶液与稀硫酸反应生成硫酸钠和水,能发生化学反应且现象不明显。
7.(1)蓝 CuSO4+2NaOHCu(OH)2↓+Na2SO4[或Cu(NO3)2+2NaOHCu(OH)2↓+ 2NaNO3]
(2)CuSO4
(3)Ba(OH)2
(1)硫酸铜和硝酸铜的溶液中都含有铜离子,故显蓝色。硝酸铜和氢氧化钠反应会生成氢氧化铜沉淀和硝酸钠,硫酸铜和氢氧化钠反应会生成氢氧化铜沉淀和硫酸钠。(2)向硫酸铜、硝酸铜两种物质的溶液中分别加入氯化钡溶液,若反应能发生,需要生成气体、沉淀或水,硝酸铜和氯化钡混合达不到上述条件,硫酸铜和氯化钡混合,会生成硫酸钡沉淀。(3)向硫酸铜溶液中加入某纯净物的溶液,能将铜离子转化为沉淀的离子为氢氧根离子或碳酸根离子,能将硫酸根离子转化为沉淀的是钡离子,综合分析,加入的溶液应是氢氧化钡溶液。
8.C
9.C 铁能与稀硫酸反应生成硫酸亚铁和氢气,氧化铁能与稀硫酸反应生成硫酸铁和水,碳酸钠能与稀硫酸反应生成硫酸钠、水和二氧化碳;氢氧化钙能与硫酸反应生成硫酸钙和水,碳酸钠能与氢氧化钙反应生成碳酸钙和氢氧化钠,共5个反应。
10.A ①中二氧化碳和氢氧化钙溶液反应生成碳酸钙沉淀和水,氢氧化钙溶液和盐酸反应生成氯化钙和水,盐酸和硝酸银溶液反应生成氯化银沉淀和硝酸;②中硝酸钡溶液和碳酸钾溶液反应生成碳酸钡沉淀和硝酸钾,碳酸钾溶液和氯化钠溶液不反应,氯化钠溶液和氯化铁溶液不反应;③中氧化铜和稀盐酸反应生成氯化铜和水,稀盐酸和氢氧化钠溶液反应生成氯化钠和水,氢氧化钠溶液和硝酸铜溶液反应生成氢氧化铜沉淀和硝酸钠;④中氯化钙溶液和硫酸不反应,硫酸和硫酸镁溶液不反应,硫酸镁溶液和氢氧化镁不反应。
11.(1)CuSO4 置换反应 (2)CaO CO2
(3)CaCO3+2HClCaCl2+H2O+CO2↑ BaCl2+Na2SO4BaSO4↓+2NaCl
12.[实验记录与分析] 碱 产生气泡 碳酸钠能和氯化钙发生反应
[反思与拓展] (1)不一定 (2)H+ (3)Ca2+和C
[实验记录与分析] 实验一碳酸钠溶液能使无色酚酞溶液变红,说明碳酸钠溶液显碱性;实验二盐酸和碳酸钠能反应生成二氧化碳气体,实验现象为产生气泡;实验四氯化钙溶液加入碳酸钠溶液中生成白色沉淀,说明碳酸钠能和氯化钙发生反应。[反思与拓展] (1)碳酸钠溶液为盐溶液,显碱性,说明盐溶液不一定显中性。(2)稀盐酸和稀硫酸都能电离出氢离子,属于酸,具有酸的通性,都能和碳酸钠反应生成二氧化碳。(3)实验三和实验四实质上都是溶液中的Ca2+和C相互结合生成白色碳酸钙沉淀的反应。
13.解:设该氯化钠溶液中溶质的质量为x。
NaCl+AgNO3AgCl↓+NaNO3
58.5 143.5
x 14.35 g
= x=5.85 g
该氯化钠溶液中溶质的质量分数为×100%=16.25%。
答:该氯化钠溶液中溶质的质量分数为16.25%。
14.B A中亚铁离子在水中显浅绿色;B中四种离子不能结合生成沉淀、气体或水,可以共存,且没有带颜色的离子;C中钡离子与硫酸根离子反应会生成不溶于水的硫酸钡沉淀;D中氢离子与碳酸根离子反应会产生二氧化碳气体。
15.A CuSO4和NaOH反应生成Cu(OH)2蓝色沉淀和Na2SO4;BaCl2和Na2SO4反应生成BaSO4白色沉淀和NaCl;CaCl2和Na2CO3反应生成CaCO3白色沉淀和NaCl。
知识点 1 盐的化学性质
1.甲同学学习了常见的盐后,总结出盐能发生的化学反应如图示。请回答下列问题。
(1)某些盐能和酸反应,请写出:①有气体生成的反应的化学方程式:
;
②有沉淀生成的反应的化学方程式: 。
(2)某些盐能和某些碱反应,请写出:①生成氢氧化钠的反应的化学方程式:
;
②生成蓝色沉淀的反应的化学方程式: 。
(3)盐和盐能反应,生成两种新盐。将氯化钡溶液滴入碳酸钠溶液中,观察到的现象是
,反应的化学方程式为 。
(4)盐溶液能与金属反应,置换出另一种金属。写出铁与硫酸铜溶液反应的化学方程式:
。
2.将X溶液分别加入AgNO3溶液、Na2CO3溶液、Na2SO4溶液中,均有白色沉淀生成,则X可能是 ( )
A.BaCl2 B.HCl C.NaOH D.Ca(NO3)2
3.将下列试剂分别滴入Ca(OH)2、H2SO4、Na2SO4三种溶液中,会出现三种不同现象的是 ( )
A.Na2CO3溶液 B.MgCl2溶液 C.Ba(NO3)2溶液 D.酚酞溶液
知识点 2 判断复分解反应能否发生
4.下列关于复分解反应的说法一定正确的是 ( )
A.反应物为酸和碱 B.伴随有明显现象
C.生成物为盐和水 D.元素化合价不变
5.下列各组物质中,不能发生复分解反应的是( )
A.稀盐酸和氧化铜 B.碳酸钠溶液和稀硫酸
C.石灰水和碳酸钠溶液 D.氯化钾溶液和硫酸铜溶液
6.将下列物质混合,能发生复分解反应且现象不明显的是 ( )
A.澄清石灰水与硫酸铜溶液 B.氢氧化钠溶液与稀硫酸
C.稀盐酸与碳酸钠 D.硫酸钠溶液与氯化钡溶液
7.盐中含有金属离子(或N)和酸根离子,组成相似的盐具有一些相似的化学性质。
(1)硫酸铜、硝酸铜两种物质的溶液均显 色,因为它们都具有铜离子。向这两种物质的溶液中分别加入NaOH溶液,有相同的实验现象发生,写出其中一个反应的化学方程式:
。
(2)向硫酸铜、硝酸铜两种物质的溶液中分别加入氯化钡溶液,能与氯化钡溶液发生反应的物质是 (填化学式),另外一种物质不反应。
(3)向硫酸铜溶液中加入某纯净物的溶液,能同时将铜离子和硫酸根离子转变成沉淀,该纯净物的化学式为 。
8.下列对化学反应X+Na2CO32Y+CaCO3↓的分析错误的是 ( )
A.该反应属于复分解反应 B.Y中一定含有钠元素
C.X一定是熟石灰 D.X中阴离子的化合价是-1
9.现有Fe、Fe2O3、Na2CO3、Ca(OH)2、稀硫酸等五种物质,在常温下它们两两相互可以发生的化学反应有 ( )
A.7个 B.6个 C.5个 D.4个
10.下列四组物质,从左至右能发生化学反应的是(即a+b能反应,b+c能反应,c+d能反应)( )
序号 a b c d
① CO2 Ca(OH)2 HCl AgNO3
② Ba(NO3)2 K2CO3 NaCl FeCl3
③ CuO HCl NaOH Cu(NO3)2
④ CaCl2 H2SO4 MgSO4 Mg(OH)2
A.①③ B.①②③
C.①④ D.①②③④
11.如图“盐的化学性质”思维导图。请根据图示,选择下表给出的物质完成填空。(每种物质只能选用一次)
HCl CuSO4 Ca(OH)2 Na2SO4
BaCl2 Na2CO3 CaCO3 Fe
(1)反应①选用的盐是 ,该反应属于 (填基本反应类型)。
(2)反应③所生成的盐不溶于水,且在高温下能分解为 和 。(均填化学式)
(3)写出编号对应反应的化学方程式。
② ;
④ 。
12.[2020·青岛] 化学课堂上,同学们分小组合作探究碳酸钠的性质,请你参与探究并填空。
[实验记录与分析]
实验 实验操作 实验现象 实验结论
实验一 溶液由无色变为红色 碳酸钠溶液显 性
实验二 碳酸钠能与盐酸发生反应
实验三 生成白色沉淀 碳酸钠能与氢氧化钙发生反应
实验四 生成白色沉淀
[反思与拓展]
(1)甲同学分析实验一得出:盐溶液 (填“一定”或“不一定”)显中性。
(2)乙同学用稀硫酸代替实验二中的稀盐酸进行探究,发现实验现象相同。从微观角度分析,这是因为稀盐酸和稀硫酸中都含有 。
(3)丙同学对比实验三和实验四的现象,从微观角度分析,两个反应的实质相同,溶液中相互结合的离子都是 。
13.[2020·山西] 农业生产上常用一定溶质质量分数的氯化钠溶液进行选种。实验小组取该溶液36 g,向其中滴加硝酸银溶液至不再产生沉淀为止,过滤、洗涤、干燥后,用电子秤称得沉淀质量为14.35 g。计算该氯化钠溶液中溶质的质量分数。
14.[2020·滨州] 下列各组离子在水中能大量共存且形成无色溶液的是 ( )
A.Fe2+ Na+ S Cl- B.K+ Na+ OH- N
C.Ba2+ Cl- S OH- D.H+ K+ N C
15.[2021·株洲] 下列选项中各溶质的溶液混合,无明显现象的是 ( )
A.NaCl、BaCl2、KNO3 B.CuSO4、NaOH、KCl
C.BaCl2、Na2SO4、HCl D.CaCl2、Na2CO3、KNO3
第2课时 盐的化学性质 复分解反应发生的条件
1.(1)①Na2CO3+2HCl2NaCl+H2O+CO2↑(合理即可)
②BaCl2+H2SO4BaSO4↓+2HCl(合理即可)
(2)①Na2CO3+Ca(OH)2CaCO3↓+2NaOH(合理即可)
②CuSO4+2NaOHCu(OH)2↓+Na2SO4(合理即可)
(3)有白色沉淀生成 BaCl2+Na2CO3BaCO3↓+2NaCl
(4)Fe+CuSO4FeSO4+Cu
2.A
3.A 将Na2CO3溶液分别滴入Ca(OH)2、H2SO4、Na2SO4三种溶液中,现象分别为产生白色沉淀、产生气泡、无明显现象;将MgCl2溶液分别滴入Ca(OH)2、H2SO4、Na2SO4三种溶液中,现象分别为产生白色沉淀、无明显现象、无明显现象; 将Ba(NO3)2溶液分别滴入Ca(OH)2、H2SO4、Na2SO4三种溶液中,现象分别为无明显现象、产生白色沉淀、产生白色沉淀;将酚酞溶液分别滴入Ca(OH)2、H2SO4、Na2SO4三种溶液中,现象分别为溶液变红、无明显现象、无明显现象。
4.D 碱和盐、酸和盐、酸和碱等物质之间均能发生复分解反应;有的复分解反应没有明显现象,如图稀盐酸和氢氧化钠溶液的反应;复分解反应的生成物不一定是盐和水,也可以是盐和碱等。
5.D KCl和CuSO4相互交换成分没有沉淀、气体或水生成,不能发生复分解反应。
6.B 澄清石灰水与硫酸铜溶液反应生成氢氧化铜蓝色沉淀和硫酸钙,稀盐酸与碳酸钠反应生成氯化钠、水和二氧化碳气体,硫酸钠溶液与氯化钡溶液交换成分生成硫酸钡白色沉淀和氯化钠,均能发生反应,且现象明显;氢氧化钠溶液与稀硫酸反应生成硫酸钠和水,能发生化学反应且现象不明显。
7.(1)蓝 CuSO4+2NaOHCu(OH)2↓+Na2SO4[或Cu(NO3)2+2NaOHCu(OH)2↓+ 2NaNO3]
(2)CuSO4
(3)Ba(OH)2
(1)硫酸铜和硝酸铜的溶液中都含有铜离子,故显蓝色。硝酸铜和氢氧化钠反应会生成氢氧化铜沉淀和硝酸钠,硫酸铜和氢氧化钠反应会生成氢氧化铜沉淀和硫酸钠。(2)向硫酸铜、硝酸铜两种物质的溶液中分别加入氯化钡溶液,若反应能发生,需要生成气体、沉淀或水,硝酸铜和氯化钡混合达不到上述条件,硫酸铜和氯化钡混合,会生成硫酸钡沉淀。(3)向硫酸铜溶液中加入某纯净物的溶液,能将铜离子转化为沉淀的离子为氢氧根离子或碳酸根离子,能将硫酸根离子转化为沉淀的是钡离子,综合分析,加入的溶液应是氢氧化钡溶液。
8.C
9.C 铁能与稀硫酸反应生成硫酸亚铁和氢气,氧化铁能与稀硫酸反应生成硫酸铁和水,碳酸钠能与稀硫酸反应生成硫酸钠、水和二氧化碳;氢氧化钙能与硫酸反应生成硫酸钙和水,碳酸钠能与氢氧化钙反应生成碳酸钙和氢氧化钠,共5个反应。
10.A ①中二氧化碳和氢氧化钙溶液反应生成碳酸钙沉淀和水,氢氧化钙溶液和盐酸反应生成氯化钙和水,盐酸和硝酸银溶液反应生成氯化银沉淀和硝酸;②中硝酸钡溶液和碳酸钾溶液反应生成碳酸钡沉淀和硝酸钾,碳酸钾溶液和氯化钠溶液不反应,氯化钠溶液和氯化铁溶液不反应;③中氧化铜和稀盐酸反应生成氯化铜和水,稀盐酸和氢氧化钠溶液反应生成氯化钠和水,氢氧化钠溶液和硝酸铜溶液反应生成氢氧化铜沉淀和硝酸钠;④中氯化钙溶液和硫酸不反应,硫酸和硫酸镁溶液不反应,硫酸镁溶液和氢氧化镁不反应。
11.(1)CuSO4 置换反应 (2)CaO CO2
(3)CaCO3+2HClCaCl2+H2O+CO2↑ BaCl2+Na2SO4BaSO4↓+2NaCl
12.[实验记录与分析] 碱 产生气泡 碳酸钠能和氯化钙发生反应
[反思与拓展] (1)不一定 (2)H+ (3)Ca2+和C
[实验记录与分析] 实验一碳酸钠溶液能使无色酚酞溶液变红,说明碳酸钠溶液显碱性;实验二盐酸和碳酸钠能反应生成二氧化碳气体,实验现象为产生气泡;实验四氯化钙溶液加入碳酸钠溶液中生成白色沉淀,说明碳酸钠能和氯化钙发生反应。[反思与拓展] (1)碳酸钠溶液为盐溶液,显碱性,说明盐溶液不一定显中性。(2)稀盐酸和稀硫酸都能电离出氢离子,属于酸,具有酸的通性,都能和碳酸钠反应生成二氧化碳。(3)实验三和实验四实质上都是溶液中的Ca2+和C相互结合生成白色碳酸钙沉淀的反应。
13.解:设该氯化钠溶液中溶质的质量为x。
NaCl+AgNO3AgCl↓+NaNO3
58.5 143.5
x 14.35 g
= x=5.85 g
该氯化钠溶液中溶质的质量分数为×100%=16.25%。
答:该氯化钠溶液中溶质的质量分数为16.25%。
14.B A中亚铁离子在水中显浅绿色;B中四种离子不能结合生成沉淀、气体或水,可以共存,且没有带颜色的离子;C中钡离子与硫酸根离子反应会生成不溶于水的硫酸钡沉淀;D中氢离子与碳酸根离子反应会产生二氧化碳气体。
15.A CuSO4和NaOH反应生成Cu(OH)2蓝色沉淀和Na2SO4;BaCl2和Na2SO4反应生成BaSO4白色沉淀和NaCl;CaCl2和Na2CO3反应生成CaCO3白色沉淀和NaCl。
