北京课改版化学九年级下册同步练习:第9章 溶液 单元测试(word含答案)
文档属性
| 名称 | 北京课改版化学九年级下册同步练习:第9章 溶液 单元测试(word含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 575.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-24 22:34:22 | ||
图片预览




文档简介
第9章自我综合评价
可能用到的相对原子质量:H-1 C-12 O-16 Na-23
第一部分 选择题(共25分)
每小题1分。在每小题给出的四个选项中,选出最符合题目要求的一项。
1.[2021·石景山期末改编] 下列物质中,属于溶液的是 ( )
A.牛奶 B.豆浆 C.冰水 D.矿泉水
2.将厨房中的白醋、白糖、食盐、花生油四种物质分别取少量于烧杯中,加入足量水充分搅拌,不能形成溶液的是 ( )
A.白醋 B.白糖 C.食盐 D.花生油
3.配制50 g溶质的质量分数为10%的葡萄糖溶液,不需要的仪器是 ( )
A.蒸发皿 B.玻璃棒 C.烧杯 D.量筒
4.杨刚同学自制汽水,可是家里没有冰箱,为了使自制的汽水变得冰凉可口,他想到可以购买一种物质来达到制冷效果,他应该购买的是 ( )
A.硝酸铵 B.蔗糖 C.氢氧化钠 D.食盐
5.下列溶液中溶剂不是水的是 ( )
A.硫酸铜溶液 B.碘酒溶液
C.硫酸钠溶液 D.高锰酸钾溶液
6.向图所示试管的水中加入一些固体氢氧化钠,完全溶解后,弯曲的玻璃管内液面的变化情况是 ( )
A.a 液面上升,b 液面下降
B.a 液面下降,b 液面上升
C.a、b 液面均无变化
D.条件不足,无法判断
7.从100 mL 溶质的质量分数为30% 的溶液中取出20 mL,取出的溶液中溶质的质量分数为( )
A.3% B.6% C.10% D.30%
8.下列有关溶液的说法错误的是 ( )
A.溶液一定是无色透明的
B.溶液由溶质和溶剂组成
C.溶质可以是固体、液体或气体
D.稀溶液也可能是饱和溶液
9.次氯酸钠(NaClO)是“84”消毒液的有效成分,其中氯元素的化合价为 ( )
A.+5 B.+3
C.+1 D.-1
10.将10 g硝酸钾完全溶解在100 g水中,下列说法不正确的是 ( )
A.溶质为10 g
B.溶剂为100 g
C.溶液为110 g
D.硝酸钾的溶解度为10 g
11.[2021·丰台期末改编] 下列说法不正确的是 ( )
A.水是常见的溶剂
B.溶液的特征就是混合物
C.溶质在溶解的过程中,有的放出热量,有的吸收热量
D.洗涤剂能使植物油在水中分散成大量细小的液滴,这种现象称为乳化
12.[2021·房山期末] 下列实验操作不能达到实验目的的是 ( )
选项 实验目的 实验操作
A 鉴别空气和氧气 伸入带火星的木条
B 鉴别硬水和软水 加入肥皂水
C 鉴别白糖水和蒸馏水 观察颜色
D 鉴别氢氧化钠和硝酸铵 加水溶解并测温度
13.下列各组物质,只用水就可以鉴别的是 ( )
A.固体:氯化钠、碳酸钙、高锰酸钾
B.气体:氢气、氧气、二氧化碳
C.液体:豆油、酒精、菜油
D.固体:硝酸钾、氯化钙、氯化镁
14.t ℃时,有一杯接近饱和的硝酸钾溶液,下列做法一定不能使其变为饱和溶液的是 ( )
A.恒温蒸发溶剂
B.降低溶液的温度
C.向溶液中加入硝酸钾晶体
D.向溶液中加入t ℃时硝酸钾的饱和溶液
15.20 ℃时,氯化钠的溶解度为36 g。对这句话理解错误的是 ( )
A.20 ℃时,100 g水中最多能溶解氯化钠36 g
B.20 ℃时,100 g氯化钠饱和溶液中含氯化钠36 g
C.20 ℃时,氯化钠饱和溶液中水与氯化钠的质量比为100∶36
D.20 ℃时,将36 g氯化钠溶解于100 g水中,所得溶液为该温度下氯化钠的饱和溶液
16.t ℃时,某物质的溶解度为10 g,在其饱和溶液中溶液、溶剂、溶质之间的质量比是( )
A.溶液∶溶质=10∶1 B.溶液∶溶剂=10∶11
C.溶剂∶溶质=11∶10 D.溶质∶溶剂=1∶10
17.图为氢氧化钙的溶解度曲线,下列说法不正确的是 ( )
A.氢氧化钙的溶解度随温度的升高而减小
B.30 ℃时,100 g水中最多溶解0.15 g氢氧化钙
C.将30 ℃时恰好饱和的石灰水升温到50 ℃时,溶质的质量分数不变
D.70 ℃时,饱和石灰水中溶质和溶剂的质量比为1∶1000
18.已知KCl的溶解度如下表所示。下列说法不正确的是( )
温度/℃ 10 20 30 40 50 60
溶解度/g 31.0 34.0 37.0 40.0 42.6 45.5
A.10 ℃时,100 g水中最多能溶解31.0 g KCl
B.20 ℃时,向100 g水中加入40 g KCl,充分搅拌,所得溶液质量为140 g
C.通过升高温度,能将30 ℃时恰好饱和的KCl溶液转化为不饱和溶液
D.50 ℃时,饱和KCl溶液中溶质的质量分数为×100%
依据实验和溶解度曲线回答19~22题。
20 ℃时,向100 g水中不断加入硝酸钾固体或改变温度,得到相应的溶液①~⑤。
19.①溶液中的溶质为 ( )
A.钾 B.硝酸 C.水 D.硝酸钾
20.③中溶液的质量为 ( )
A.60 g B.100 g C.160 g D.163.9 g
21.①~⑤所得溶液属于饱和溶液的是 ( )
A.②⑤ B.②③⑤ C.②④⑤ D.②③④⑤
22.⑤中溶质的质量分数的计算式为 ( )
A.×100% B. ×100%
C.×100% D.×100%
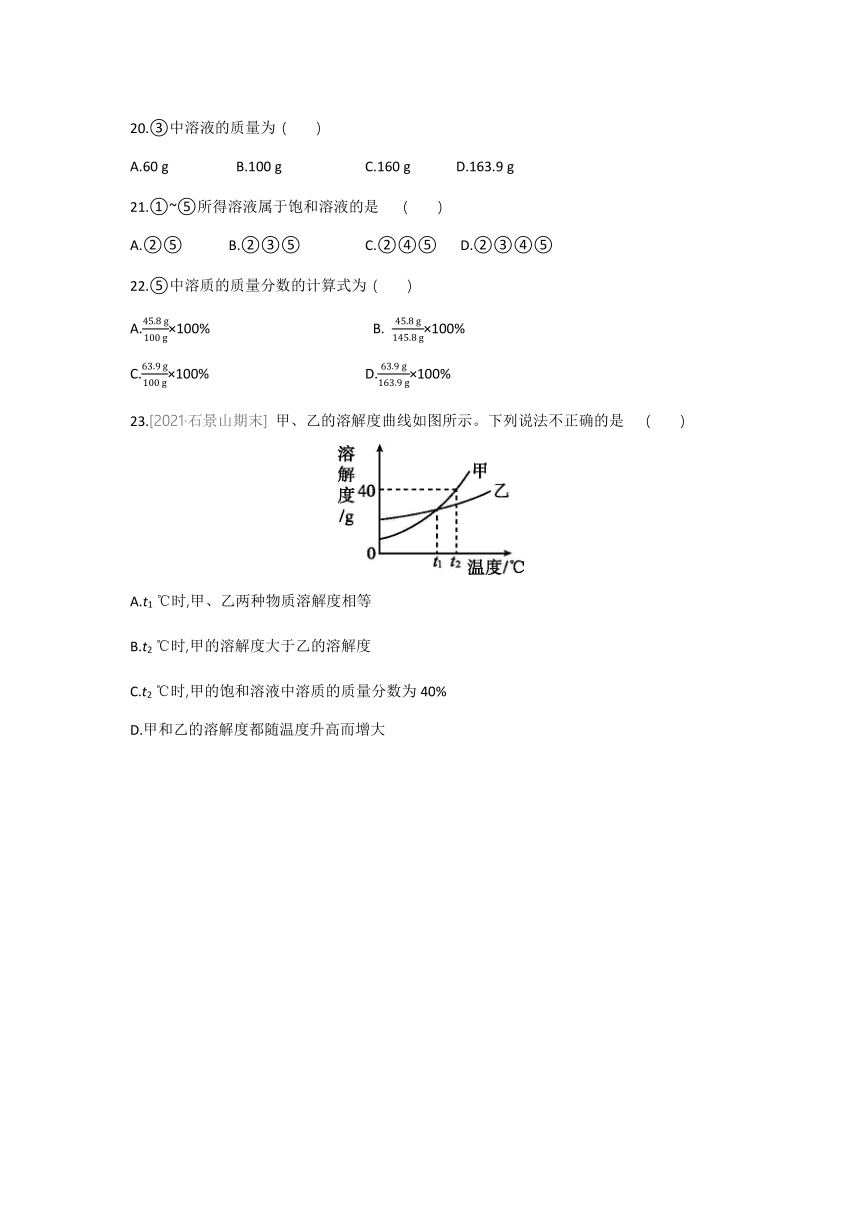
23.[2021·石景山期末] 甲、乙的溶解度曲线如图所示。下列说法不正确的是 ( )
A.t1 ℃时,甲、乙两种物质溶解度相等
B.t2 ℃时,甲的溶解度大于乙的溶解度
C.t2 ℃时,甲的饱和溶液中溶质的质量分数为40%
D.甲和乙的溶解度都随温度升高而增大
24.[2021·通州期末] 20 ℃时,取甲、乙、丙、丁四种纯净物各40 g,分别加入四个各盛有100 g水的烧杯中,充分溶解,其溶解情况如下表。下列说法正确的是 ( )
物质 甲 乙 丙 丁
未溶解固体的质量/g 8.4 4 0 18.4
A.所得四杯溶液一定都是饱和溶液
B.丁溶液的溶质质量分数最大
C.20 ℃时四种物质溶解度的关系:丁>甲>乙>丙
D.向四个烧杯中分别再加入100 g 20 ℃的水后,所得溶液质量相等
25.在20 ℃时,将等质量的a、b两种固体分别加入盛有100 g水的烧杯中,充分搅拌后现象如图甲,升温到50 ℃时,现象如图乙,a、b两种固体的溶解度曲线如图丙。下列说法正确的是 ( )
A.图甲两种溶液中溶质的质量分数a大于b
B.图丙中M表示b的溶解度曲线
C.图乙中a、b溶液一定都是不饱和溶液
D.本实验升温至30 ℃时a、b溶液的溶质质量分数不相等
第二部分 非选择题(共45分)
【生活现象解释】
26.(4分)生活中处处有化学。
(1)我们常用洗涤剂清洗餐具上的油污,这是利用了洗涤剂的 作用。
(2)生活中常用的降低水的硬度的方法是 ,此方法还能杀灭水中的一些病原微生物。
(3)医疗上,常需要配制0.9%的生理盐水,生理盐水中溶质为 。
(4)“氧来乐”是一种鱼池增氧剂,其主要成分为过氧化氢,“氧来乐”产生氧气的化学方程式为 。
27.(3分)图是利用海水提取粗盐的过程。
(1)图中①是 (填“蒸发”或“冷却”)池。
(2)在①中,海水中氯化钠的质量分数逐渐 (填“变大”或“变小”)。
(3)母液为氯化钠的 (填“饱和”或“不饱和”)溶液。
28.(3分)[2021·石景山期末] 小明进行家庭小实验,制作多晶冰糖。主要制作过程为:20 ℃时,取330 g蔗糖和100 g水,放入不锈钢容器中,加热并不断搅拌至液体温度达到120 ℃,盖上厚毛巾静置7天。
已知:20 ℃和100 ℃时,蔗糖的溶解度分别为203.9 g和487.2 g。
(1)蔗糖溶液中的溶质是 。
(2)20 ℃时,将330 g蔗糖和100 g水混合,得到的是 (填“饱和”或“不饱和”)溶液。
(3)加热后,溶液中溶质的质量分数会 (填“增大”或“减小”)。
29.(3分)开放性实践活动中,A、B、C三组同学将葵花子放入氯化钠溶液中浸泡12 h,捞出葵花子,沥干水分后,用烤炉烤熟,制得咸瓜子。已知:室温为20 ℃,在此温度下,氯化钠的溶解度为36 g。
咸瓜子配方表
组号 葵花子用量/g 食盐用量/g 水用量/g
A 25 25 100
B 25 40 100
C 25 50 100
(1)“捞出葵花子,沥干水分”过程中应用的实验操作是 。
(2)B、C两组同学炒制的瓜子咸度 (填“相同”或“不相同”),并说明理由: 。
【科普阅读理解】
30.(5分)[2021·石景山期末] 阅读下面科普短文。
水是包括人类在内所有生命生存所需的重要物质,也是生物体最重要的组成部分。全球水资源储量如图所示。
海水是宝贵的自然资源,目前世界上已知的100多种元素中,80多种可以在海水中找到,是名副其实的液体矿藏。海水的含盐量非常高,通过晾晒可得到食盐,我国目前利用海洋资源获取钾、镁、溴、氯、碘等元素已形成规模。
海水不能被直接使用,可以进行淡化处理,常用的海水淡化方法有蒸馏法和反渗透法。利用太阳能蒸馏淡化海水是一种节能的蒸馏法,其原理如图所示。反渗透法是一种利用膜分离技术淡化海水的方法,其原理如图0所示,对海水加压,水分子可以透过分离膜,而海水中的各种离子不能透过,从而得到淡水。
海水还是陆地淡水的来源之一和气候的调节器。人类在日常生活中所能使用的是淡水资源,淡水资源弥足珍贵,我国淡水资源人均占有量只相当于世界人均占有量的左右。节约是中华民族的传统美德,日常生活中,我们应大力倡导节约用水,树立节水意识,把节约水资源作为我们自觉的行动。
依据文章内容回答下列问题。
(1)根据文章,地球上水资源储量最多的是 。
(2)海水是宝贵的自然资源,原因是 。
(3)利用膜分离技术能得到淡水的原因是 。
(4)请你写出一条生活中节约用水的措施: 。
(5)下列说法正确的是 (填字母)。
A.海水中含有100多种元素
B.水变成水蒸气的过程,水分子本身发生改变
C.海水不仅是液体矿藏,还是陆地淡水的来源之一
D.从海水中可以获取食盐、淡水,以及含钾、镁、溴、氯、碘等元素的产品
【生产实际分析】
31.(3分)自来水生产过程如图1所示。回答下列问题。
(1)明矾[KAl(SO4)2·12H2O]中含有的金属元素是 (填元素符号)。
(2)清水池中盛放的清水属于 。
A.纯净物 B.单质 C.混合物 D.氧化物
(3)上述流程中起过滤作用的是 。
32.(3分)CO2形成的超临界CO2流体可用于从香兰草豆荚粉中提取香兰素(C8H8O3)。
(1)香兰素由 元素组成。
(2)由香兰素的乙醇溶液得到香兰素的过程中,发生的是 变化。
(3)以上提取香兰素的过程中,可循环使用的物质有 。
【基本实验及其原理分析】
33.(6分)配制一定溶质的质量分数的氯化钠溶液的过程如图3所示。
(1)配制50 g质量分数为15%的氯化钠溶液,所需氯化钠的质量为 g,水的质量为 g。
(2)溶解过程中玻璃棒的作用是 。
(3)对配制的溶液进行检测,发现溶质的质量分数偏小,其原因可能有 (填字母)。
A.称量时,药品与砝码放反了
B.量取水时,仰视读数
C.装瓶时,有少量溶液洒出
(4)把50 g溶质的质量分数为15%的氯化钠溶液稀释成5%的氯化钠溶液,需要水的质量是
g。
(5)配制好的溶质的质量分数为15%的氯化钠溶液中溶质和溶剂的质量比为 。
34.(2分)[2019·丰台二模] 为了研究物质的溶解现象,设计并进行了如下实验。
实验 ① ② ③
现象 固体完全溶解,形成紫色溶液 固体少量溶解,形成浅黄色溶液 固体完全溶解,形成棕色溶液
(1)设计实验①②的目的是 。
(2)依据实验②③的现象,可得出的结论是 。
35.(2分)[2019·北京] 如图4,下面是在一只烧杯中进行的实验,请补全实验方案。
A 验证KCl不能无限溶解 20 ℃时,①加入100 g水;②加入18 g KCl;③加入 (已知:20 ℃时,KCl的溶解度为34 g)
B 配制 ①加入2.5 g NaCl;②加入47.5 g水;③搅拌至全部溶解
36.(2分)[2019·朝阳二模] 根据下表中的数据和相关实验回答问题。
温度/℃ 溶解度/g 实验装置
NaOH Ca(OH)2
10 51 0.176
20 109 0.165
40 129 0.141
60 174 0.116
80 314 0.094
(1)实验A中的白色固体是 。
(2)通过实验B中溶液是否变浑浊来鉴别NaOH和Ca(OH)2两种饱和溶液的依据 。
【科学探究】
37.(6分)[2021·通州期末] 课堂上,老师将用水润湿的手帕在75%医用酒精中浸泡后点燃,酒精燃烧但是手帕安然无恙(如图5)。针对本实验,学生开展了以下探究活动。
[查阅资料] 滤纸的着火点约为130 ℃。
[进行实验]
步骤一:取不同质量的酒精与水混合。
实验编号 无水酒精质量/g 水质量/g
① 8 5
② 8 10
③ 8 15
④ 8 20
⑤ 8 30
步骤二:取滤纸,分别浸泡在步骤一所得①~⑤溶液中,用图6 Ⅰ所示装置测定酒精燃烧时滤纸的温度,将所得数据绘制成如图Ⅱ所示的曲线。
[实验记录]
实验编号 ① ② ③ ④ ⑤
现象 酒精和滤 纸都燃烧 酒精 燃烧 酒精 燃烧 酒精 燃烧 酒精不 燃烧
[解释与结论]
(1)75%医用酒精中的溶剂是 。
(2)步骤一的目的是 。
(3)实验①在20 s时温度突然上升的主要原因是
。
(4)实验③在 s时酒精燃尽,火焰熄灭。
(5)用滤纸做“烧不坏的手帕”实验,所用酒精溶液中溶质的质量分数范围大致是21.1%[反思与评价]
(6)图Ⅱ中实验⑤的曲线与其他4个实验的曲线比较后,你对物质燃烧条件的新认识是 。
【实际应用定量分析】
38.(3分)利用化学反应2Na+H22NaH可实现氢气的存储,计算230 g金属钠最多可吸收氢气的质量。
1.D 2.D 3.A 4.A 5.B 6.B 7.D
8.A 9.C 10.D 11.B 12.C 13.A
14.D 15.B 16.D 17.C 18.B 19.D 20.C 21.C 22.B 23.C 24.D 25.C
26.(1)乳化 (2)煮沸 (3)氯化钠
(4)2H2O2 2H2O+O2↑
27.(1)蒸发 (2)变大 (3)饱和
28.(1)蔗糖 (2)饱和 (3)增大
29.(1)过滤
(2)相同 B、C两组同学配制的氯化钠溶液均为室温下的饱和溶液,溶质的质量分数相同,浸泡时间相同,且所用葵花子的质量相等,故咸度相同
30.(1)海水
(2)目前世界上已知的100多种元素中,80多种可以在海水中找到
(3)对海水加压,水分子可以透过分离膜,而海水中的各种离子不能透过
(4)用淘米水浇花(合理即可)
(5)CD
31.(1)Al、K (2)C
(3)隔网、滤水池
32.(1)碳、氢、氧
(2)物理
(3)二氧化碳和无水乙醇
33.(1)7.5 42.5
(2)搅拌,加速溶解
(3)AB (4)100 (5)3∶17
34.(1)比较高锰酸钾和碘在水中的溶解情况(合理即可)
(2)碘在酒精中的溶解性比在水中好(合理即可)
35.A:20 g KCl固体(合理即可)
B:50 g溶质的质量分数为5%的氯化钠溶液
36.(1)NaOH
(2)氢氧化钠的溶解度随温度升高而增大,氢氧化钙的溶解度随温度升高而减小
37.(1)水
(2)配制不同浓度的酒精溶液
(3)滤纸的温度达到着火点后燃烧起来
(4)14(13~15均可)
(5)61.5
(6)可燃物的浓度需达到一定值(合理即可)
38.解:设最多可吸收氢气的质量为x。
2Na + H22NaH
46 2
230 g x
=
x=10 g
答:230 g金属钠最多可吸收氢气的质量为10 g。
可能用到的相对原子质量:H-1 C-12 O-16 Na-23
第一部分 选择题(共25分)
每小题1分。在每小题给出的四个选项中,选出最符合题目要求的一项。
1.[2021·石景山期末改编] 下列物质中,属于溶液的是 ( )
A.牛奶 B.豆浆 C.冰水 D.矿泉水
2.将厨房中的白醋、白糖、食盐、花生油四种物质分别取少量于烧杯中,加入足量水充分搅拌,不能形成溶液的是 ( )
A.白醋 B.白糖 C.食盐 D.花生油
3.配制50 g溶质的质量分数为10%的葡萄糖溶液,不需要的仪器是 ( )
A.蒸发皿 B.玻璃棒 C.烧杯 D.量筒
4.杨刚同学自制汽水,可是家里没有冰箱,为了使自制的汽水变得冰凉可口,他想到可以购买一种物质来达到制冷效果,他应该购买的是 ( )
A.硝酸铵 B.蔗糖 C.氢氧化钠 D.食盐
5.下列溶液中溶剂不是水的是 ( )
A.硫酸铜溶液 B.碘酒溶液
C.硫酸钠溶液 D.高锰酸钾溶液
6.向图所示试管的水中加入一些固体氢氧化钠,完全溶解后,弯曲的玻璃管内液面的变化情况是 ( )
A.a 液面上升,b 液面下降
B.a 液面下降,b 液面上升
C.a、b 液面均无变化
D.条件不足,无法判断
7.从100 mL 溶质的质量分数为30% 的溶液中取出20 mL,取出的溶液中溶质的质量分数为( )
A.3% B.6% C.10% D.30%
8.下列有关溶液的说法错误的是 ( )
A.溶液一定是无色透明的
B.溶液由溶质和溶剂组成
C.溶质可以是固体、液体或气体
D.稀溶液也可能是饱和溶液
9.次氯酸钠(NaClO)是“84”消毒液的有效成分,其中氯元素的化合价为 ( )
A.+5 B.+3
C.+1 D.-1
10.将10 g硝酸钾完全溶解在100 g水中,下列说法不正确的是 ( )
A.溶质为10 g
B.溶剂为100 g
C.溶液为110 g
D.硝酸钾的溶解度为10 g
11.[2021·丰台期末改编] 下列说法不正确的是 ( )
A.水是常见的溶剂
B.溶液的特征就是混合物
C.溶质在溶解的过程中,有的放出热量,有的吸收热量
D.洗涤剂能使植物油在水中分散成大量细小的液滴,这种现象称为乳化
12.[2021·房山期末] 下列实验操作不能达到实验目的的是 ( )
选项 实验目的 实验操作
A 鉴别空气和氧气 伸入带火星的木条
B 鉴别硬水和软水 加入肥皂水
C 鉴别白糖水和蒸馏水 观察颜色
D 鉴别氢氧化钠和硝酸铵 加水溶解并测温度
13.下列各组物质,只用水就可以鉴别的是 ( )
A.固体:氯化钠、碳酸钙、高锰酸钾
B.气体:氢气、氧气、二氧化碳
C.液体:豆油、酒精、菜油
D.固体:硝酸钾、氯化钙、氯化镁
14.t ℃时,有一杯接近饱和的硝酸钾溶液,下列做法一定不能使其变为饱和溶液的是 ( )
A.恒温蒸发溶剂
B.降低溶液的温度
C.向溶液中加入硝酸钾晶体
D.向溶液中加入t ℃时硝酸钾的饱和溶液
15.20 ℃时,氯化钠的溶解度为36 g。对这句话理解错误的是 ( )
A.20 ℃时,100 g水中最多能溶解氯化钠36 g
B.20 ℃时,100 g氯化钠饱和溶液中含氯化钠36 g
C.20 ℃时,氯化钠饱和溶液中水与氯化钠的质量比为100∶36
D.20 ℃时,将36 g氯化钠溶解于100 g水中,所得溶液为该温度下氯化钠的饱和溶液
16.t ℃时,某物质的溶解度为10 g,在其饱和溶液中溶液、溶剂、溶质之间的质量比是( )
A.溶液∶溶质=10∶1 B.溶液∶溶剂=10∶11
C.溶剂∶溶质=11∶10 D.溶质∶溶剂=1∶10
17.图为氢氧化钙的溶解度曲线,下列说法不正确的是 ( )
A.氢氧化钙的溶解度随温度的升高而减小
B.30 ℃时,100 g水中最多溶解0.15 g氢氧化钙
C.将30 ℃时恰好饱和的石灰水升温到50 ℃时,溶质的质量分数不变
D.70 ℃时,饱和石灰水中溶质和溶剂的质量比为1∶1000
18.已知KCl的溶解度如下表所示。下列说法不正确的是( )
温度/℃ 10 20 30 40 50 60
溶解度/g 31.0 34.0 37.0 40.0 42.6 45.5
A.10 ℃时,100 g水中最多能溶解31.0 g KCl
B.20 ℃时,向100 g水中加入40 g KCl,充分搅拌,所得溶液质量为140 g
C.通过升高温度,能将30 ℃时恰好饱和的KCl溶液转化为不饱和溶液
D.50 ℃时,饱和KCl溶液中溶质的质量分数为×100%
依据实验和溶解度曲线回答19~22题。
20 ℃时,向100 g水中不断加入硝酸钾固体或改变温度,得到相应的溶液①~⑤。
19.①溶液中的溶质为 ( )
A.钾 B.硝酸 C.水 D.硝酸钾
20.③中溶液的质量为 ( )
A.60 g B.100 g C.160 g D.163.9 g
21.①~⑤所得溶液属于饱和溶液的是 ( )
A.②⑤ B.②③⑤ C.②④⑤ D.②③④⑤
22.⑤中溶质的质量分数的计算式为 ( )
A.×100% B. ×100%
C.×100% D.×100%
23.[2021·石景山期末] 甲、乙的溶解度曲线如图所示。下列说法不正确的是 ( )
A.t1 ℃时,甲、乙两种物质溶解度相等
B.t2 ℃时,甲的溶解度大于乙的溶解度
C.t2 ℃时,甲的饱和溶液中溶质的质量分数为40%
D.甲和乙的溶解度都随温度升高而增大
24.[2021·通州期末] 20 ℃时,取甲、乙、丙、丁四种纯净物各40 g,分别加入四个各盛有100 g水的烧杯中,充分溶解,其溶解情况如下表。下列说法正确的是 ( )
物质 甲 乙 丙 丁
未溶解固体的质量/g 8.4 4 0 18.4
A.所得四杯溶液一定都是饱和溶液
B.丁溶液的溶质质量分数最大
C.20 ℃时四种物质溶解度的关系:丁>甲>乙>丙
D.向四个烧杯中分别再加入100 g 20 ℃的水后,所得溶液质量相等
25.在20 ℃时,将等质量的a、b两种固体分别加入盛有100 g水的烧杯中,充分搅拌后现象如图甲,升温到50 ℃时,现象如图乙,a、b两种固体的溶解度曲线如图丙。下列说法正确的是 ( )
A.图甲两种溶液中溶质的质量分数a大于b
B.图丙中M表示b的溶解度曲线
C.图乙中a、b溶液一定都是不饱和溶液
D.本实验升温至30 ℃时a、b溶液的溶质质量分数不相等
第二部分 非选择题(共45分)
【生活现象解释】
26.(4分)生活中处处有化学。
(1)我们常用洗涤剂清洗餐具上的油污,这是利用了洗涤剂的 作用。
(2)生活中常用的降低水的硬度的方法是 ,此方法还能杀灭水中的一些病原微生物。
(3)医疗上,常需要配制0.9%的生理盐水,生理盐水中溶质为 。
(4)“氧来乐”是一种鱼池增氧剂,其主要成分为过氧化氢,“氧来乐”产生氧气的化学方程式为 。
27.(3分)图是利用海水提取粗盐的过程。
(1)图中①是 (填“蒸发”或“冷却”)池。
(2)在①中,海水中氯化钠的质量分数逐渐 (填“变大”或“变小”)。
(3)母液为氯化钠的 (填“饱和”或“不饱和”)溶液。
28.(3分)[2021·石景山期末] 小明进行家庭小实验,制作多晶冰糖。主要制作过程为:20 ℃时,取330 g蔗糖和100 g水,放入不锈钢容器中,加热并不断搅拌至液体温度达到120 ℃,盖上厚毛巾静置7天。
已知:20 ℃和100 ℃时,蔗糖的溶解度分别为203.9 g和487.2 g。
(1)蔗糖溶液中的溶质是 。
(2)20 ℃时,将330 g蔗糖和100 g水混合,得到的是 (填“饱和”或“不饱和”)溶液。
(3)加热后,溶液中溶质的质量分数会 (填“增大”或“减小”)。
29.(3分)开放性实践活动中,A、B、C三组同学将葵花子放入氯化钠溶液中浸泡12 h,捞出葵花子,沥干水分后,用烤炉烤熟,制得咸瓜子。已知:室温为20 ℃,在此温度下,氯化钠的溶解度为36 g。
咸瓜子配方表
组号 葵花子用量/g 食盐用量/g 水用量/g
A 25 25 100
B 25 40 100
C 25 50 100
(1)“捞出葵花子,沥干水分”过程中应用的实验操作是 。
(2)B、C两组同学炒制的瓜子咸度 (填“相同”或“不相同”),并说明理由: 。
【科普阅读理解】
30.(5分)[2021·石景山期末] 阅读下面科普短文。
水是包括人类在内所有生命生存所需的重要物质,也是生物体最重要的组成部分。全球水资源储量如图所示。
海水是宝贵的自然资源,目前世界上已知的100多种元素中,80多种可以在海水中找到,是名副其实的液体矿藏。海水的含盐量非常高,通过晾晒可得到食盐,我国目前利用海洋资源获取钾、镁、溴、氯、碘等元素已形成规模。
海水不能被直接使用,可以进行淡化处理,常用的海水淡化方法有蒸馏法和反渗透法。利用太阳能蒸馏淡化海水是一种节能的蒸馏法,其原理如图所示。反渗透法是一种利用膜分离技术淡化海水的方法,其原理如图0所示,对海水加压,水分子可以透过分离膜,而海水中的各种离子不能透过,从而得到淡水。
海水还是陆地淡水的来源之一和气候的调节器。人类在日常生活中所能使用的是淡水资源,淡水资源弥足珍贵,我国淡水资源人均占有量只相当于世界人均占有量的左右。节约是中华民族的传统美德,日常生活中,我们应大力倡导节约用水,树立节水意识,把节约水资源作为我们自觉的行动。
依据文章内容回答下列问题。
(1)根据文章,地球上水资源储量最多的是 。
(2)海水是宝贵的自然资源,原因是 。
(3)利用膜分离技术能得到淡水的原因是 。
(4)请你写出一条生活中节约用水的措施: 。
(5)下列说法正确的是 (填字母)。
A.海水中含有100多种元素
B.水变成水蒸气的过程,水分子本身发生改变
C.海水不仅是液体矿藏,还是陆地淡水的来源之一
D.从海水中可以获取食盐、淡水,以及含钾、镁、溴、氯、碘等元素的产品
【生产实际分析】
31.(3分)自来水生产过程如图1所示。回答下列问题。
(1)明矾[KAl(SO4)2·12H2O]中含有的金属元素是 (填元素符号)。
(2)清水池中盛放的清水属于 。
A.纯净物 B.单质 C.混合物 D.氧化物
(3)上述流程中起过滤作用的是 。
32.(3分)CO2形成的超临界CO2流体可用于从香兰草豆荚粉中提取香兰素(C8H8O3)。
(1)香兰素由 元素组成。
(2)由香兰素的乙醇溶液得到香兰素的过程中,发生的是 变化。
(3)以上提取香兰素的过程中,可循环使用的物质有 。
【基本实验及其原理分析】
33.(6分)配制一定溶质的质量分数的氯化钠溶液的过程如图3所示。
(1)配制50 g质量分数为15%的氯化钠溶液,所需氯化钠的质量为 g,水的质量为 g。
(2)溶解过程中玻璃棒的作用是 。
(3)对配制的溶液进行检测,发现溶质的质量分数偏小,其原因可能有 (填字母)。
A.称量时,药品与砝码放反了
B.量取水时,仰视读数
C.装瓶时,有少量溶液洒出
(4)把50 g溶质的质量分数为15%的氯化钠溶液稀释成5%的氯化钠溶液,需要水的质量是
g。
(5)配制好的溶质的质量分数为15%的氯化钠溶液中溶质和溶剂的质量比为 。
34.(2分)[2019·丰台二模] 为了研究物质的溶解现象,设计并进行了如下实验。
实验 ① ② ③
现象 固体完全溶解,形成紫色溶液 固体少量溶解,形成浅黄色溶液 固体完全溶解,形成棕色溶液
(1)设计实验①②的目的是 。
(2)依据实验②③的现象,可得出的结论是 。
35.(2分)[2019·北京] 如图4,下面是在一只烧杯中进行的实验,请补全实验方案。
A 验证KCl不能无限溶解 20 ℃时,①加入100 g水;②加入18 g KCl;③加入 (已知:20 ℃时,KCl的溶解度为34 g)
B 配制 ①加入2.5 g NaCl;②加入47.5 g水;③搅拌至全部溶解
36.(2分)[2019·朝阳二模] 根据下表中的数据和相关实验回答问题。
温度/℃ 溶解度/g 实验装置
NaOH Ca(OH)2
10 51 0.176
20 109 0.165
40 129 0.141
60 174 0.116
80 314 0.094
(1)实验A中的白色固体是 。
(2)通过实验B中溶液是否变浑浊来鉴别NaOH和Ca(OH)2两种饱和溶液的依据 。
【科学探究】
37.(6分)[2021·通州期末] 课堂上,老师将用水润湿的手帕在75%医用酒精中浸泡后点燃,酒精燃烧但是手帕安然无恙(如图5)。针对本实验,学生开展了以下探究活动。
[查阅资料] 滤纸的着火点约为130 ℃。
[进行实验]
步骤一:取不同质量的酒精与水混合。
实验编号 无水酒精质量/g 水质量/g
① 8 5
② 8 10
③ 8 15
④ 8 20
⑤ 8 30
步骤二:取滤纸,分别浸泡在步骤一所得①~⑤溶液中,用图6 Ⅰ所示装置测定酒精燃烧时滤纸的温度,将所得数据绘制成如图Ⅱ所示的曲线。
[实验记录]
实验编号 ① ② ③ ④ ⑤
现象 酒精和滤 纸都燃烧 酒精 燃烧 酒精 燃烧 酒精 燃烧 酒精不 燃烧
[解释与结论]
(1)75%医用酒精中的溶剂是 。
(2)步骤一的目的是 。
(3)实验①在20 s时温度突然上升的主要原因是
。
(4)实验③在 s时酒精燃尽,火焰熄灭。
(5)用滤纸做“烧不坏的手帕”实验,所用酒精溶液中溶质的质量分数范围大致是21.1%
(6)图Ⅱ中实验⑤的曲线与其他4个实验的曲线比较后,你对物质燃烧条件的新认识是 。
【实际应用定量分析】
38.(3分)利用化学反应2Na+H22NaH可实现氢气的存储,计算230 g金属钠最多可吸收氢气的质量。
1.D 2.D 3.A 4.A 5.B 6.B 7.D
8.A 9.C 10.D 11.B 12.C 13.A
14.D 15.B 16.D 17.C 18.B 19.D 20.C 21.C 22.B 23.C 24.D 25.C
26.(1)乳化 (2)煮沸 (3)氯化钠
(4)2H2O2 2H2O+O2↑
27.(1)蒸发 (2)变大 (3)饱和
28.(1)蔗糖 (2)饱和 (3)增大
29.(1)过滤
(2)相同 B、C两组同学配制的氯化钠溶液均为室温下的饱和溶液,溶质的质量分数相同,浸泡时间相同,且所用葵花子的质量相等,故咸度相同
30.(1)海水
(2)目前世界上已知的100多种元素中,80多种可以在海水中找到
(3)对海水加压,水分子可以透过分离膜,而海水中的各种离子不能透过
(4)用淘米水浇花(合理即可)
(5)CD
31.(1)Al、K (2)C
(3)隔网、滤水池
32.(1)碳、氢、氧
(2)物理
(3)二氧化碳和无水乙醇
33.(1)7.5 42.5
(2)搅拌,加速溶解
(3)AB (4)100 (5)3∶17
34.(1)比较高锰酸钾和碘在水中的溶解情况(合理即可)
(2)碘在酒精中的溶解性比在水中好(合理即可)
35.A:20 g KCl固体(合理即可)
B:50 g溶质的质量分数为5%的氯化钠溶液
36.(1)NaOH
(2)氢氧化钠的溶解度随温度升高而增大,氢氧化钙的溶解度随温度升高而减小
37.(1)水
(2)配制不同浓度的酒精溶液
(3)滤纸的温度达到着火点后燃烧起来
(4)14(13~15均可)
(5)61.5
(6)可燃物的浓度需达到一定值(合理即可)
38.解:设最多可吸收氢气的质量为x。
2Na + H22NaH
46 2
230 g x
=
x=10 g
答:230 g金属钠最多可吸收氢气的质量为10 g。
