沪教版(全国)化学九年级上册同步课时练习:第5章 第1节 第1课时 金属的性质(word版有答案)
文档属性
| 名称 | 沪教版(全国)化学九年级上册同步课时练习:第5章 第1节 第1课时 金属的性质(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 151.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-26 07:04:55 | ||
图片预览


文档简介
第5章 金属的冶炼与利用
第1节 金属的性质和利用
第1课时 金属的性质
知识点 1 金属的物理性质和用途
1.通常状况下,颜色呈紫红色的金属是 ( )
A.铁 B.银 C.铜 D.铝
2.金属材料在人类生产活动中已得到越来越广泛的应用。下列性质属于金属共性的是( )
A.硬度很大、熔点很高
B.有良好的导电性、导热性
C.是银白色的固体
D.延展性差
3.下列有关金属的说法中,错误的是 ( )
A.铜制插头是利用铜的导电性
B.钨制灯丝是利用钨的熔点低
C.铝制成铝箔是利用铝的延展性
D.用铁锅炒菜是利用铁的导热性
知识点 2 金属的化学性质
4.常见的四种金属:铝、铜、铁、锌,它们具有的相同化学性质是 ( )
A.良好的延展性
B.在一定条件下跟氧气反应
C.良好的导电性
D.能跟盐酸反应
5.下列是日常生活中常见的金属,其中金属活动性最强的是 ( )
A.Fe B.Cu C.Al D.Zn
6.化学是一门以实验为基础的科学,下列有关实验现象的描述中正确的是 ( )
A.铁丝在空气中剧烈燃烧,发出耀眼的白光
B.在空气中加热铜丝,可以观察到其表面变黑
C.将镁条放入稀盐酸中,观察到固体逐渐溶解,产生大量氢气
D.将铁钉放入硫酸铜溶液中,观察到固体全部溶解,得到浅绿色溶液
7.铝、铁、铜是人类广泛使用的三种金属。与我们的生活息息相关。
(1)人类开始使用这三种金属的先后排序为 (用元素符号表示)。
(2)在其他条件相同时,这三种金属与5 mL浓度相同的盐酸反应,速率最快的是 。
(3)放在稀硫酸中有气泡产生,且溶液逐渐变为浅绿色的是 ,该反应的化学方程式是 。
(4)以上三种金属中,能与硫酸铜溶液发生置换反应的是 (填金属名称)。
知识点 3 置换反应
8.下列反应属于置换反应的是 ( )
A.C+O2CO2
B.CaCO3CaO+CO2↑
C.NaOH+HClNaCl+H2O
D.2Al+Fe2O3Al2O3+2Fe
9.如图中国人民银行为纪念改革开放40周年而发行的纪念币。在选择铸造纪念币的材料时,不需要考虑的因素是( )
A.金属的硬度
B.金属的耐腐蚀性
C.金属的导电性
D.金属的价值
10.下列物质中,不能用金属和稀酸直接反应得到的是 ( )
A.氯化镁 B.硫酸铝 C.氯化锌 D.硫酸铁
11.铝在工业和生活中应用广泛。
(1)铝是地壳中含量最高的 (填“金属”或“非金属”)元素,其年产量已跃居第二位。
(2)铝可制成电线,主要是利用其有良好的延展性和 性。
(3)铝的化学性质比较活泼,在空气中比铁更容易氧化,但铝制品比铁制品经久耐用,其主要原因是 。
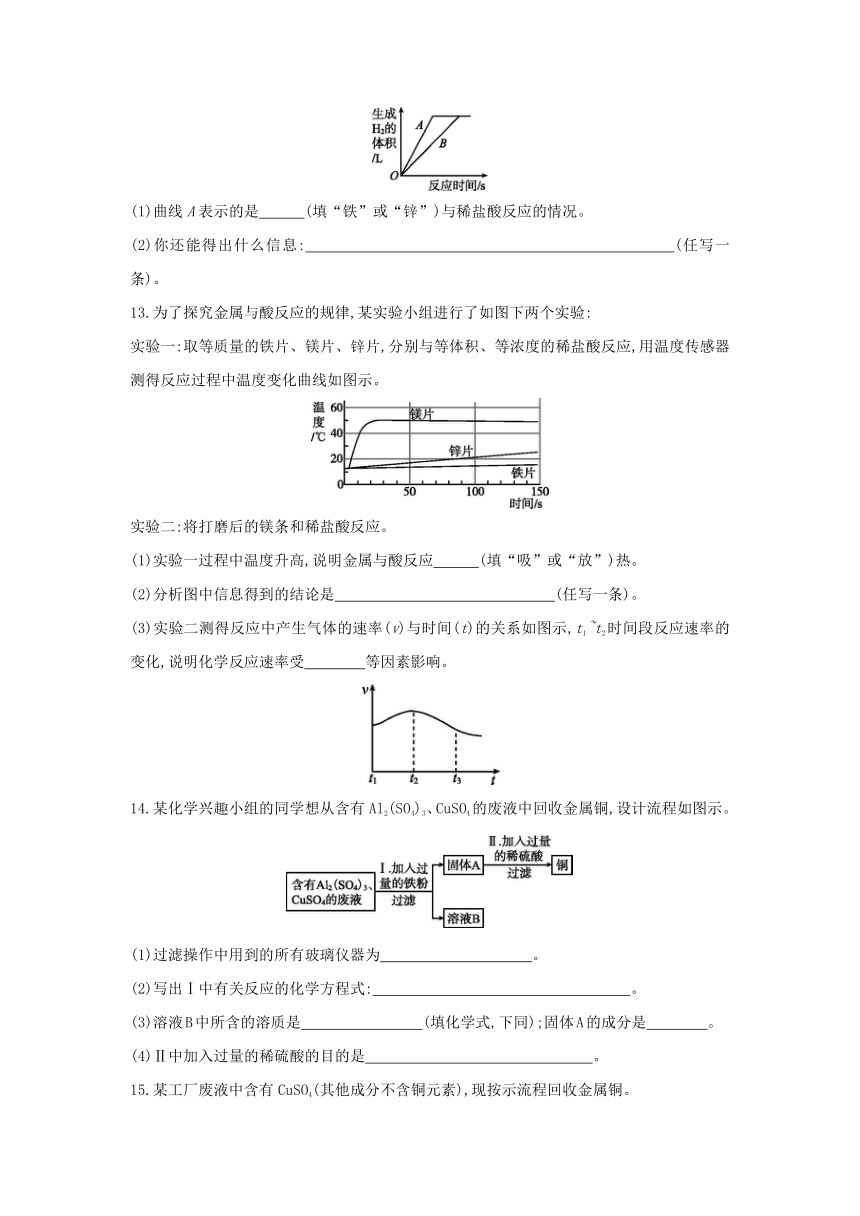
12.某研究小组将足量的铁和锌两种金属同时分别放入两份质量分数相同的少量稀盐酸中,根据实验现象,反应生成H2的体积(气体体积都在相同状况下测定)与反应时间的关系如图示,根据图中信息,请回答:
(1)曲线A表示的是 (填“铁”或“锌”)与稀盐酸反应的情况。
(2)你还能得出什么信息: (任写一条)。
13.为了探究金属与酸反应的规律,某实验小组进行了如图下两个实验:
实验一:取等质量的铁片、镁片、锌片,分别与等体积、等浓度的稀盐酸反应,用温度传感器测得反应过程中温度变化曲线如图示。
实验二:将打磨后的镁条和稀盐酸反应。
(1)实验一过程中温度升高,说明金属与酸反应 (填“吸”或“放”)热。
(2)分析图中信息得到的结论是 (任写一条)。
(3)实验二测得反应中产生气体的速率(v)与时间(t)的关系如图示,t1~t2时间段反应速率的变化,说明化学反应速率受 等因素影响。
14.某化学兴趣小组的同学想从含有Al2(SO4)3、CuSO4的废液中回收金属铜,设计流程如图示。
(1)过滤操作中用到的所有玻璃仪器为 。
(2)写出Ⅰ中有关反应的化学方程式: 。
(3)溶液B中所含的溶质是 (填化学式,下同);固体A的成分是 。
(4)Ⅱ中加入过量的稀硫酸的目的是 。
15.某工厂废液中含有CuSO4(其他成分不含铜元素),现按示流程回收金属铜。
(1)回收过程中,加入适量稀硫酸可除去过量的铁屑,该反应的化学方程式为Fe+H2SO4FeSO4+H2↑,这个反应所属的基本反应类型是 。
(2)洗涤后的滤渣不能用加热的方法干燥,其原因是 。
(3)现有一批废液,其中含4 t CuSO4,理论上可从该废液中回收得到多少吨金属铜
16.[2020·南京] 下列金属中,熔点最高的是 ( )
A.铜 B.汞 C.钨 D.铝
17.[2020·滨州] 现有质量相等的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图示(已知甲、乙、丙在生成物中均显+2价)。则下列说法错误的是 ( )
A.完全反应所需时间:丙>甲>乙
B.生成氢气的质量:甲>乙>丙
C.相对原子质量:乙>丙>甲
D.消耗硫酸的质量:甲>乙>丙
答案
1.C 铁、银、铝呈银白色,铜呈紫红色。
2.B 金属具有的共性有常温下大多数金属是固体,有金属光泽,有良好的导电性、导热性、延展性等。
3.B
4.B 导电性和延展性属于物理性质,铜不能跟盐酸反应。
5.C
6.B 铁丝在空气中不能燃烧,镁条在空气中燃烧发出耀眼的白光;将镁条放入稀盐酸中,能观察到固体逐渐溶解,产生气泡,现象描述中不能出现物质名称;将铁钉放入硫酸铜溶液中,观察到铁钉表面出现红色固体,溶液由蓝色变为浅绿色,而不是固体全部溶解。
7.(1)Cu、Fe、Al
(2)铝(或Al)
(3)铁(或Fe) Fe+H2SO4FeSO4+H2↑
(4)铝、铁
8.D
9.C 根据纪念币的流通特点可知:铸造出的纪念币要有较强的耐腐蚀性、硬度较大且硬币价值与面值的吻合度要接近,而金属的导电性、导热性等不是铸造纪念币时需要考虑的因素。
10.D 铁与稀硫酸反应生成的是硫酸亚铁,不是硫酸铁,硫酸铁不能用金属与稀酸反应直接得到。
11.(1)金属 (2)导电
(3)在常温下,铝与空气中的氧气反应,在表面生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化
12.(1)锌
(2)反应结束后,产生氢气的体积相等(合理即可)
13.(1)放 (2)相同条件下,金属越活泼,与酸反应放出的热量越多(合理即可)
(3)温度
14.(1)漏斗、玻璃棒、烧杯
(2)Fe+CuSO4FeSO4+Cu
(3)Al2(SO4)3、FeSO4 Cu、Fe
(4)将铜铁混合物中的铁完全除去
15.(1)置换反应
(2)加热条件下,铜与氧气反应,生成新物质氧化铜,导致回收的铜不纯
(3)解:设理论上可从该废液中回收得到的金属铜的质量为x。
Fe+CuSO4FeSO4+Cu
160 64
4 t x
= x=1.6 t
答:理论上可从该废液中回收得到1.6 t金属铜。
16.C
17.C 由图中信息可知,完全反应所需时间:丙>甲>乙;生成氢气的质量:甲>乙>丙;甲、乙、丙在生成物中均显+2价,稀硫酸足量,相对原子质量越大,生成的氢气质量越小,因此相对原子质量:丙>乙>甲;生成的氢气中氢元素完全来自硫酸,因此生成氢气质量越大,消耗硫酸质量越大,因此消耗硫酸的质量:甲>乙>丙。
第1节 金属的性质和利用
第1课时 金属的性质
知识点 1 金属的物理性质和用途
1.通常状况下,颜色呈紫红色的金属是 ( )
A.铁 B.银 C.铜 D.铝
2.金属材料在人类生产活动中已得到越来越广泛的应用。下列性质属于金属共性的是( )
A.硬度很大、熔点很高
B.有良好的导电性、导热性
C.是银白色的固体
D.延展性差
3.下列有关金属的说法中,错误的是 ( )
A.铜制插头是利用铜的导电性
B.钨制灯丝是利用钨的熔点低
C.铝制成铝箔是利用铝的延展性
D.用铁锅炒菜是利用铁的导热性
知识点 2 金属的化学性质
4.常见的四种金属:铝、铜、铁、锌,它们具有的相同化学性质是 ( )
A.良好的延展性
B.在一定条件下跟氧气反应
C.良好的导电性
D.能跟盐酸反应
5.下列是日常生活中常见的金属,其中金属活动性最强的是 ( )
A.Fe B.Cu C.Al D.Zn
6.化学是一门以实验为基础的科学,下列有关实验现象的描述中正确的是 ( )
A.铁丝在空气中剧烈燃烧,发出耀眼的白光
B.在空气中加热铜丝,可以观察到其表面变黑
C.将镁条放入稀盐酸中,观察到固体逐渐溶解,产生大量氢气
D.将铁钉放入硫酸铜溶液中,观察到固体全部溶解,得到浅绿色溶液
7.铝、铁、铜是人类广泛使用的三种金属。与我们的生活息息相关。
(1)人类开始使用这三种金属的先后排序为 (用元素符号表示)。
(2)在其他条件相同时,这三种金属与5 mL浓度相同的盐酸反应,速率最快的是 。
(3)放在稀硫酸中有气泡产生,且溶液逐渐变为浅绿色的是 ,该反应的化学方程式是 。
(4)以上三种金属中,能与硫酸铜溶液发生置换反应的是 (填金属名称)。
知识点 3 置换反应
8.下列反应属于置换反应的是 ( )
A.C+O2CO2
B.CaCO3CaO+CO2↑
C.NaOH+HClNaCl+H2O
D.2Al+Fe2O3Al2O3+2Fe
9.如图中国人民银行为纪念改革开放40周年而发行的纪念币。在选择铸造纪念币的材料时,不需要考虑的因素是( )
A.金属的硬度
B.金属的耐腐蚀性
C.金属的导电性
D.金属的价值
10.下列物质中,不能用金属和稀酸直接反应得到的是 ( )
A.氯化镁 B.硫酸铝 C.氯化锌 D.硫酸铁
11.铝在工业和生活中应用广泛。
(1)铝是地壳中含量最高的 (填“金属”或“非金属”)元素,其年产量已跃居第二位。
(2)铝可制成电线,主要是利用其有良好的延展性和 性。
(3)铝的化学性质比较活泼,在空气中比铁更容易氧化,但铝制品比铁制品经久耐用,其主要原因是 。
12.某研究小组将足量的铁和锌两种金属同时分别放入两份质量分数相同的少量稀盐酸中,根据实验现象,反应生成H2的体积(气体体积都在相同状况下测定)与反应时间的关系如图示,根据图中信息,请回答:
(1)曲线A表示的是 (填“铁”或“锌”)与稀盐酸反应的情况。
(2)你还能得出什么信息: (任写一条)。
13.为了探究金属与酸反应的规律,某实验小组进行了如图下两个实验:
实验一:取等质量的铁片、镁片、锌片,分别与等体积、等浓度的稀盐酸反应,用温度传感器测得反应过程中温度变化曲线如图示。
实验二:将打磨后的镁条和稀盐酸反应。
(1)实验一过程中温度升高,说明金属与酸反应 (填“吸”或“放”)热。
(2)分析图中信息得到的结论是 (任写一条)。
(3)实验二测得反应中产生气体的速率(v)与时间(t)的关系如图示,t1~t2时间段反应速率的变化,说明化学反应速率受 等因素影响。
14.某化学兴趣小组的同学想从含有Al2(SO4)3、CuSO4的废液中回收金属铜,设计流程如图示。
(1)过滤操作中用到的所有玻璃仪器为 。
(2)写出Ⅰ中有关反应的化学方程式: 。
(3)溶液B中所含的溶质是 (填化学式,下同);固体A的成分是 。
(4)Ⅱ中加入过量的稀硫酸的目的是 。
15.某工厂废液中含有CuSO4(其他成分不含铜元素),现按示流程回收金属铜。
(1)回收过程中,加入适量稀硫酸可除去过量的铁屑,该反应的化学方程式为Fe+H2SO4FeSO4+H2↑,这个反应所属的基本反应类型是 。
(2)洗涤后的滤渣不能用加热的方法干燥,其原因是 。
(3)现有一批废液,其中含4 t CuSO4,理论上可从该废液中回收得到多少吨金属铜
16.[2020·南京] 下列金属中,熔点最高的是 ( )
A.铜 B.汞 C.钨 D.铝
17.[2020·滨州] 现有质量相等的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图示(已知甲、乙、丙在生成物中均显+2价)。则下列说法错误的是 ( )
A.完全反应所需时间:丙>甲>乙
B.生成氢气的质量:甲>乙>丙
C.相对原子质量:乙>丙>甲
D.消耗硫酸的质量:甲>乙>丙
答案
1.C 铁、银、铝呈银白色,铜呈紫红色。
2.B 金属具有的共性有常温下大多数金属是固体,有金属光泽,有良好的导电性、导热性、延展性等。
3.B
4.B 导电性和延展性属于物理性质,铜不能跟盐酸反应。
5.C
6.B 铁丝在空气中不能燃烧,镁条在空气中燃烧发出耀眼的白光;将镁条放入稀盐酸中,能观察到固体逐渐溶解,产生气泡,现象描述中不能出现物质名称;将铁钉放入硫酸铜溶液中,观察到铁钉表面出现红色固体,溶液由蓝色变为浅绿色,而不是固体全部溶解。
7.(1)Cu、Fe、Al
(2)铝(或Al)
(3)铁(或Fe) Fe+H2SO4FeSO4+H2↑
(4)铝、铁
8.D
9.C 根据纪念币的流通特点可知:铸造出的纪念币要有较强的耐腐蚀性、硬度较大且硬币价值与面值的吻合度要接近,而金属的导电性、导热性等不是铸造纪念币时需要考虑的因素。
10.D 铁与稀硫酸反应生成的是硫酸亚铁,不是硫酸铁,硫酸铁不能用金属与稀酸反应直接得到。
11.(1)金属 (2)导电
(3)在常温下,铝与空气中的氧气反应,在表面生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化
12.(1)锌
(2)反应结束后,产生氢气的体积相等(合理即可)
13.(1)放 (2)相同条件下,金属越活泼,与酸反应放出的热量越多(合理即可)
(3)温度
14.(1)漏斗、玻璃棒、烧杯
(2)Fe+CuSO4FeSO4+Cu
(3)Al2(SO4)3、FeSO4 Cu、Fe
(4)将铜铁混合物中的铁完全除去
15.(1)置换反应
(2)加热条件下,铜与氧气反应,生成新物质氧化铜,导致回收的铜不纯
(3)解:设理论上可从该废液中回收得到的金属铜的质量为x。
Fe+CuSO4FeSO4+Cu
160 64
4 t x
= x=1.6 t
答:理论上可从该废液中回收得到1.6 t金属铜。
16.C
17.C 由图中信息可知,完全反应所需时间:丙>甲>乙;生成氢气的质量:甲>乙>丙;甲、乙、丙在生成物中均显+2价,稀硫酸足量,相对原子质量越大,生成的氢气质量越小,因此相对原子质量:丙>乙>甲;生成的氢气中氢元素完全来自硫酸,因此生成氢气质量越大,消耗硫酸质量越大,因此消耗硫酸的质量:甲>乙>丙。
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
