第一节 原子结构--能层、能级与构造原理
文档属性
| 名称 | 第一节 原子结构--能层、能级与构造原理 |  | |
| 格式 | zip | ||
| 文件大小 | 834.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-05-31 20:28:04 | ||
图片预览











文档简介
课件31张PPT。考向一第
一节
原子结构晨背关键语句知识点一考向二随堂基础巩固课时跟踪训练知识点二理解教材新知把握热点考向应用创新演练
第一课时
能层
、
能级与构造原理
第
一章
原子结构与性质 1.根据电子能量的差异,核外电子分成不同的能层,各能层最多容纳的电子数为2n2 。
2.能层中电子的能量略有差异,根据能量的差异又分成不同的能级,能级数等于能层序数。
3.绝大多数元素原子的核外电子排布遵循构造原理,即电子进入能级的顺序为1s2s2p3s3p4s3d4p5s4d5p6
s4f5d6p7s5f6d7p。
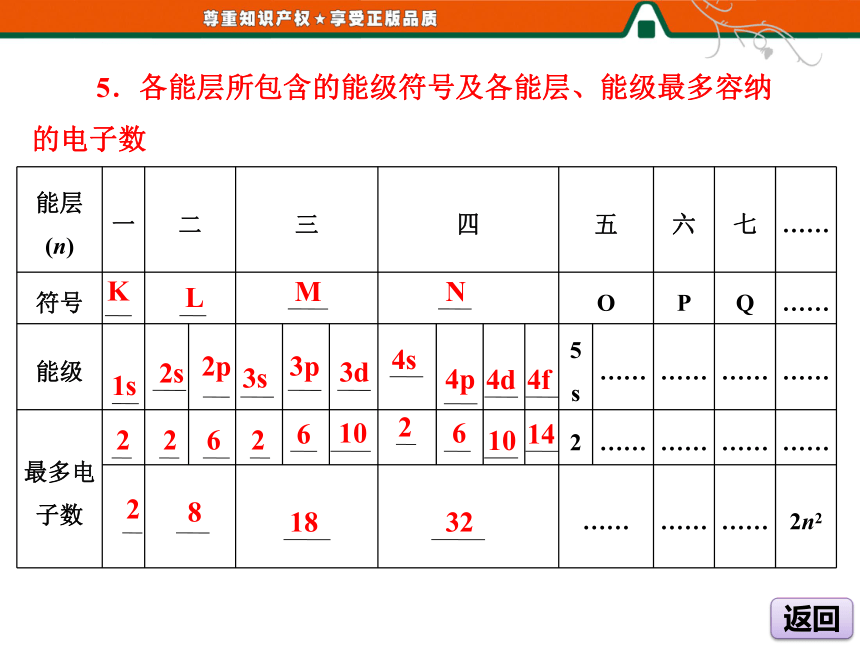
4.各能级能量由低到高的顺序为ns(n-2)f(n-1)dnp。[自学教材·填要点]1.原子的诞生2.宇宙中元素的组成及含量 3.能层
根据多电子原子核外电子的 ,将核外电子分成不同的能层,能层用 表示。能量差异n 4.能级
(1)根据多电子原子中同一能层电子 的不同,将它们分成不同能级。
(2)能级用相应能层序数和字母s、p、d、f组合在一起来表示,如n能层的能级按能量由低到高的顺序排列为ns、 、nd、nf等。
(3)能层序数 该能层的所包含的能级数,如第三能层有能级 。
(4)s、p、d、f能级可容纳的电子数为1,3,5,7的 倍。能量np等于3s、3p、3d二 5.各能层所包含的能级符号及各能层、能级最多容纳的电子数KLMN1s2s2p3s3p3d4s4p4d4f2262106621014281832[师生互动·解疑难] (1)不同能层中同一能级,能层序数越大能量越高。
如1s<2s<3s…… 2p<3p<4p……
(2)同一能层中,各能级之间的能量大小关系是s (3)各能级能量由低到高的顺序为ns(n-2)f(n-1)dnp。1.以下能级符号正确的是________。
①5s ②2d ③3f ④1p ⑤3d
解析:第二能层只有2s、2p能级;第三能层只有3s、3p、3d能级,第一能层只有1s能级,故②、③、④均不正确。
答案:①⑤[自学教材·填要点] 1.构造原理
从氢原子开始,随着原子 的递增,原子核每增加一个质子,原子核外便增加一个电子,这个电子大多是按1s2s2p 3p4s 4p 4d5p6s4f5d6p7s……的能级顺序填充的,填满一个能级再填下一个新能级。这种规律称为构造
原理。
2.电子排布式
将能级上所容纳的电子数标在该能级符号 ,并按照能层从左到右的顺序排列的式子,称电子排布式,如锂元素的电子排布式为:1s22s1。核电荷数3s3d5s右上角3.应用
根据构造原理,可写出几乎所有元素原子的电子排布式。
如Mg、Cl的电子排布式为:
Mg: ,或简化写成: ;
Cl: ,或简化写成: 。1s22s22p63s2[Ne]3s21s22s22p63s23p5[Ne]3s23p5电子排布式的书写
(1)简单原子的电子排布式。
按照构造原理将电子依次填充到能量逐渐升高的能级中。如:
6C:1s22s22p2;
10Ne:1s22s22p6;
17Cl:1s22s22p63s23p5;
19K:1s22s22p63s23p64s1。[师生互动·解疑难] (2)复杂原子的电子排布式。
对于较复杂原子的电子排布式,应先按构造原理从低到高排列,然后将同能层的能级移到一起。
如26Fe,先排列为:1s22s22p63s23p64s23d6,然后将同一能层的能级排到一起,即该原子的电子排布式为:1s22s22p63s23p63d64s2。
(3)简化电子排布式。
如K:1s22s22p63s23p64s1,其简化电子排布式可表示为:[Ar]4s1,其中[Ar]代表Ar的核外电子排布式,即1s22s22p63s23p6。再如Fe的简化电子排布式为:[Ar]3d64s2。2.下列原子的电子排布式正确的是 ( )
A.9F:1s22s22p6
B.15P:1s22s22p63s33p2
C.21Sc:1s22s22p63s23p64s23d1
D.35Br:1s22s22p63s23p63d104s24p5
解析:氟原子2p能级应排5个电子;磷原子的3s能级应排2个电子,3p能级应排3个电子;写电子排布式时,应将同能层的能级移到一起。
答案:D [例1] 构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以E表示某能级的能量,以下各式中能量高低顺序正确的是 ( )
A.E(5s)>E(4f)>E(4s)>E(3d)
B.E(3d)>E(4s)>E(3p)>E(3s)
C.E(4s) D.E(5s)>E(4s)>E(4f)>E(3d) [解析] 根据构造原理,各能级能量由低到高的顺序为1s2s2p3s3p4s3d4p5s……所以A项和D项的正确顺序为E(4f)>E(5s)>E(3d)>E(4s);对于不同能层的相同能级,能层序数越大,能量越高,即E(4s)>E(3s)>E(2s)>E(1s),C项错误。
[答案] B 决定电子能量高低的因素:
(1)能层:能级符号相同时,能层序数越大,电子能量越高。
(2)能级:在同一能层的不同能级中,s、p、d、f能级的能量依次升高。
(3)在多电子原子中会发生能级交错现象。提示:(1)不一定,如E(4s)
出现了能级交错现象。
(2)不一定。原子在填充
电子时,由低能量向高能量填充,
在3d和4s等能级中出现能级交错现象,
先填充4s后填充3d,但失去电子时,却先失去4s电子,后失去3d电子。 [例2] 根据构造原理写出下列原子或离子的核外电子排布式。
(1)O____________;(2)Ca____________;
(3)S2-____________;(4)Al3+____________。 [解析] O原子有8个电子,按1s、2s、2p顺序填充电子:1s22s22p4;Ca原子有20个电子,由于4s<3d,出现能级交错,按1s、2s、2p、3s、3p、4s顺序填充为1s22s22p63s23
p64s2;S原子有16个电子,按1s、2s、2p、3s、3p顺序填充为1s22s22p63s23p4,S2-为S原子得到2个电子后形成,故3p能级上填充6个电子,即其核外电子排布式为1s22s22p63s23p6;Al原子有13个电子,按1s、2s、2p、3s顺序填充为1s22s22p63s23p1,Al原子失去3个电子后变成Al3+,故Al3+的电子排布式为1s22s22p6。
[答案] (1)1s22s22p4 (2)1s22s22p63s23p64s2
(3)1s22s22p63s23p6 (4)1s22s22p6 电子排布式的书写顺序与电子排布顺序有所不同,电子进入能级的顺序是按构造原理中能级的能量递增的顺序,而电子排布式的书写则按能层的顺序,能层中的能级按s、p、d、f能量递增的顺序排列。主族元素的原子失去最外层电子形成阳离子,主族元素的原子得到电子填充在最外层形成阴离子,下列各原子或离子的电子排布式错误的是 ( )
A.Ca2+:1s22s22p63s23p6
B.F-:1s22s22p6
C.S:1s22s22p63s1
D.Ar:1s22s22p63s23p6解析:先写出各微粒的电子排布式:
Ca2+:1s22s22p63s23p6;F-:1s22s22p6;
S:1s22s22p63s23p4;Ar:1s22s22p63s23p6。
再与各选项对比,就能找出答案。
答案:C点击下图片进入“随堂基础巩固”点击下图片进入“课时跟踪训练”
一节
原子结构晨背关键语句知识点一考向二随堂基础巩固课时跟踪训练知识点二理解教材新知把握热点考向应用创新演练
第一课时
能层
、
能级与构造原理
第
一章
原子结构与性质 1.根据电子能量的差异,核外电子分成不同的能层,各能层最多容纳的电子数为2n2 。
2.能层中电子的能量略有差异,根据能量的差异又分成不同的能级,能级数等于能层序数。
3.绝大多数元素原子的核外电子排布遵循构造原理,即电子进入能级的顺序为1s2s2p3s3p4s3d4p5s4d5p6
s4f5d6p7s5f6d7p。
4.各能级能量由低到高的顺序为ns(n-2)f(n-1)dnp。[自学教材·填要点]1.原子的诞生2.宇宙中元素的组成及含量 3.能层
根据多电子原子核外电子的 ,将核外电子分成不同的能层,能层用 表示。能量差异n 4.能级
(1)根据多电子原子中同一能层电子 的不同,将它们分成不同能级。
(2)能级用相应能层序数和字母s、p、d、f组合在一起来表示,如n能层的能级按能量由低到高的顺序排列为ns、 、nd、nf等。
(3)能层序数 该能层的所包含的能级数,如第三能层有能级 。
(4)s、p、d、f能级可容纳的电子数为1,3,5,7的 倍。能量np等于3s、3p、3d二 5.各能层所包含的能级符号及各能层、能级最多容纳的电子数KLMN1s2s2p3s3p3d4s4p4d4f2262106621014281832[师生互动·解疑难] (1)不同能层中同一能级,能层序数越大能量越高。
如1s<2s<3s…… 2p<3p<4p……
(2)同一能层中,各能级之间的能量大小关系是s
①5s ②2d ③3f ④1p ⑤3d
解析:第二能层只有2s、2p能级;第三能层只有3s、3p、3d能级,第一能层只有1s能级,故②、③、④均不正确。
答案:①⑤[自学教材·填要点] 1.构造原理
从氢原子开始,随着原子 的递增,原子核每增加一个质子,原子核外便增加一个电子,这个电子大多是按1s2s2p 3p4s 4p 4d5p6s4f5d6p7s……的能级顺序填充的,填满一个能级再填下一个新能级。这种规律称为构造
原理。
2.电子排布式
将能级上所容纳的电子数标在该能级符号 ,并按照能层从左到右的顺序排列的式子,称电子排布式,如锂元素的电子排布式为:1s22s1。核电荷数3s3d5s右上角3.应用
根据构造原理,可写出几乎所有元素原子的电子排布式。
如Mg、Cl的电子排布式为:
Mg: ,或简化写成: ;
Cl: ,或简化写成: 。1s22s22p63s2[Ne]3s21s22s22p63s23p5[Ne]3s23p5电子排布式的书写
(1)简单原子的电子排布式。
按照构造原理将电子依次填充到能量逐渐升高的能级中。如:
6C:1s22s22p2;
10Ne:1s22s22p6;
17Cl:1s22s22p63s23p5;
19K:1s22s22p63s23p64s1。[师生互动·解疑难] (2)复杂原子的电子排布式。
对于较复杂原子的电子排布式,应先按构造原理从低到高排列,然后将同能层的能级移到一起。
如26Fe,先排列为:1s22s22p63s23p64s23d6,然后将同一能层的能级排到一起,即该原子的电子排布式为:1s22s22p63s23p63d64s2。
(3)简化电子排布式。
如K:1s22s22p63s23p64s1,其简化电子排布式可表示为:[Ar]4s1,其中[Ar]代表Ar的核外电子排布式,即1s22s22p63s23p6。再如Fe的简化电子排布式为:[Ar]3d64s2。2.下列原子的电子排布式正确的是 ( )
A.9F:1s22s22p6
B.15P:1s22s22p63s33p2
C.21Sc:1s22s22p63s23p64s23d1
D.35Br:1s22s22p63s23p63d104s24p5
解析:氟原子2p能级应排5个电子;磷原子的3s能级应排2个电子,3p能级应排3个电子;写电子排布式时,应将同能层的能级移到一起。
答案:D [例1] 构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以E表示某能级的能量,以下各式中能量高低顺序正确的是 ( )
A.E(5s)>E(4f)>E(4s)>E(3d)
B.E(3d)>E(4s)>E(3p)>E(3s)
C.E(4s)
[答案] B 决定电子能量高低的因素:
(1)能层:能级符号相同时,能层序数越大,电子能量越高。
(2)能级:在同一能层的不同能级中,s、p、d、f能级的能量依次升高。
(3)在多电子原子中会发生能级交错现象。提示:(1)不一定,如E(4s)
(2)不一定。原子在填充
电子时,由低能量向高能量填充,
在3d和4s等能级中出现能级交错现象,
先填充4s后填充3d,但失去电子时,却先失去4s电子,后失去3d电子。 [例2] 根据构造原理写出下列原子或离子的核外电子排布式。
(1)O____________;(2)Ca____________;
(3)S2-____________;(4)Al3+____________。 [解析] O原子有8个电子,按1s、2s、2p顺序填充电子:1s22s22p4;Ca原子有20个电子,由于4s<3d,出现能级交错,按1s、2s、2p、3s、3p、4s顺序填充为1s22s22p63s23
p64s2;S原子有16个电子,按1s、2s、2p、3s、3p顺序填充为1s22s22p63s23p4,S2-为S原子得到2个电子后形成,故3p能级上填充6个电子,即其核外电子排布式为1s22s22p63s23p6;Al原子有13个电子,按1s、2s、2p、3s顺序填充为1s22s22p63s23p1,Al原子失去3个电子后变成Al3+,故Al3+的电子排布式为1s22s22p6。
[答案] (1)1s22s22p4 (2)1s22s22p63s23p64s2
(3)1s22s22p63s23p6 (4)1s22s22p6 电子排布式的书写顺序与电子排布顺序有所不同,电子进入能级的顺序是按构造原理中能级的能量递增的顺序,而电子排布式的书写则按能层的顺序,能层中的能级按s、p、d、f能量递增的顺序排列。主族元素的原子失去最外层电子形成阳离子,主族元素的原子得到电子填充在最外层形成阴离子,下列各原子或离子的电子排布式错误的是 ( )
A.Ca2+:1s22s22p63s23p6
B.F-:1s22s22p6
C.S:1s22s22p63s1
D.Ar:1s22s22p63s23p6解析:先写出各微粒的电子排布式:
Ca2+:1s22s22p63s23p6;F-:1s22s22p6;
S:1s22s22p63s23p4;Ar:1s22s22p63s23p6。
再与各选项对比,就能找出答案。
答案:C点击下图片进入“随堂基础巩固”点击下图片进入“课时跟踪训练”
