第一节 金属的化学性质
图片预览




文档简介
课件16张PPT。第三章 金属及其化合物
第一节 金属的化学性质
第1课时 金属与非金属的反应
1.了解Na Fe与Al分别与O2的反应 ,以及和其它非金属的反应
2.知道铝的氧化膜对内部金属的保护作用金属与我们的生活了解自然界中的金属元素1、金属元素占总元素的4/5,地壳中含量最多的金属元素
是铝,第二位是铁,第三位是钙,第四位是钠。地壳中含量最多的元素是氧,第二位是硅,第三位是铝。
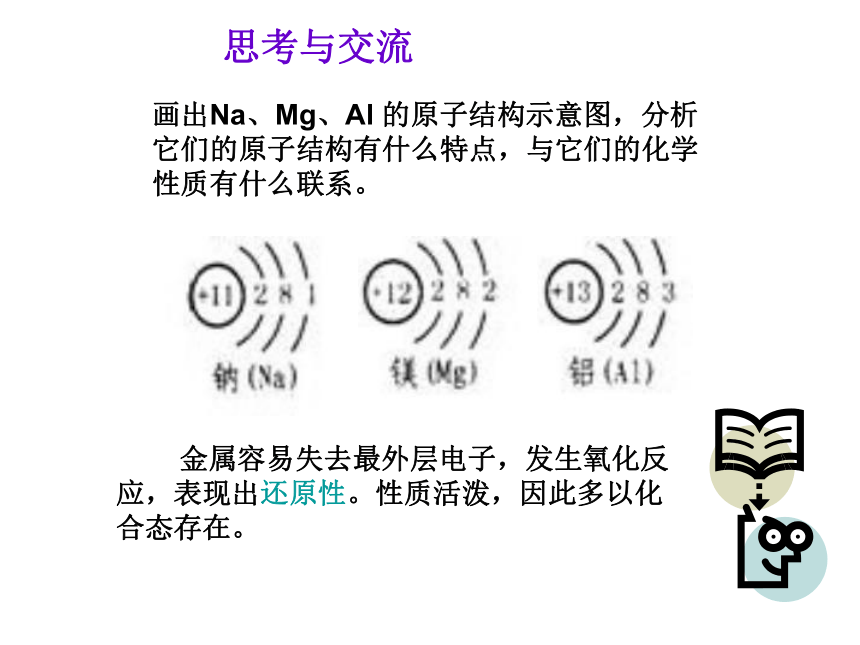
2、大多数金属元素是以化合态存在的。为什么?画出Na、Mg、Al 的原子结构示意图,分析它们的原子结构有什么特点,与它们的化学性质有什么联系。 金属容易失去最外层电子,发生氧化反应,表现出还原性。性质活泼,因此多以化合态存在。思考与交流一、复习小结金属的一些化学通性:(即一些共同的化学性质)
1、金属与非金属反应
2、金属与酸反应
3、金属可以与盐溶液反应
咱们再初中已经学过金属,金属有共同的物理性质:( )也学过一些金属的化学反应:( )
结合书46页举例说明。二、金属与非金属的反应
金属钠的物理性质存放方法:
存放方法:保存在煤油当中(1)、钠和氧气的反应
A、常温下:4Na + O2 ==== 2Na2O(颜色:白色固体)
B、钠的燃烧
实验现象:金属先熔化成银色小球,在空气中燃烧,火焰呈黄色,生成淡黄色固体 。
反应可表示为: 2Na + O2 ==== Na2O2 (颜色:淡黄色固体) △由以上两个反应可以得出结论: 反应物相同时,如果反应条件不同,则生成物有可能不同。2、铝与氧气的反应
4Al+3O2 点燃 2Al2O3 【实验探究1】
实验现象 :铝箔 逐渐熔化,失去光泽,但不滴落
原因:铝的熔点为665℃,氧化铝的熔点为2050℃ ,铝表面的致密氧化膜包在铝的外面,所以熔化了的液态铝不会落下。
【实验探究2】
实验现象: 熔化的铝仍不滴落
原因: 磨去氧化膜的铝片在空气中很快又形成一层新的氧化膜
注意:铝在空气中不能燃烧,但在纯氧中能够燃烧。
和铁一样。总结:
1、金属和氧气加热条件下反应一般生成普通氧化物,例MgO Al2O3 CuO,但钠和氧气在加热条件下反应生成Na2O2,铁在纯氧中燃烧生成Fe3O4。
2、钠和镁能在空气中燃烧,铁和铝不能在空气中燃烧,只能在纯氧中燃烧。
3、金属的活动性越强,与氧气反应就越易进行(如钠露置空气中就氧化);金属活动性越弱,与氧气发生反应时反应条件较高(如铁在空气中不能被点燃),俗语说“真金不怕火炼”就说明金在加热条件下也不与氧气反应。
所以当氧化剂都相同,可根据它和还原剂发生反应所需条件的剧烈程度来判断还原剂还原性的强弱。 4、燃烧不一定非要氧气参加,能发光发热的反应就是燃烧反应。
5、当反应条件相差不大,还原剂都相同时,氧化剂氧化性越强,能把还原剂中的相关元素氧化到较高价态。相反还原剂还原性越强,能把氧化剂中相关元素氧化到较低价态。
所以可以根据元素发生反应后,形成价态的高低来判断氧化性,还原性的强弱。一、金属与氧气反应
1.钠与氧气的反应
常温下:4Na+O2=2Na2O
加热条件下:2Na+O2=Na2O2
小结:金属钠的物理性质,银白色金属光泽,熔点低、硬度小、密度比煤油大。
2.铝与氧气的反应
4Al+3O2=2Al2O3
金属氧化膜的作用:致密的氧化膜对内层金属起保护作用。 实验室的钠是保存在煤油中的,那么能否保存在汽油或者CCl4溶液中呢?思考不能,因为汽油易挥发,而四氯化碳密度比钠大,故都不能保存钠
第一节 金属的化学性质
第1课时 金属与非金属的反应
1.了解Na Fe与Al分别与O2的反应 ,以及和其它非金属的反应
2.知道铝的氧化膜对内部金属的保护作用金属与我们的生活了解自然界中的金属元素1、金属元素占总元素的4/5,地壳中含量最多的金属元素
是铝,第二位是铁,第三位是钙,第四位是钠。地壳中含量最多的元素是氧,第二位是硅,第三位是铝。
2、大多数金属元素是以化合态存在的。为什么?画出Na、Mg、Al 的原子结构示意图,分析它们的原子结构有什么特点,与它们的化学性质有什么联系。 金属容易失去最外层电子,发生氧化反应,表现出还原性。性质活泼,因此多以化合态存在。思考与交流一、复习小结金属的一些化学通性:(即一些共同的化学性质)
1、金属与非金属反应
2、金属与酸反应
3、金属可以与盐溶液反应
咱们再初中已经学过金属,金属有共同的物理性质:( )也学过一些金属的化学反应:( )
结合书46页举例说明。二、金属与非金属的反应
金属钠的物理性质存放方法:
存放方法:保存在煤油当中(1)、钠和氧气的反应
A、常温下:4Na + O2 ==== 2Na2O(颜色:白色固体)
B、钠的燃烧
实验现象:金属先熔化成银色小球,在空气中燃烧,火焰呈黄色,生成淡黄色固体 。
反应可表示为: 2Na + O2 ==== Na2O2 (颜色:淡黄色固体) △由以上两个反应可以得出结论: 反应物相同时,如果反应条件不同,则生成物有可能不同。2、铝与氧气的反应
4Al+3O2 点燃 2Al2O3 【实验探究1】
实验现象 :铝箔 逐渐熔化,失去光泽,但不滴落
原因:铝的熔点为665℃,氧化铝的熔点为2050℃ ,铝表面的致密氧化膜包在铝的外面,所以熔化了的液态铝不会落下。
【实验探究2】
实验现象: 熔化的铝仍不滴落
原因: 磨去氧化膜的铝片在空气中很快又形成一层新的氧化膜
注意:铝在空气中不能燃烧,但在纯氧中能够燃烧。
和铁一样。总结:
1、金属和氧气加热条件下反应一般生成普通氧化物,例MgO Al2O3 CuO,但钠和氧气在加热条件下反应生成Na2O2,铁在纯氧中燃烧生成Fe3O4。
2、钠和镁能在空气中燃烧,铁和铝不能在空气中燃烧,只能在纯氧中燃烧。
3、金属的活动性越强,与氧气反应就越易进行(如钠露置空气中就氧化);金属活动性越弱,与氧气发生反应时反应条件较高(如铁在空气中不能被点燃),俗语说“真金不怕火炼”就说明金在加热条件下也不与氧气反应。
所以当氧化剂都相同,可根据它和还原剂发生反应所需条件的剧烈程度来判断还原剂还原性的强弱。 4、燃烧不一定非要氧气参加,能发光发热的反应就是燃烧反应。
5、当反应条件相差不大,还原剂都相同时,氧化剂氧化性越强,能把还原剂中的相关元素氧化到较高价态。相反还原剂还原性越强,能把氧化剂中相关元素氧化到较低价态。
所以可以根据元素发生反应后,形成价态的高低来判断氧化性,还原性的强弱。一、金属与氧气反应
1.钠与氧气的反应
常温下:4Na+O2=2Na2O
加热条件下:2Na+O2=Na2O2
小结:金属钠的物理性质,银白色金属光泽,熔点低、硬度小、密度比煤油大。
2.铝与氧气的反应
4Al+3O2=2Al2O3
金属氧化膜的作用:致密的氧化膜对内层金属起保护作用。 实验室的钠是保存在煤油中的,那么能否保存在汽油或者CCl4溶液中呢?思考不能,因为汽油易挥发,而四氯化碳密度比钠大,故都不能保存钠
