金属钠的性质与应用
图片预览


文档简介
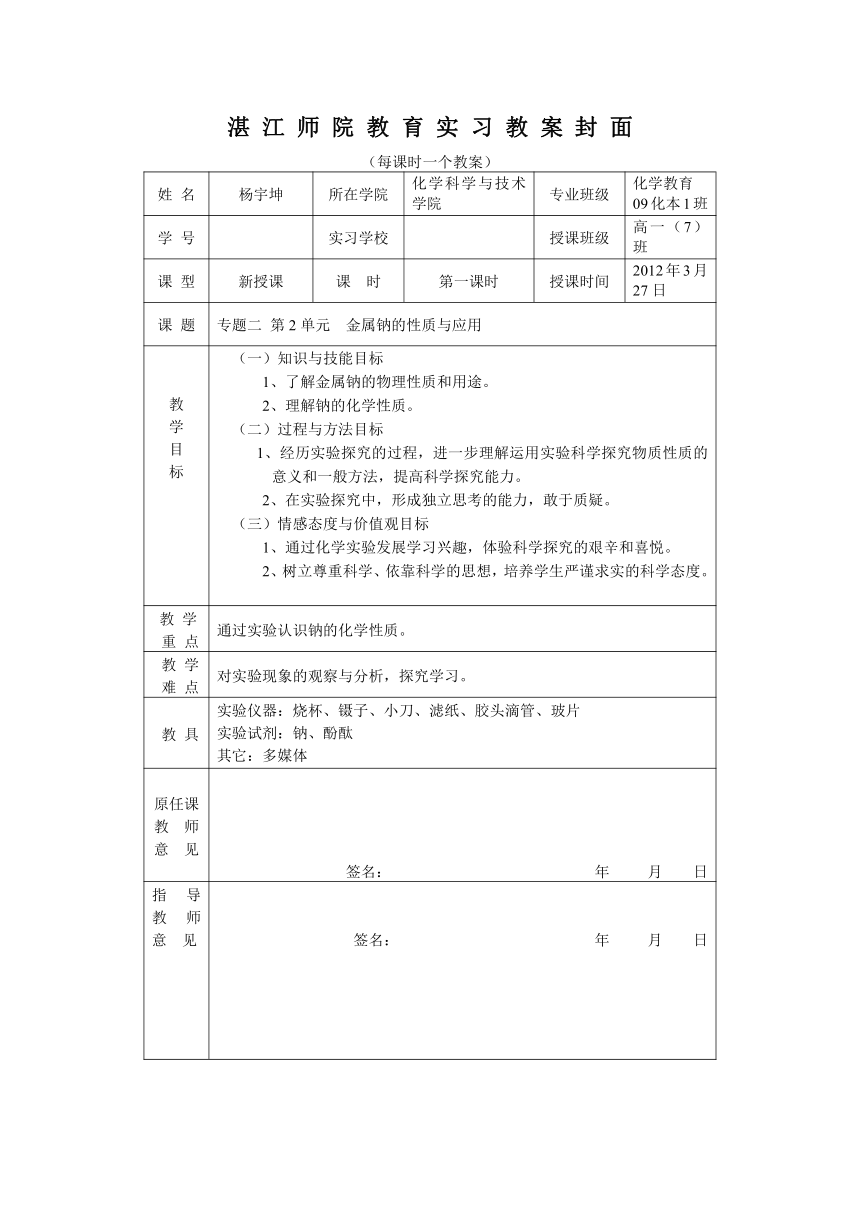
湛 江 师 院 教 育 实 习 教 案 封 面
(每课时一个教案)
姓 名 杨宇坤 所在学院 化学科学与技术学院 专业班级 化学教育09化本1班
学 号 实习学校 授课班级 高一(7)班
课 型 新授课 课 时 第一课时 授课时间 2012年3月27日
课 题 专题二 第2单元 金属钠的性质与应用
教学目标 (一)知识与技能目标1、了解金属钠的物理性质和用途。2、理解钠的化学性质。(二)过程与方法目标1、经历实验探究的过程,进一步理解运用实验科学探究物质性质的意义和一般方法,提高科学探究能力。2、在实验探究中,形成独立思考的能力,敢于质疑。(三)情感态度与价值观目标1、通过化学实验发展学习兴趣,体验科学探究的艰辛和喜悦。2、树立尊重科学、依靠科学的思想,培养学生严谨求实的科学态度。
教 学 重 点 通过实验认识钠的化学性质。
教 学 难 点 对实验现象的观察与分析,探究学习。
教 具 实验仪器:烧杯、镊子、小刀、滤纸、胶头滴管、玻片实验试剂:钠、酚酞其它:多媒体
原任课教 师 意 见 签名: 年 月 日
指 导 教 师 意 见 签名: 年 月 日
板书版面设计:
第2单元 钠、镁及其化合物---金属钠的性质及应用
钠的物理性质
银白色金属
质地柔软
密度比煤油大比水小
熔点低
导电、导热
钠的化学性质
与氧气反应
a.在常温下 4Na + O2 === 2Na2O(白色固体)
b.在加热条件下 2Na + O2 === Na2O2(淡黄色粉末)
Na2O(碱性氧化物)和水、酸等反应:
Na2O + H2O = 2NaOH
Na2O2 与水、二氧化碳等反应:
2Na2O2 + 2H2O == 4NaOH + O2
2Na2O2 + 2CO2 == 2Na2CO3 + O2
2、与水反应
2Na + 2H2O === 2NaOH + H2↑
三、钠的工业制备法:
2NaCl(熔融)=== 2Na + Cl2↑
课堂教学过程的设计与实施:
时序 教师活动和教学内容 学生活动 教学媒体
3’00”10’00”20’0035’00’’’’38’0045’00 【上课】上课!同学们好!请坐。【导入】今天我们要开始学习第二单元的第一个内容——金属钠的性质及应用。老师今天要当一回魔术师,表演一个叫“滴水点灯”的魔术,大家想看不?好。【演示实验】切一小块钠,放进酒精灯的灯芯,灯芯裹好小钠块,然后用胶头滴管滴1至2滴水到灯芯,有白烟,后酒精灯被点着。【讲述】大家是不是觉得很神奇呢?滴水是怎么成功地点着了灯的呢?其实这都归功于钠。究竟是钠的什么样的性质让它显得如此神奇呢?让我们来一起探讨一下。【板书】金属钠的性质及应用【提问】都说结构决定物质的性质,那么钠原子是什么结构呢?钠是元素周期表中的第几号元素啊?最外层有几个电子呢?【总结】钠是第11号元素,最外层只有一个电子。所以钠的性质很活泼,容易失去一个电子,形成八电子稳定结构。【板书】【PPT展示】钠保存在煤油中的图片【演示】取出装有钠的试剂瓶,取掉瓶塞,叫学生用手轻扇闻气味。【提问】同学们闻到什么气味【讲解】注意,钠是保存在煤油里的。钠的密度是0.97g/cm3 ,其密度比水小,可以保存在煤油里则说明它的密度比煤油大。下面老师要取一点钠,大家要注意观看。【演示】用镊子从瓶中取出一块钠,用滤纸把钠表面的煤油吸走。把钠移至有滤纸的玻片上,用小刀切出一小块,并让学生看切开的钠。【提问】大家看到钠的切面是什么颜色的呢,老师可以用小刀切开又说明了什么呢?【板书】一、钠的物理性质 银白色金属 质地柔软 密度比煤油大比水小 熔点低 导电、导热【讲述】学习完钠的物理性质,现在我们来重点学习一下金属钠的化学性质。大家观察到钠的表面跟刚切开的钠表面有什么不同吗?【总结】刚切开的钠表面是银白色的,而放置在空气中的钠表面颜色变暗。说明钠在空气中生成了新的物质。钠的化学性质活泼,能与空气中的氧气发生反应。【板书】二、钠的化学性质1.与氧气反应 a.在常温下 4Na + O2 === 2Na2O(白色固体)【设疑】如果在加热的情况下,钠和氧气还是生成氧化钠吗?老师现在放一段钠在空气中加热的视频,大家仔细观察。【视频播放】播放钠在空气中的视频【提问】同学们能描述一下自己看到了什么吗 【总结】钠在加热的情况下先是熔成一个小球,后剧烈燃烧起来,最后生成了淡黄色的物质。【提问】生成的物质是不是氧化钠呢?【总结】钠在加热的情况下生成的是淡黄色的过氧化钠。【板书】b.在加热条件下 2Na + O2 ==== Na2O2(淡黄色粉末)【讲述】氧化钠是碱性氧化物,能和水反应,还具有碱性氧化物的通性—可以和酸反应生成盐和水。【板书】Na2O(碱性氧化物)和水、酸等反应:Na2O + H2O = 2NaOH【讲解】而生成的过氧化钠则可作漂白剂和呼吸面具中的供养剂【板书】Na2O2 与水、二氧化碳等反应:2Na2O2 + 2H2O == 4NaOH + O2 2Na2O2 + 2CO2 == 2Na2CO3 + O2【讲述】钠除了跟氧气反应,还可以和水反应,这也是钠不能保存在水里的原因。下面我们来做一下钠与水反应的实验。【演示实验】向一只盛有水的烧杯中滴加几滴酚酞溶液,然后投入绿豆大小的金属钠。【提问】同学们看到了什么现象?【总结】钠与水反应的现象可用5个字概括:浮、熔、游、响、红。【提问】这些现象产生的原因是什么呢?【PPT展示】 【提问】既然已知钠与水反应生成了碱和气体,大家能推出这种碱和气体分别是什么吗?这个反应的化学反应方程式又是怎么写的呢?【板书】2、钠与水反应: 2Na + 2H2O === 2NaOH + H2↑【讲述】上面我们通过学习钠的物理和化学性质,知道钠是一种非常活泼的金属,那么,这么活泼的金属有些什么用途呢,我们一起看一下【PPT展示】【讲述】钠就有以上等等方面的用途。但我们知道在自然界中是不存在游离态的钠的,即不存在单质钠,钠的性质那么活泼,应该如何制取呢?【板书】钠的工业制备法: 2NaCl(熔融)=== 2Na + Cl2↑【讲述】以上就是我们今天学习的全部内容,现在我们来总结一下。我们学习了钠的物理和化学性质,钠与氧气、水的反应,钠的用途和制备。【PPT展示】【课堂小结】【课后思考题】【PPT展示】(1)电解NaCl溶液,能否得到金属钠?为什么?(2)电解时产生的Cl2和金属Na能接触吗?为什么?【讲述】这堂课就上到这里。下课! 问好回答答想好奇观看思考回答闻味回答认真观看思考回答观察思考描述认真观看思考回答观察思考讨论描述认真观看回答思考讨论做笔记思考回答思考讨论观看思考回答抄题 仪器药品 PPT演示仪器药品视频播放PPT演示仪器药品PPT演示PPT演示PPT演示
Na
△
通电
Na
△
通电
(每课时一个教案)
姓 名 杨宇坤 所在学院 化学科学与技术学院 专业班级 化学教育09化本1班
学 号 实习学校 授课班级 高一(7)班
课 型 新授课 课 时 第一课时 授课时间 2012年3月27日
课 题 专题二 第2单元 金属钠的性质与应用
教学目标 (一)知识与技能目标1、了解金属钠的物理性质和用途。2、理解钠的化学性质。(二)过程与方法目标1、经历实验探究的过程,进一步理解运用实验科学探究物质性质的意义和一般方法,提高科学探究能力。2、在实验探究中,形成独立思考的能力,敢于质疑。(三)情感态度与价值观目标1、通过化学实验发展学习兴趣,体验科学探究的艰辛和喜悦。2、树立尊重科学、依靠科学的思想,培养学生严谨求实的科学态度。
教 学 重 点 通过实验认识钠的化学性质。
教 学 难 点 对实验现象的观察与分析,探究学习。
教 具 实验仪器:烧杯、镊子、小刀、滤纸、胶头滴管、玻片实验试剂:钠、酚酞其它:多媒体
原任课教 师 意 见 签名: 年 月 日
指 导 教 师 意 见 签名: 年 月 日
板书版面设计:
第2单元 钠、镁及其化合物---金属钠的性质及应用
钠的物理性质
银白色金属
质地柔软
密度比煤油大比水小
熔点低
导电、导热
钠的化学性质
与氧气反应
a.在常温下 4Na + O2 === 2Na2O(白色固体)
b.在加热条件下 2Na + O2 === Na2O2(淡黄色粉末)
Na2O(碱性氧化物)和水、酸等反应:
Na2O + H2O = 2NaOH
Na2O2 与水、二氧化碳等反应:
2Na2O2 + 2H2O == 4NaOH + O2
2Na2O2 + 2CO2 == 2Na2CO3 + O2
2、与水反应
2Na + 2H2O === 2NaOH + H2↑
三、钠的工业制备法:
2NaCl(熔融)=== 2Na + Cl2↑
课堂教学过程的设计与实施:
时序 教师活动和教学内容 学生活动 教学媒体
3’00”10’00”20’0035’00’’’’38’0045’00 【上课】上课!同学们好!请坐。【导入】今天我们要开始学习第二单元的第一个内容——金属钠的性质及应用。老师今天要当一回魔术师,表演一个叫“滴水点灯”的魔术,大家想看不?好。【演示实验】切一小块钠,放进酒精灯的灯芯,灯芯裹好小钠块,然后用胶头滴管滴1至2滴水到灯芯,有白烟,后酒精灯被点着。【讲述】大家是不是觉得很神奇呢?滴水是怎么成功地点着了灯的呢?其实这都归功于钠。究竟是钠的什么样的性质让它显得如此神奇呢?让我们来一起探讨一下。【板书】金属钠的性质及应用【提问】都说结构决定物质的性质,那么钠原子是什么结构呢?钠是元素周期表中的第几号元素啊?最外层有几个电子呢?【总结】钠是第11号元素,最外层只有一个电子。所以钠的性质很活泼,容易失去一个电子,形成八电子稳定结构。【板书】【PPT展示】钠保存在煤油中的图片【演示】取出装有钠的试剂瓶,取掉瓶塞,叫学生用手轻扇闻气味。【提问】同学们闻到什么气味【讲解】注意,钠是保存在煤油里的。钠的密度是0.97g/cm3 ,其密度比水小,可以保存在煤油里则说明它的密度比煤油大。下面老师要取一点钠,大家要注意观看。【演示】用镊子从瓶中取出一块钠,用滤纸把钠表面的煤油吸走。把钠移至有滤纸的玻片上,用小刀切出一小块,并让学生看切开的钠。【提问】大家看到钠的切面是什么颜色的呢,老师可以用小刀切开又说明了什么呢?【板书】一、钠的物理性质 银白色金属 质地柔软 密度比煤油大比水小 熔点低 导电、导热【讲述】学习完钠的物理性质,现在我们来重点学习一下金属钠的化学性质。大家观察到钠的表面跟刚切开的钠表面有什么不同吗?【总结】刚切开的钠表面是银白色的,而放置在空气中的钠表面颜色变暗。说明钠在空气中生成了新的物质。钠的化学性质活泼,能与空气中的氧气发生反应。【板书】二、钠的化学性质1.与氧气反应 a.在常温下 4Na + O2 === 2Na2O(白色固体)【设疑】如果在加热的情况下,钠和氧气还是生成氧化钠吗?老师现在放一段钠在空气中加热的视频,大家仔细观察。【视频播放】播放钠在空气中的视频【提问】同学们能描述一下自己看到了什么吗 【总结】钠在加热的情况下先是熔成一个小球,后剧烈燃烧起来,最后生成了淡黄色的物质。【提问】生成的物质是不是氧化钠呢?【总结】钠在加热的情况下生成的是淡黄色的过氧化钠。【板书】b.在加热条件下 2Na + O2 ==== Na2O2(淡黄色粉末)【讲述】氧化钠是碱性氧化物,能和水反应,还具有碱性氧化物的通性—可以和酸反应生成盐和水。【板书】Na2O(碱性氧化物)和水、酸等反应:Na2O + H2O = 2NaOH【讲解】而生成的过氧化钠则可作漂白剂和呼吸面具中的供养剂【板书】Na2O2 与水、二氧化碳等反应:2Na2O2 + 2H2O == 4NaOH + O2 2Na2O2 + 2CO2 == 2Na2CO3 + O2【讲述】钠除了跟氧气反应,还可以和水反应,这也是钠不能保存在水里的原因。下面我们来做一下钠与水反应的实验。【演示实验】向一只盛有水的烧杯中滴加几滴酚酞溶液,然后投入绿豆大小的金属钠。【提问】同学们看到了什么现象?【总结】钠与水反应的现象可用5个字概括:浮、熔、游、响、红。【提问】这些现象产生的原因是什么呢?【PPT展示】 【提问】既然已知钠与水反应生成了碱和气体,大家能推出这种碱和气体分别是什么吗?这个反应的化学反应方程式又是怎么写的呢?【板书】2、钠与水反应: 2Na + 2H2O === 2NaOH + H2↑【讲述】上面我们通过学习钠的物理和化学性质,知道钠是一种非常活泼的金属,那么,这么活泼的金属有些什么用途呢,我们一起看一下【PPT展示】【讲述】钠就有以上等等方面的用途。但我们知道在自然界中是不存在游离态的钠的,即不存在单质钠,钠的性质那么活泼,应该如何制取呢?【板书】钠的工业制备法: 2NaCl(熔融)=== 2Na + Cl2↑【讲述】以上就是我们今天学习的全部内容,现在我们来总结一下。我们学习了钠的物理和化学性质,钠与氧气、水的反应,钠的用途和制备。【PPT展示】【课堂小结】【课后思考题】【PPT展示】(1)电解NaCl溶液,能否得到金属钠?为什么?(2)电解时产生的Cl2和金属Na能接触吗?为什么?【讲述】这堂课就上到这里。下课! 问好回答答想好奇观看思考回答闻味回答认真观看思考回答观察思考描述认真观看思考回答观察思考讨论描述认真观看回答思考讨论做笔记思考回答思考讨论观看思考回答抄题 仪器药品 PPT演示仪器药品视频播放PPT演示仪器药品PPT演示PPT演示PPT演示
Na
△
通电
Na
△
通电
