华师大版科学九年级上册综合复习专题训练(四) 物质的转化与衍生关系(含解析)
文档属性
| 名称 | 华师大版科学九年级上册综合复习专题训练(四) 物质的转化与衍生关系(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 283.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-06-26 16:15:38 | ||
图片预览


文档简介
专题训练(四) 物质的转化与衍生关系
类型一 转化关系图综合分析
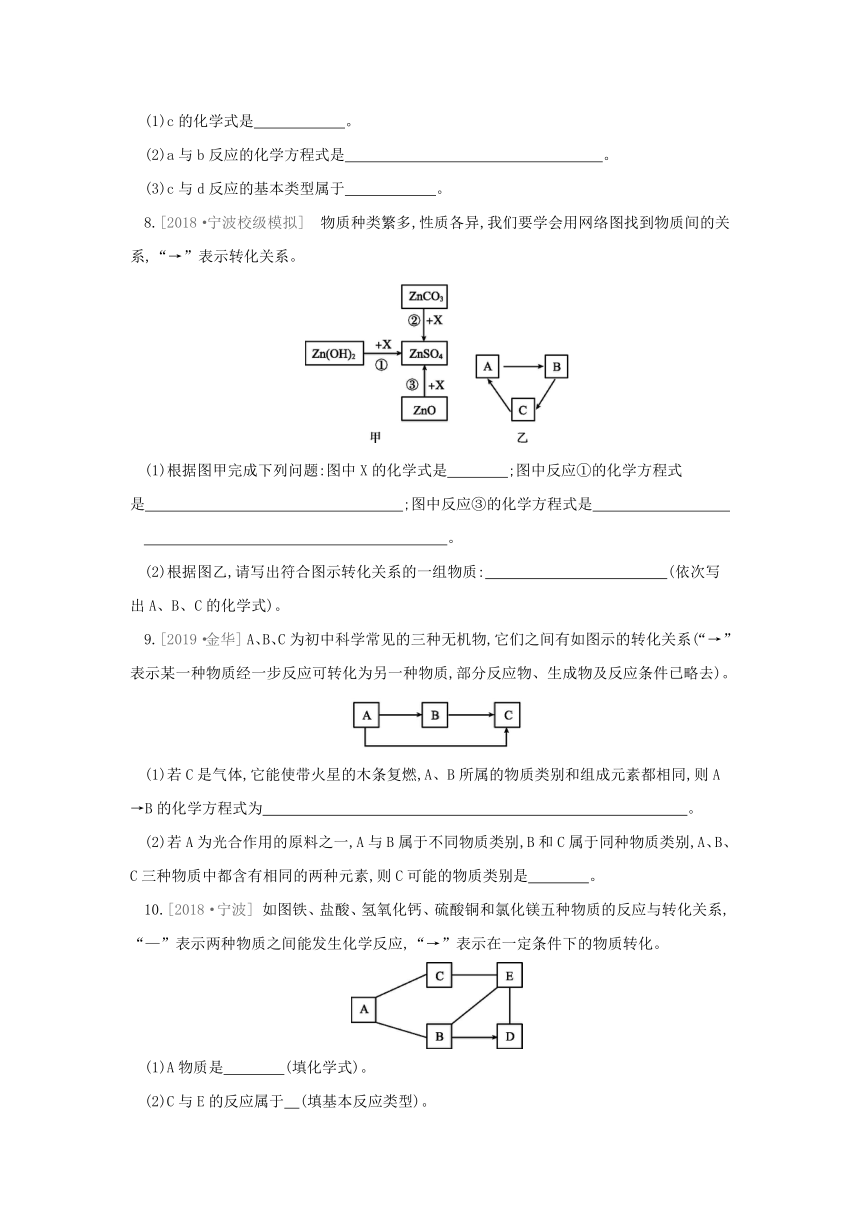
1.通过物质间相互反应可以实现物质间的相互转化,下列物质间的转化,通过一步化学反应不能实现的是( )
A.C→CO→CO2 B.Mg→MgO→MgCl2
C.CuO→Cu(OH)2→CuCl2 D.NaOH→NaCl→NaNO3
2.[2019·台州] 如图出了三种物质可能存在的转化关系,根据所学的物质性质及化学变化规律,判断下列选项正确的是( )
A.不能一步实现转化的有①②
B.实现③转化,可通入氯化钠溶液中
C.实现⑤转化,可加入碳酸钙粉末
D.实现⑥转化,可加入氢氧化钾溶液
3.A、B、C、D四种物质的转化关系如图示,它们均为初中科学中常见的物质,其中A是一种红棕色氧化物,B物质的溶液呈黄色。则X可能为( )
ABCD
A.H2SO4 B.CuCl2
C.NaOH D.Fe(OH)3
4.甲、乙、丙是初中科学常见的物质,用“-”连接的两种物质在溶液中可发生化学反应。下列说法不正确的是( )
A.甲可以为盐
B.乙只能是氧化物或酸
C.丙只能是金属单质、盐或碱
D.其中一个反应可以同时生成两种沉淀
5.如图示,现有甲、乙、丙、X、Y、Z六种物质,其中连线两端的甲、乙、丙溶液两两之间能发生反应;X、Y、Z之间只通过一步反应就能实现如图箭头所指方向的转化。下列符合上述要求的一组物质是( )
选项 甲 乙 丙 X Y Z
A HCl NaOH Na2CO3 Cu CuO CuSO4
B HCl Ba(OH)2 Na2CO3 H2O2 H2O O2
C H2SO4 NaOH K2CO3 C CO CO2
D H2SO4 Ba(OH)2 K2CO3 CaO Ca(OH)2 CaCO3
6.[2019·台州] 某同学对Fe2O3做了如图示的探究活动,已知氯气在水溶液中能将Fe2+转变为Fe3+,且每一步都充分反应。下列分析正确的是( )
A.无色气体可以使澄清石灰水变浑浊
B.黑色粉末是Fe3O4
C.①过程Fe2O3中的氧元素全部转入无色气体
D.②过程有置换反应发生
7.[2019·湖州] 的a、b、c、d是初中科学中常见的四种不同类别的物质,连线的两物质(或其水溶液)都能发生化学反应,分别生成甲、乙、丙、丁四种物质(部分生成物已经略去)。其中甲是标准状况下密度最小的气体;乙为氯化物,是家庭做菜时必要的调味品;a为常见的单质,它的制品在生活中应用极广,其组成元素是合成人体血红蛋白所必需的;c中含有三种元素,c和d相混时会产生蓝色絮状沉淀物丙。
(1)c的化学式是 。
(2)a与b反应的化学方程式是 。
(3)c与d反应的基本类型属于 。
8.[2018·宁波校级模拟] 物质种类繁多,性质各异,我们要学会用网络图找到物质间的关系,“→”表示转化关系。
(1)根据图甲完成下列问题:图中X的化学式是 ;图中反应①的化学方程式是 ;图中反应③的化学方程式是
。
(2)根据图乙,请写出符合图示转化关系的一组物质: (依次写出A、B、C的化学式)。
9.[2019·金华] A、B、C为初中科学常见的三种无机物,它们之间有如图示的转化关系(“→”表示某一种物质经一步反应可转化为另一种物质,部分反应物、生成物及反应条件已略去)。
(1)若C是气体,它能使带火星的木条复燃,A、B所属的物质类别和组成元素都相同,则A→B的化学方程式为 。
(2)若A为光合作用的原料之一,A与B属于不同物质类别,B和C属于同种物质类别,A、B、C三种物质中都含有相同的两种元素,则C可能的物质类别是 。
10.[2018·宁波] 如图铁、盐酸、氢氧化钙、硫酸铜和氯化镁五种物质的反应与转化关系,“—”表示两种物质之间能发生化学反应,“→”表示在一定条件下的物质转化。
(1)A物质是 (填化学式)。
(2)C与E的反应属于 (填基本反应类型)。
(3)从物质反应规律分析,在单质、氧化物、酸、碱和盐中,能与B反应生成D的物质有
(填序号)。
①2类 ②3类 ③4类 ④5类
类型二 实验探究综合分析
11.实验室有一久置的生石灰样品,科学小组同学利用该样品进行了一系列探究活动,具体操作步骤如图下:
①称取0.75 g样品,加足量的水充分溶解,过滤,得滤液A和0.1 g沉淀B。
②将滤液A等分成两份,一份先加少量酚酞试液,再滴加稀盐酸至过量,得混合物C;另一份加过量的碳酸钠溶液,得混合物D。
③将混合物C、D倒入一个洁净的烧杯中,发现烧杯中有白色沉淀且上层清液呈红色,过滤,得滤液E和1 g滤渣。
④向滤液E中滴加CaCl2溶液,有白色沉淀生成。
(1)则滤液E中一定含有的溶质(除酚酞外)是 。
(2)根据实验现象及数据判断,原样品的成分是 。
12.[2019·杭州] 某兴趣小组做了如图所示实验。
①在止水夹K1、K2处于关闭状态时,将针筒A中溶液挤入试管B中,接着打开止水夹K1,发现D中的部分溶液被吸入试管B中,充分反应后,试管B中留下的溶液也显红色。
②打开止水夹K2 ,风哨振动鸣叫,C中的部分溶液被吸入B和D中,反应后B、D中溶液都变为无色。
(1)步骤①中,充分反应后,试管B中的二氧化碳最终转化为 (填化学式)和水。
(2)解释步骤②中“风哨振动鸣叫”的原因:
。
(3)实验开始时C、D中两种溶液的溶质质量分数的关系为:a% (填“>” “=”或“<”)b%。
答案
1.C CuO不溶于水也不和水反应,不能通过一步反应转化成Cu(OH)2。
2.A 氢氧化钠和二氧化碳之间不能一步转化。二氧化碳与氯化钠不反应,与氢氧化钠反应能生成碳酸钠;氢氧化钠可以和二氧化碳反应转化为碳酸钠,氢氧化钠和碳酸钙粉末不发生反应;碳酸钠可以和氢氧化钡反应转化成氢氧化钠,与氢氧化钾溶液不发生反应。
3.A 4.B 5.D
6.B 由于氧化铁不含碳元素,且是高温隔绝空气加热,所以不会生成二氧化碳,无色气体为氧气,不能使澄清石灰水变浑浊。由于每一步都充分反应,所以不会有剩余的氧化铁,根据铁元素质量守恒,可得黑色粉末中铁原子和氧原子的个数比为:=3:4,所以黑色粉末是Fe3O4。黑色粉末中有氧元素。②过程是四氧化三铁和盐酸反应,不存在置换反应。
7.(1)NaOH
(2)Fe+2HClFeCl2+H2↑
(3)复分解反应
图中的a、b、c、d是初中科学中常见的四种不同类别的物质,连线的两物质(或其水溶液)都能发生化学反应,分别生成甲、乙、丙、丁四种物质。甲是标准状况下密度最小的气体,所以甲是氢气;乙为氯化物,是家庭做菜时必要的调味品,所以乙是氯化钠;a为常见的单质,它的制品在生活中应用极广,其组成元素是合成人体血红蛋白所必需的,所以a是铁;c中含有三种元素,c和d相混时会产生蓝色絮状沉淀物丙,所以丙是氢氧化铜沉淀;b和c反应生成氯化钠,和铁反应生成氢气,所以b是盐酸,c是氢氧化钠,d是硫酸铜或氯化铜。经过验证,推导正确。(1)c的化学式是NaOH。(2)a与b的反应是铁和盐酸反应生成氯化亚铁和氢气,化学方程式是Fe+2HClFeCl2+H2↑。(3)c与d的反应是氯化铜(或硫酸铜)和氢氧化钠反应生成氢氧化铜沉淀和氯化钠(或硫酸钠),反应的基本类型属于复分解反应。
8.(1)H2SO4 H2SO4+Zn(OH)2ZnSO4+2H2O ZnO+H2SO4ZnSO4+H2O
(2)CaO、Ca(OH)2、CaCO3(合理即可)
(1)氢氧化锌、碳酸锌和氧化锌均能与X反应生成硫酸锌,故X是硫酸。
9.(1)2H2O22H2O+O2↑
(2)酸、碱、盐
(1)C是气体,它能使带火星的木条复燃,则C是氧气;A能够生成氧气,则可能是过氧化氢溶液、水、高锰酸钾、氯酸钾,而B与A组成元素相同,且也能生成氧气,所以B是水;A是过氧化氢。(2)A为光合作用的原料之一,可以是水或者二氧化碳,A、B属于不同物质类别,B、C属于相同物质类别,A、B、C含有相同的两种元素,则有以下三种情况:①A是水,水与二氧化硫反应生成亚硫酸(B),亚硫酸与氧气反应生成硫酸(C),水与三氧化硫反应也能生成硫酸,A、B、C有共同的氢元素和氧元素,所以C可以是酸;②A是水,水与氧化钙反应生成氢氧化钙(B),氢氧化钙与碳酸钠反应生成氢氧化钠(C),水与氧化钠反应也能生成氢氧化钠,A、B、C有共同的氢元素和氧元素,所以C可以是碱;③A是二氧化碳,二氧化碳与氢氧化钠反应生成碳酸钠(B),碳酸钠与氢氧化钙反应生成碳酸钙(C),二氧化碳与氢氧化钙反应也能生成碳酸钙,A、B、C有共同的碳元素和氧元素,所以C可以是盐。综上所述,C可能是酸、碱、盐。
10.(1)Fe (2)复分解反应 (3)③
铁、盐酸、氢氧化钙、硫酸铜和氯化镁中,只有氢氧化钙能和盐酸、硫酸铜、氯化镁三种物质发生反应,则E为氢氧化钙、A为铁;A(铁)能和盐酸、硫酸铜发生反应,则B、C为盐酸和硫酸铜中的一种,则D为氯化镁;盐酸和硫酸铜中,盐酸能和镁、氢氧化镁等物质反应生成氯化镁(D),则B为盐酸、C为硫酸铜。(2)C与E是硫酸铜和氢氧化钙之间的反应,属于复分解反应。(3)B为盐酸,能与金属(镁)、金属氧化物(氧化镁)、碱(氢氧化镁)和盐(碳酸镁)发生反应生成氯化镁。
11.(1)碳酸钠、氯化钠
(2)氧化钙、氢氧化钙和碳酸钙
(1)通过实验分析可知:将混合物C、D倒入一个洁净的烧杯中,发现烧杯中有白色沉淀且上层清液呈红色,过滤,得滤液E和1 g滤渣,向滤液E中滴加CaCl2溶液,有白色沉淀生成,说明滤液E中一定含有的溶质是碳酸钠、氯化钠、酚酞,一定没有氯化氢,氢氧化钠可能有也可能没有。(2)根据①称取0.75 g样品,加足量的水充分溶解,过滤得滤液A和0.1 g沉淀B,可以判断原样品的成分中有碳酸钙;那么剩余物是0.65 g;根据③将混合物C、D倒入一个洁净的烧杯中,发现烧杯中有白色沉淀且上层清液呈红色,过滤,得滤液E和1 g滤渣碳酸钙,1 g碳酸钙中钙元素的质量=1 g××100%=0.4 g;根据质量守恒定律,钙元素质量守恒,剩余的0.65 g物质中含有0.4 g钙;假设0.65 g物质都是氧化钙,那么含钙元素的质量=0.65 g××100%≈0.46 g,0.46 g>0.4 g;假设0.65 g物质都是氢氧化钙,那么含钙元素的质量=0.65 g××100%≈0.35 g,0.35 g<0.4 g,因此原样品的成分中还有氧化钙和氢氧化钙。
12.(1)Na2CO3
(2)B中二氧化碳气体与氢氧化钠溶液反应使装置内气压下降,小于外部气压,气流从风哨进入
(3)>
类型一 转化关系图综合分析
1.通过物质间相互反应可以实现物质间的相互转化,下列物质间的转化,通过一步化学反应不能实现的是( )
A.C→CO→CO2 B.Mg→MgO→MgCl2
C.CuO→Cu(OH)2→CuCl2 D.NaOH→NaCl→NaNO3
2.[2019·台州] 如图出了三种物质可能存在的转化关系,根据所学的物质性质及化学变化规律,判断下列选项正确的是( )
A.不能一步实现转化的有①②
B.实现③转化,可通入氯化钠溶液中
C.实现⑤转化,可加入碳酸钙粉末
D.实现⑥转化,可加入氢氧化钾溶液
3.A、B、C、D四种物质的转化关系如图示,它们均为初中科学中常见的物质,其中A是一种红棕色氧化物,B物质的溶液呈黄色。则X可能为( )
ABCD
A.H2SO4 B.CuCl2
C.NaOH D.Fe(OH)3
4.甲、乙、丙是初中科学常见的物质,用“-”连接的两种物质在溶液中可发生化学反应。下列说法不正确的是( )
A.甲可以为盐
B.乙只能是氧化物或酸
C.丙只能是金属单质、盐或碱
D.其中一个反应可以同时生成两种沉淀
5.如图示,现有甲、乙、丙、X、Y、Z六种物质,其中连线两端的甲、乙、丙溶液两两之间能发生反应;X、Y、Z之间只通过一步反应就能实现如图箭头所指方向的转化。下列符合上述要求的一组物质是( )
选项 甲 乙 丙 X Y Z
A HCl NaOH Na2CO3 Cu CuO CuSO4
B HCl Ba(OH)2 Na2CO3 H2O2 H2O O2
C H2SO4 NaOH K2CO3 C CO CO2
D H2SO4 Ba(OH)2 K2CO3 CaO Ca(OH)2 CaCO3
6.[2019·台州] 某同学对Fe2O3做了如图示的探究活动,已知氯气在水溶液中能将Fe2+转变为Fe3+,且每一步都充分反应。下列分析正确的是( )
A.无色气体可以使澄清石灰水变浑浊
B.黑色粉末是Fe3O4
C.①过程Fe2O3中的氧元素全部转入无色气体
D.②过程有置换反应发生
7.[2019·湖州] 的a、b、c、d是初中科学中常见的四种不同类别的物质,连线的两物质(或其水溶液)都能发生化学反应,分别生成甲、乙、丙、丁四种物质(部分生成物已经略去)。其中甲是标准状况下密度最小的气体;乙为氯化物,是家庭做菜时必要的调味品;a为常见的单质,它的制品在生活中应用极广,其组成元素是合成人体血红蛋白所必需的;c中含有三种元素,c和d相混时会产生蓝色絮状沉淀物丙。
(1)c的化学式是 。
(2)a与b反应的化学方程式是 。
(3)c与d反应的基本类型属于 。
8.[2018·宁波校级模拟] 物质种类繁多,性质各异,我们要学会用网络图找到物质间的关系,“→”表示转化关系。
(1)根据图甲完成下列问题:图中X的化学式是 ;图中反应①的化学方程式是 ;图中反应③的化学方程式是
。
(2)根据图乙,请写出符合图示转化关系的一组物质: (依次写出A、B、C的化学式)。
9.[2019·金华] A、B、C为初中科学常见的三种无机物,它们之间有如图示的转化关系(“→”表示某一种物质经一步反应可转化为另一种物质,部分反应物、生成物及反应条件已略去)。
(1)若C是气体,它能使带火星的木条复燃,A、B所属的物质类别和组成元素都相同,则A→B的化学方程式为 。
(2)若A为光合作用的原料之一,A与B属于不同物质类别,B和C属于同种物质类别,A、B、C三种物质中都含有相同的两种元素,则C可能的物质类别是 。
10.[2018·宁波] 如图铁、盐酸、氢氧化钙、硫酸铜和氯化镁五种物质的反应与转化关系,“—”表示两种物质之间能发生化学反应,“→”表示在一定条件下的物质转化。
(1)A物质是 (填化学式)。
(2)C与E的反应属于 (填基本反应类型)。
(3)从物质反应规律分析,在单质、氧化物、酸、碱和盐中,能与B反应生成D的物质有
(填序号)。
①2类 ②3类 ③4类 ④5类
类型二 实验探究综合分析
11.实验室有一久置的生石灰样品,科学小组同学利用该样品进行了一系列探究活动,具体操作步骤如图下:
①称取0.75 g样品,加足量的水充分溶解,过滤,得滤液A和0.1 g沉淀B。
②将滤液A等分成两份,一份先加少量酚酞试液,再滴加稀盐酸至过量,得混合物C;另一份加过量的碳酸钠溶液,得混合物D。
③将混合物C、D倒入一个洁净的烧杯中,发现烧杯中有白色沉淀且上层清液呈红色,过滤,得滤液E和1 g滤渣。
④向滤液E中滴加CaCl2溶液,有白色沉淀生成。
(1)则滤液E中一定含有的溶质(除酚酞外)是 。
(2)根据实验现象及数据判断,原样品的成分是 。
12.[2019·杭州] 某兴趣小组做了如图所示实验。
①在止水夹K1、K2处于关闭状态时,将针筒A中溶液挤入试管B中,接着打开止水夹K1,发现D中的部分溶液被吸入试管B中,充分反应后,试管B中留下的溶液也显红色。
②打开止水夹K2 ,风哨振动鸣叫,C中的部分溶液被吸入B和D中,反应后B、D中溶液都变为无色。
(1)步骤①中,充分反应后,试管B中的二氧化碳最终转化为 (填化学式)和水。
(2)解释步骤②中“风哨振动鸣叫”的原因:
。
(3)实验开始时C、D中两种溶液的溶质质量分数的关系为:a% (填“>” “=”或“<”)b%。
答案
1.C CuO不溶于水也不和水反应,不能通过一步反应转化成Cu(OH)2。
2.A 氢氧化钠和二氧化碳之间不能一步转化。二氧化碳与氯化钠不反应,与氢氧化钠反应能生成碳酸钠;氢氧化钠可以和二氧化碳反应转化为碳酸钠,氢氧化钠和碳酸钙粉末不发生反应;碳酸钠可以和氢氧化钡反应转化成氢氧化钠,与氢氧化钾溶液不发生反应。
3.A 4.B 5.D
6.B 由于氧化铁不含碳元素,且是高温隔绝空气加热,所以不会生成二氧化碳,无色气体为氧气,不能使澄清石灰水变浑浊。由于每一步都充分反应,所以不会有剩余的氧化铁,根据铁元素质量守恒,可得黑色粉末中铁原子和氧原子的个数比为:=3:4,所以黑色粉末是Fe3O4。黑色粉末中有氧元素。②过程是四氧化三铁和盐酸反应,不存在置换反应。
7.(1)NaOH
(2)Fe+2HClFeCl2+H2↑
(3)复分解反应
图中的a、b、c、d是初中科学中常见的四种不同类别的物质,连线的两物质(或其水溶液)都能发生化学反应,分别生成甲、乙、丙、丁四种物质。甲是标准状况下密度最小的气体,所以甲是氢气;乙为氯化物,是家庭做菜时必要的调味品,所以乙是氯化钠;a为常见的单质,它的制品在生活中应用极广,其组成元素是合成人体血红蛋白所必需的,所以a是铁;c中含有三种元素,c和d相混时会产生蓝色絮状沉淀物丙,所以丙是氢氧化铜沉淀;b和c反应生成氯化钠,和铁反应生成氢气,所以b是盐酸,c是氢氧化钠,d是硫酸铜或氯化铜。经过验证,推导正确。(1)c的化学式是NaOH。(2)a与b的反应是铁和盐酸反应生成氯化亚铁和氢气,化学方程式是Fe+2HClFeCl2+H2↑。(3)c与d的反应是氯化铜(或硫酸铜)和氢氧化钠反应生成氢氧化铜沉淀和氯化钠(或硫酸钠),反应的基本类型属于复分解反应。
8.(1)H2SO4 H2SO4+Zn(OH)2ZnSO4+2H2O ZnO+H2SO4ZnSO4+H2O
(2)CaO、Ca(OH)2、CaCO3(合理即可)
(1)氢氧化锌、碳酸锌和氧化锌均能与X反应生成硫酸锌,故X是硫酸。
9.(1)2H2O22H2O+O2↑
(2)酸、碱、盐
(1)C是气体,它能使带火星的木条复燃,则C是氧气;A能够生成氧气,则可能是过氧化氢溶液、水、高锰酸钾、氯酸钾,而B与A组成元素相同,且也能生成氧气,所以B是水;A是过氧化氢。(2)A为光合作用的原料之一,可以是水或者二氧化碳,A、B属于不同物质类别,B、C属于相同物质类别,A、B、C含有相同的两种元素,则有以下三种情况:①A是水,水与二氧化硫反应生成亚硫酸(B),亚硫酸与氧气反应生成硫酸(C),水与三氧化硫反应也能生成硫酸,A、B、C有共同的氢元素和氧元素,所以C可以是酸;②A是水,水与氧化钙反应生成氢氧化钙(B),氢氧化钙与碳酸钠反应生成氢氧化钠(C),水与氧化钠反应也能生成氢氧化钠,A、B、C有共同的氢元素和氧元素,所以C可以是碱;③A是二氧化碳,二氧化碳与氢氧化钠反应生成碳酸钠(B),碳酸钠与氢氧化钙反应生成碳酸钙(C),二氧化碳与氢氧化钙反应也能生成碳酸钙,A、B、C有共同的碳元素和氧元素,所以C可以是盐。综上所述,C可能是酸、碱、盐。
10.(1)Fe (2)复分解反应 (3)③
铁、盐酸、氢氧化钙、硫酸铜和氯化镁中,只有氢氧化钙能和盐酸、硫酸铜、氯化镁三种物质发生反应,则E为氢氧化钙、A为铁;A(铁)能和盐酸、硫酸铜发生反应,则B、C为盐酸和硫酸铜中的一种,则D为氯化镁;盐酸和硫酸铜中,盐酸能和镁、氢氧化镁等物质反应生成氯化镁(D),则B为盐酸、C为硫酸铜。(2)C与E是硫酸铜和氢氧化钙之间的反应,属于复分解反应。(3)B为盐酸,能与金属(镁)、金属氧化物(氧化镁)、碱(氢氧化镁)和盐(碳酸镁)发生反应生成氯化镁。
11.(1)碳酸钠、氯化钠
(2)氧化钙、氢氧化钙和碳酸钙
(1)通过实验分析可知:将混合物C、D倒入一个洁净的烧杯中,发现烧杯中有白色沉淀且上层清液呈红色,过滤,得滤液E和1 g滤渣,向滤液E中滴加CaCl2溶液,有白色沉淀生成,说明滤液E中一定含有的溶质是碳酸钠、氯化钠、酚酞,一定没有氯化氢,氢氧化钠可能有也可能没有。(2)根据①称取0.75 g样品,加足量的水充分溶解,过滤得滤液A和0.1 g沉淀B,可以判断原样品的成分中有碳酸钙;那么剩余物是0.65 g;根据③将混合物C、D倒入一个洁净的烧杯中,发现烧杯中有白色沉淀且上层清液呈红色,过滤,得滤液E和1 g滤渣碳酸钙,1 g碳酸钙中钙元素的质量=1 g××100%=0.4 g;根据质量守恒定律,钙元素质量守恒,剩余的0.65 g物质中含有0.4 g钙;假设0.65 g物质都是氧化钙,那么含钙元素的质量=0.65 g××100%≈0.46 g,0.46 g>0.4 g;假设0.65 g物质都是氢氧化钙,那么含钙元素的质量=0.65 g××100%≈0.35 g,0.35 g<0.4 g,因此原样品的成分中还有氧化钙和氢氧化钙。
12.(1)Na2CO3
(2)B中二氧化碳气体与氢氧化钠溶液反应使装置内气压下降,小于外部气压,气流从风哨进入
(3)>
同课章节目录
