化学人教版(2019)选择性必修1 3.3.1盐类水解(共21张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.3.1盐类水解(共21张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 996.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-26 10:38:59 | ||
图片预览





文档简介
(共21张PPT)
第三章 水溶液中的离子反应与平衡
第三节 盐类水解
第一课时 盐类的水解
[环节1]复习建模:将HCl通入水中形成盐酸溶液中的离子行为
溶剂:H2O 溶质 : HCl 电离方程式
微粒间的相互作用 H2O解离了HCl分子,水电离被抑制
溶液中的微粒种类 Cl–、H+、OH–、H2O
微粒数量变化 c(H+)大于c(OH–) Cl–?
宏观的性质(溶液的酸碱性) 酸性
相关化学方程式 无
H2O H+ + OH–
HCl H+ + Cl–
[环节二]
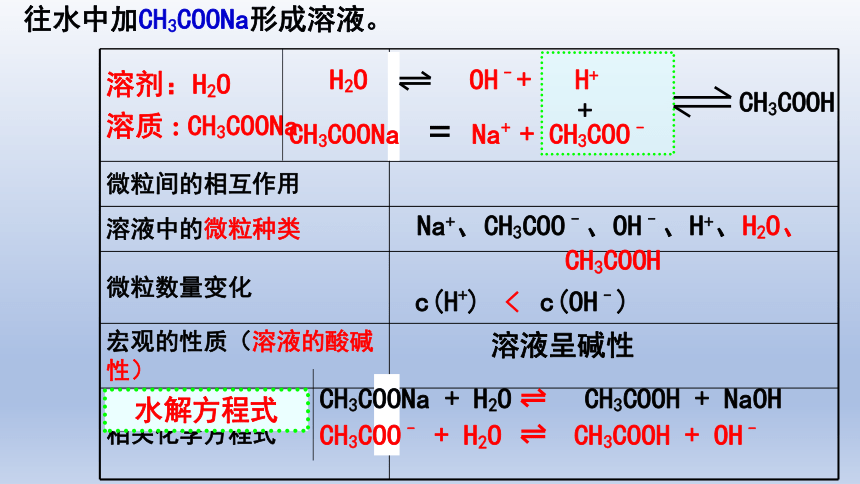
【用模分析】 往水中加CH3COONa形成溶液。
【探究1】
溶剂:H2O 溶质 : CH3COONa
微粒间的相互作用
溶液中的微粒种类
微粒数量变化
宏观的性质(溶液的酸碱性)
相关化学方程式
往水中加CH3COONa形成溶液。
H2O OH–+ H+
CH3COONa Na+ + CH3COO–
+
溶液呈碱性
CH3COOH
Na+、CH3COO–、OH–、H+、H2O、CH3COOH
CH3COONa + H2O CH3COOH + NaOH
CH3COO– + H2O CH3COOH + OH–
水解方程式
c(H+) c(OH–)
<
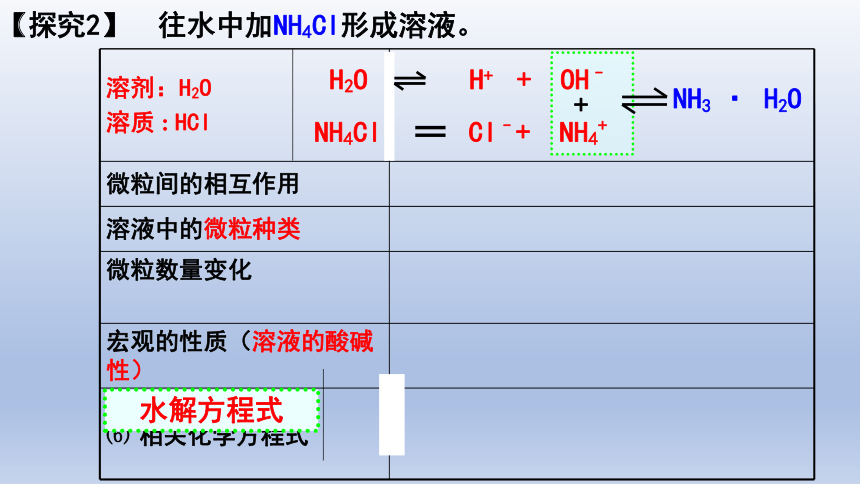
溶剂:H2O 溶质 : HCl
微粒间的相互作用
溶液中的微粒种类
微粒数量变化
宏观的性质(溶液的酸碱性)
⑹ 相关化学方程式
【探究2】 往水中加NH4Cl形成溶液。
H2O H+ + OH–
NH4Cl Cl–+ NH4+
+
NH3 · H2O
水解方程式
[环节三]
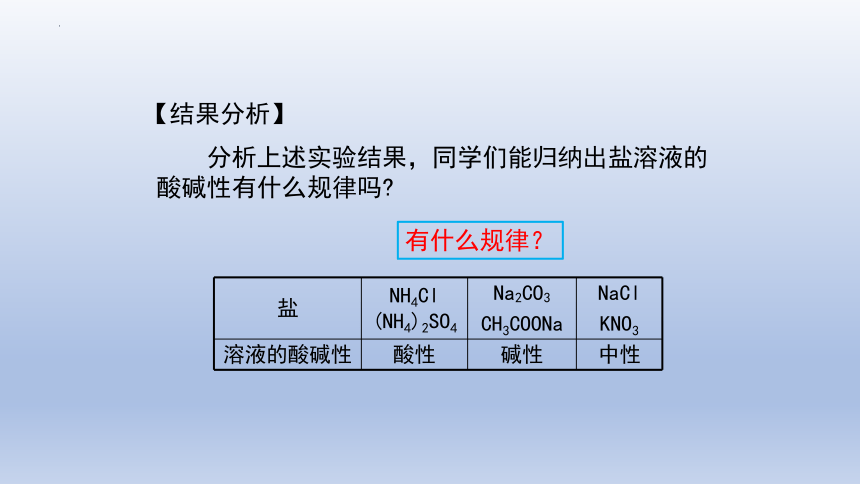
【用模分析】 根据提供的资料分析不同盐溶液呈现不同的性质,并从中找到规律
[寻找规律
先思考如何寻找规律。(从宏观和微观2个角度去分析)
分析上述实验结果,同学们能归纳出盐溶液的酸碱性有什么规律吗
盐 NH4Cl (NH4)2SO4 Na2CO3 CH3COONa NaCl
KNO3
溶液的酸碱性 酸性 碱性 中性
有什么规律?
【结果分析】
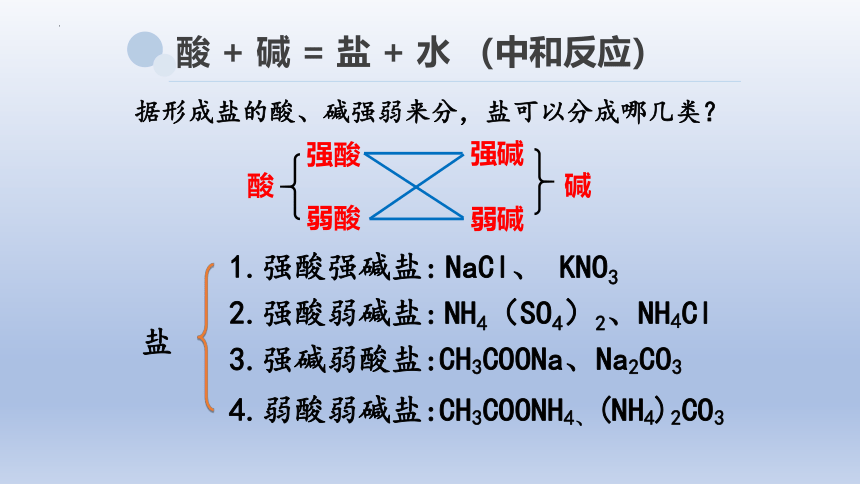
据形成盐的酸、碱强弱来分,盐可以分成哪几类?
盐
1.强酸强碱盐:
2.强酸弱碱盐:
3.强碱弱酸盐:
4.弱酸弱碱盐:
NaCl、 KNO3
NH4(SO4)2、NH4Cl
CH3COONH4、(NH4)2CO3
CH3COONa、Na2CO3
强酸
弱酸
弱碱
强碱
酸
碱
酸 + 碱 = 盐 + 水 (中和反应)
寻找规律
盐的类型与盐溶液酸碱性的关系:
盐的类型 强酸强碱盐 强酸弱碱盐 强碱弱酸盐
盐溶液酸碱性
中性
酸性
碱性
宏观角度:分析上述实验结果,归纳其与盐的类型间的关系,并从微观实质角度寻找原因。
弱碱
弱碱阳离子
弱酸根离子
弱酸
H2O OH- + H+
+
+
盐类的水解
微观角度
盐类的水解
在溶液中盐电离出来的弱离子跟水所电离出来的H+ 或OH–结合生成弱电解质的反应,叫做盐类的水解。
(弱酸、弱碱)
1、定义:
盐易溶,有弱离子。
2、水解的条件:
3、水解的实质:
与加酸、碱比较
盐电离
弱酸的阴离子
弱碱的阳离子
结合H+
结合OH-
生成弱电解质
破坏了水的电离平衡
促进水的电离
c(H+)≠c(OH-)
使盐溶液呈现不同的酸碱性
4.表达、 盐 + 水 酸 + 碱
5、水解的规律:
⑴ 有__就水解;
⑵ 越__越水解;
⑶ 谁__显谁性;同强显__性。
弱
弱
强
中
盐类 实例 能否水解 引起水解的离子 对水的电离 平衡的影响 溶液的
酸碱性
强碱 弱酸盐
强酸 弱碱盐
强酸 强碱盐
能
弱酸的
阴离子
促进水的
电离
碱性
NH4Cl
能
弱碱的
阳离子
促进水的
电离
酸性
NaCl
不能
无
无
中性
记住啦!
CH3COONa
盐 + 水 酸 + 碱
5、水解的特点:
⑴ 可逆
⑵ 吸热
⑶ 一般很微弱
⑷ 水解平衡(动态)
中和
水解
一般不用“↑”或“↓”;
一般不写“ ”,而写“ ”。
,必有弱酸或弱碱生成
⑸ 多元弱酸根离子分步水解,以第一步水解为主。
△H>0
在溶液中,不能发生水解的离子是( )
A、ClO – B、CO3 2 –
C、Fe 3+ D、SO4 2 –
D
下列盐的水溶液中,哪些呈酸性( )
哪些呈碱性( )
① FeCl3 ② NaClO ③ (NH4)2SO4
④ AgNO3 ⑤ Na2S ⑥ K2SO4
①③④
②⑤
课堂专练
问题 FeCl3溶液呈酸性、碱性还是中性?
学以致用
宏观 FeCl3为强酸弱碱盐,溶液呈酸性。
微观 盐电离产生的Fe3+与溶液中的OH-
结合生成弱碱Fe(OH)3,使溶液中
c(H+)>c(OH-),溶液呈酸性。
名师点拨
Na2CO3在水溶液中电离出来的CO32-与水电离出来的H+结合生成HCO3-,HCO3-又与水电离出来的H+结合生成H2CO3,促进水继续电离,溶液中c(H+)Na2CO3的水解分两步进行:
第一步:Na2CO3在水溶液中电离出来的CO32-与水电离出来的H+结合生成HCO3-
第二步:生成HCO3-继续与水电离出来的H+结合成弱电解质H2CO3
3、盐类水解方程式的书写:
(一)一元弱酸强碱盐
如:CH3COONa、NaF
化学方程式:
离子方程式:
CH3COONa + H2O CH3COOH + NaOH
CH3COO– + H2O CH3COOH + OH–
化学方程式:
离子方程式:
NaF + H2O HF + NaOH
F– + H2O HF + OH–
(二)多元弱酸强碱盐
如:Na2CO3、 Na3PO4
离子方程式:
HCO3 – + H2O H2CO3 + OH –
CO3 2– + H2O HCO3 – + OH –
(主)
(次)
Na2CO3溶液中含有的粒子?
5种离子,2种分子。
?
(三)弱碱强酸盐水解
如:NH4Cl、CuSO4、AlCl3
水解的离子方程式:
NH4+ + H2O NH3·H2O + H+
Cu2+ + 2H2O Cu(OH)2 + 2H+
Al 3+ + 3H2O Al(OH)3 + 3H+
(四)多元弱酸酸式酸根的水解与电离的区别:
⑴ NaHCO3
HCO3 – + H2O H2CO3 + OH –
①
②
HCO3 – + H2O CO32– + H3O +
>
∴溶液呈 性
碱
⑵ NaHSO3
HSO3 – + H2O H2SO3 + OH –
①
②
HSO3 – + H2O SO32– + H3O +
<
∴溶液呈 性
酸
① 水解
② 电离
程度:
① 水解
② 电离
程度:
课堂专练
D
第三章 水溶液中的离子反应与平衡
第三节 盐类水解
第一课时 盐类的水解
[环节1]复习建模:将HCl通入水中形成盐酸溶液中的离子行为
溶剂:H2O 溶质 : HCl 电离方程式
微粒间的相互作用 H2O解离了HCl分子,水电离被抑制
溶液中的微粒种类 Cl–、H+、OH–、H2O
微粒数量变化 c(H+)大于c(OH–) Cl–?
宏观的性质(溶液的酸碱性) 酸性
相关化学方程式 无
H2O H+ + OH–
HCl H+ + Cl–
[环节二]
【用模分析】 往水中加CH3COONa形成溶液。
【探究1】
溶剂:H2O 溶质 : CH3COONa
微粒间的相互作用
溶液中的微粒种类
微粒数量变化
宏观的性质(溶液的酸碱性)
相关化学方程式
往水中加CH3COONa形成溶液。
H2O OH–+ H+
CH3COONa Na+ + CH3COO–
+
溶液呈碱性
CH3COOH
Na+、CH3COO–、OH–、H+、H2O、CH3COOH
CH3COONa + H2O CH3COOH + NaOH
CH3COO– + H2O CH3COOH + OH–
水解方程式
c(H+) c(OH–)
<
溶剂:H2O 溶质 : HCl
微粒间的相互作用
溶液中的微粒种类
微粒数量变化
宏观的性质(溶液的酸碱性)
⑹ 相关化学方程式
【探究2】 往水中加NH4Cl形成溶液。
H2O H+ + OH–
NH4Cl Cl–+ NH4+
+
NH3 · H2O
水解方程式
[环节三]
【用模分析】 根据提供的资料分析不同盐溶液呈现不同的性质,并从中找到规律
[寻找规律
先思考如何寻找规律。(从宏观和微观2个角度去分析)
分析上述实验结果,同学们能归纳出盐溶液的酸碱性有什么规律吗
盐 NH4Cl (NH4)2SO4 Na2CO3 CH3COONa NaCl
KNO3
溶液的酸碱性 酸性 碱性 中性
有什么规律?
【结果分析】
据形成盐的酸、碱强弱来分,盐可以分成哪几类?
盐
1.强酸强碱盐:
2.强酸弱碱盐:
3.强碱弱酸盐:
4.弱酸弱碱盐:
NaCl、 KNO3
NH4(SO4)2、NH4Cl
CH3COONH4、(NH4)2CO3
CH3COONa、Na2CO3
强酸
弱酸
弱碱
强碱
酸
碱
酸 + 碱 = 盐 + 水 (中和反应)
寻找规律
盐的类型与盐溶液酸碱性的关系:
盐的类型 强酸强碱盐 强酸弱碱盐 强碱弱酸盐
盐溶液酸碱性
中性
酸性
碱性
宏观角度:分析上述实验结果,归纳其与盐的类型间的关系,并从微观实质角度寻找原因。
弱碱
弱碱阳离子
弱酸根离子
弱酸
H2O OH- + H+
+
+
盐类的水解
微观角度
盐类的水解
在溶液中盐电离出来的弱离子跟水所电离出来的H+ 或OH–结合生成弱电解质的反应,叫做盐类的水解。
(弱酸、弱碱)
1、定义:
盐易溶,有弱离子。
2、水解的条件:
3、水解的实质:
与加酸、碱比较
盐电离
弱酸的阴离子
弱碱的阳离子
结合H+
结合OH-
生成弱电解质
破坏了水的电离平衡
促进水的电离
c(H+)≠c(OH-)
使盐溶液呈现不同的酸碱性
4.表达、 盐 + 水 酸 + 碱
5、水解的规律:
⑴ 有__就水解;
⑵ 越__越水解;
⑶ 谁__显谁性;同强显__性。
弱
弱
强
中
盐类 实例 能否水解 引起水解的离子 对水的电离 平衡的影响 溶液的
酸碱性
强碱 弱酸盐
强酸 弱碱盐
强酸 强碱盐
能
弱酸的
阴离子
促进水的
电离
碱性
NH4Cl
能
弱碱的
阳离子
促进水的
电离
酸性
NaCl
不能
无
无
中性
记住啦!
CH3COONa
盐 + 水 酸 + 碱
5、水解的特点:
⑴ 可逆
⑵ 吸热
⑶ 一般很微弱
⑷ 水解平衡(动态)
中和
水解
一般不用“↑”或“↓”;
一般不写“ ”,而写“ ”。
,必有弱酸或弱碱生成
⑸ 多元弱酸根离子分步水解,以第一步水解为主。
△H>0
在溶液中,不能发生水解的离子是( )
A、ClO – B、CO3 2 –
C、Fe 3+ D、SO4 2 –
D
下列盐的水溶液中,哪些呈酸性( )
哪些呈碱性( )
① FeCl3 ② NaClO ③ (NH4)2SO4
④ AgNO3 ⑤ Na2S ⑥ K2SO4
①③④
②⑤
课堂专练
问题 FeCl3溶液呈酸性、碱性还是中性?
学以致用
宏观 FeCl3为强酸弱碱盐,溶液呈酸性。
微观 盐电离产生的Fe3+与溶液中的OH-
结合生成弱碱Fe(OH)3,使溶液中
c(H+)>c(OH-),溶液呈酸性。
名师点拨
Na2CO3在水溶液中电离出来的CO32-与水电离出来的H+结合生成HCO3-,HCO3-又与水电离出来的H+结合生成H2CO3,促进水继续电离,溶液中c(H+)
第一步:Na2CO3在水溶液中电离出来的CO32-与水电离出来的H+结合生成HCO3-
第二步:生成HCO3-继续与水电离出来的H+结合成弱电解质H2CO3
3、盐类水解方程式的书写:
(一)一元弱酸强碱盐
如:CH3COONa、NaF
化学方程式:
离子方程式:
CH3COONa + H2O CH3COOH + NaOH
CH3COO– + H2O CH3COOH + OH–
化学方程式:
离子方程式:
NaF + H2O HF + NaOH
F– + H2O HF + OH–
(二)多元弱酸强碱盐
如:Na2CO3、 Na3PO4
离子方程式:
HCO3 – + H2O H2CO3 + OH –
CO3 2– + H2O HCO3 – + OH –
(主)
(次)
Na2CO3溶液中含有的粒子?
5种离子,2种分子。
?
(三)弱碱强酸盐水解
如:NH4Cl、CuSO4、AlCl3
水解的离子方程式:
NH4+ + H2O NH3·H2O + H+
Cu2+ + 2H2O Cu(OH)2 + 2H+
Al 3+ + 3H2O Al(OH)3 + 3H+
(四)多元弱酸酸式酸根的水解与电离的区别:
⑴ NaHCO3
HCO3 – + H2O H2CO3 + OH –
①
②
HCO3 – + H2O CO32– + H3O +
>
∴溶液呈 性
碱
⑵ NaHSO3
HSO3 – + H2O H2SO3 + OH –
①
②
HSO3 – + H2O SO32– + H3O +
<
∴溶液呈 性
酸
① 水解
② 电离
程度:
① 水解
② 电离
程度:
课堂专练
D
