盐类的水解教学设计
图片预览

文档简介
盐类的水解教学设计
一、课标要求
认识盐类水解的原理.
二、教学目标
1、知识与技能
认识盐类水解的定义,发生的条件和本质以及水解的规律。
2、过程与方法
通过实验并运用归纳法分析盐类的溶液呈不同酸碱性的原因;从微观角度探究盐类水解的本质原因,让学生在学习过程中掌握从宏观到微观、从静态到动态的探究方法。
3、情感、态度与价值观
通过探究不同的盐溶液呈现不同酸碱性的本质原因,学会透过现象看本质;领悟矛盾的“对立与统一”以及矛盾 “特殊性与普遍性”的哲学观点。
三、教学重、难点
探究盐类水解的本质
四、设计思路
本节内容分两阶段进行,第一部分是寻找规律,从学生比较熟悉的盐类物质入手,引导学生通过实验并运用归纳法分析盐类的组成与盐溶液酸、碱性的对应关系,找出找出盐类溶液酸碱性的规律。第二部分是分析原因,引导学生以水的电离平衡为基础,分析盐类电离出的阴、阳离子与水电离出的H+和OH-结合成弱酸或弱碱的趋势,明确不同盐溶液呈现不同酸碱性的本质原因。分析盐类水解的条件。让学生在学习过程中掌握从宏观到微观、从静态到动态的探究方法,领悟矛盾的“对立与统一”以及矛盾 “特殊性与普遍性”的哲学观点。
五、教学过程:
教学进程 教师活动 学生活动 活动目标及说明
课堂引入 演示实验:镁粉加入到NH4Cl溶液中,会有何现象产生?说明溶液呈酸性?还是碱性呢? 观察思考 激发兴趣引入新问题实验操作示范
提问 如何检验NH4Cl溶液的酸碱性 思考、回答: 测定NH4Cl溶液的PH值。一个学生演示该实验
设问 其他的盐溶液有没有类似的情况呢?。若有,它们之间又有什么规规律呢? 思考 引入课堂探究
实验探究 试用pH试纸检验下列溶液的酸碱性。完成表一,找出其中规律。CH3COONa 、Na2S 、Na2CO3、NH4Cl、Al Cl3 、CuSO4NaCl 、KNO3 分组实验、记录(附表一)汇报实验结果(教师总表)交流分析、归纳、填表 培养实验探究能力。培养归纳问题、总结规律的能力
过渡 溶液的酸碱性与溶液中的 C(H+)、C(OH-)的大小有关吗? 思考 C(H+) > C(OH-)酸性C(H+)设问 (1)盐溶液中的H+和OH-从何而来? (2)不是盐(举例:NH4Cl是强电解质,在水溶液中NH4Cl=NH4++Cl-)而是水:H2O≒H++OH- 引导思考
问题探究 到底是什么原因导致了某些盐溶液中C(H+)和C(OH-)不等?请根据表二提示,分组讨论,共同找出原因 [思考与交流]:根据下表,对在水中分别加入三类不同盐的过程中,溶液的各种粒子变化情况进行比较、分析,试着从中找出不同类型盐溶液呈现不同酸碱性的原因。(见附表二) 引导思考宏观到微观;静态到动态
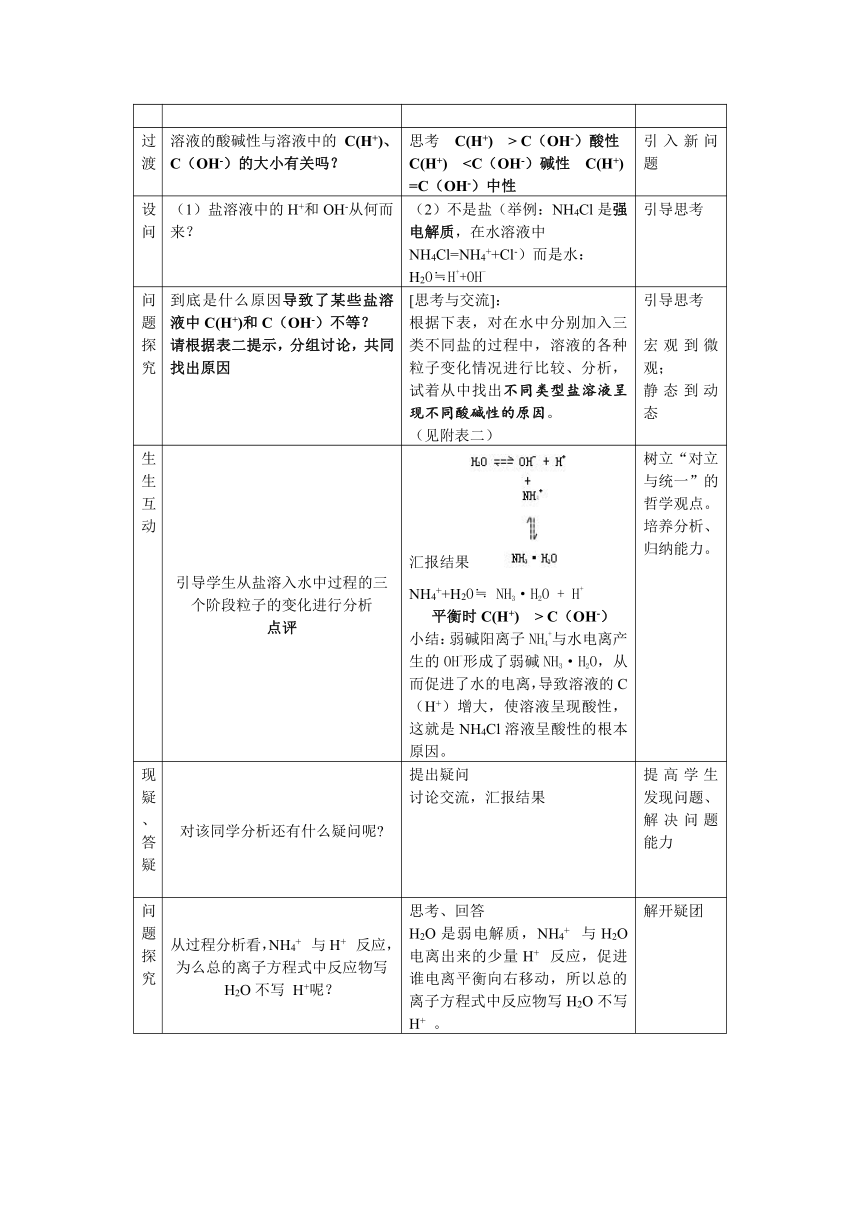
生生互动 引导学生从盐溶入水中过程的三个阶段粒子的变化进行分析点评 汇报结果NH4++H2O≒ NH3·H2O + H+平衡时C(H+) > C(OH-)小结:弱碱阳离子NH4+与水电离产生的OH-形成了弱碱NH3·H2O,从而促进了水的电离,导致溶液的C(H+)增大,使溶液呈现酸性,这就是NH4Cl溶液呈酸性的根本原因。 树立“对立与统一”的哲学观点。培养分析、归纳能力。
现疑、答疑 对该同学分析还有什么疑问呢 提出疑问讨论交流,汇报结果 提高学生发现问题、解决问题能力
问题探究 从过程分析看,NH4+ 与H+ 反应,为么总的离子方程式中反应物写H2O不写 H+呢? 思考、回答H2O是弱电解质,NH4+ 与H2O电离出来的少量H+ 反应,促进谁电离平衡向右移动,所以总的离子方程式中反应物写H2O不写 H+ 。 解开疑团
播放动画 播放NH4Cl溶液粒子变化的动画 加深对整个粒子变化过程的理解 微观变化过程形象化、具体化
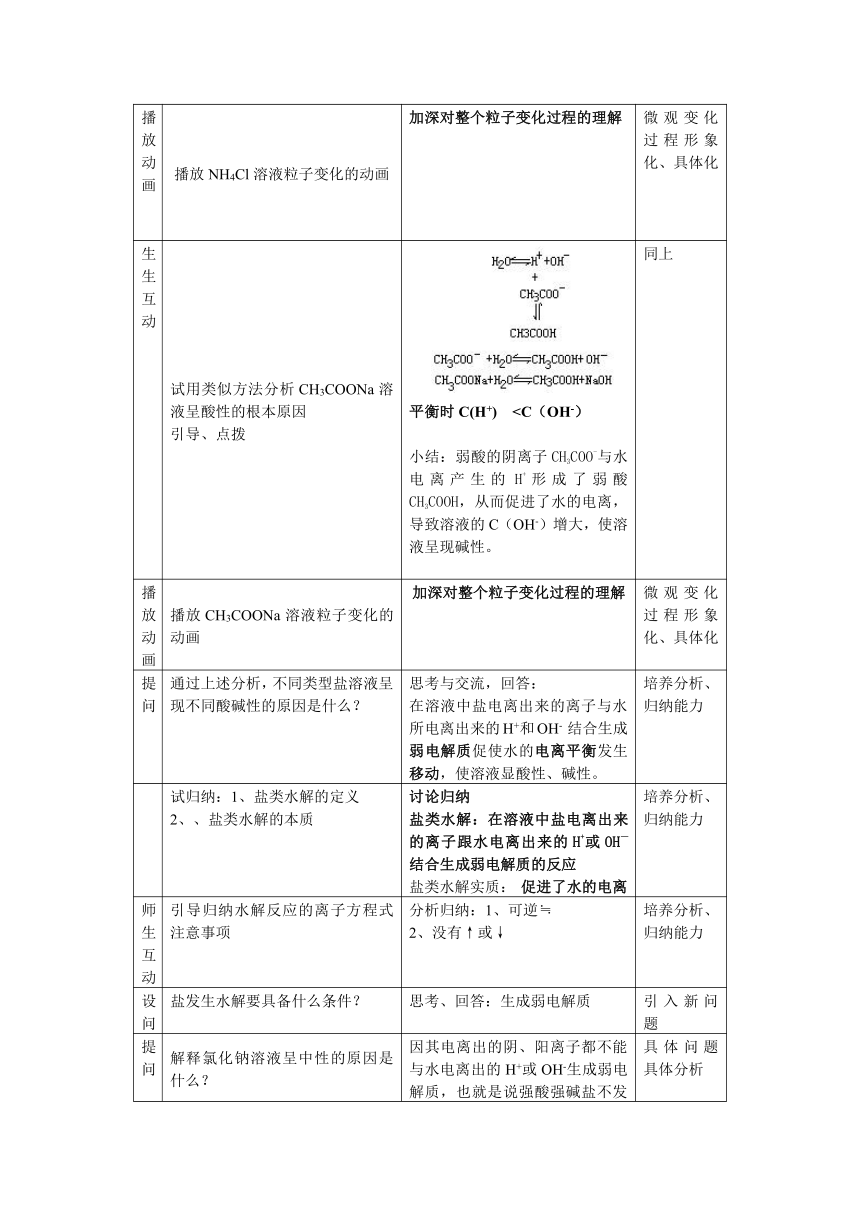
生生互动 试用类似方法分析CH3COONa溶液呈酸性的根本原因引导、点拨 平衡时C(H+)播放动画 播放CH3COONa溶液粒子变化的动画 加深对整个粒子变化过程的理解 微观变化过程形象化、具体化
提问 通过上述分析,不同类型盐溶液呈现不同酸碱性的原因是什么? 思考与交流,回答:在溶液中盐电离出来的离子与水所电离出来的H+和OH- 结合生成弱电解质促使水的电离平衡发生移动,使溶液显酸性、碱性。 培养分析、归纳能力
试归纳:1、盐类水解的定义2、、盐类水解的本质 讨论归纳盐类水解:在溶液中盐电离出来的离子跟水电离出来的H+或OH—结合生成弱电解质的反应盐类水解实质: 促进了水的电离 培养分析、归纳能力
师生互动 引导归纳水解反应的离子方程式注意事项 分析归纳:1、可逆≒2、没有↑或↓ 培养分析、归纳能力
设问 盐发生水解要具备什么条件? 思考、回答:生成弱电解质 引入新问题
提问 解释氯化钠溶液呈中性的原因是什么? 因其电离出的阴、阳离子都不能与水电离出的H+或OH-生成弱电解质,也就是说强酸强碱盐不发生水解,溶液中C(H+)=C(OH-) 具体问题具体分析
问题探究 从水解的离子看盐类水解还有规律? 思考,回答盐发生水解还有规律-谁弱谁水解 完善知识
知识应用 1、镁粉加入到NH4Cl溶液中,为什么?(以离子方程式和简要的文字说明)产生大量的氢气2、等物质的量浓度的CH3COOH(aq) 、CH3COONa(aq)、(NH4)2SO4(aq) NH3·H2O( aq) 、KCl( aq),PH由大到的小排列的顺序是 思考、写出结果。Mg 粉与NH4+ 水解产生的H+反应,使NH4+ 水解反应不断向右进行,产生大量的H+,从而产生大量的氢气。总的离子方程式2NH4+ +2H2O+ Mg ≒2 NH3·H2O+Mg2+ +H2↑2、NH3·H2O( aq) 、、CH3COONa(aq)、KCl( aq)、(NH4)2SO4(aq)、CH3COOH(aq) 巩固知识
课堂小结 1、知识总结2、方法总结 1、知识总结:盐类水解(1)定义(2)条件(3)本质(4)规律2、方法总结:实验探究、从宏观到微观、从静态到动态的探究方法 知识升华培养归纳能力
布置作业 1、《优化设计》P40 -1、2、3、52、明矾为什么能净水?(以离子方程式和简要的文字说明)3、草木灰(主要成分为K2CO3)和铵态氮肥(如主要成分为NH4Cl)为什么不能混合使用 认真完成 巩固知识
附一(表一):
(教师汇总表)
加入的盐 pH(> 、<或=7) 溶液酸碱性 该盐的类型 规律
CH3COONa 、Na2S 、Na2CO3 pH> 7 碱性 强碱弱酸盐 谁强显谁性
NH4Cl、Al Cl3 、CuSO4 pH<7 酸性 强酸弱碱盐
NaCl 、KNO3 pH=7 中性 强酸强碱盐 两强显中性
附二(表二):
加入盐分析内容 NH4Cl CH3COONa NaCl
加入盐前溶液(水)中粒子 H+ OH- H+ OH- H+ OH-
刚加入盐时溶液中的粒子 NH4+、Cl- H+ OH- CH3COO- Na+ H+ OH- Na+ Cl— H+ OH-
进一步的粒子变化 有无弱电解质生成 NH3·H2O CH3COOH 无
水的电离平衡移动 向右 向右 不移动
C(H+)、C(OH-)的相对大小 C(H+) >C(OH-) C(H+)概括 电离方程式或离子方程式 NH4++H2O≒ NH3·H2O + H+ H2O≒H++OH-NaCl =Na+ + Cl—
板书设计:第三节 盐类水解
1、定义 : 盐与水的作用
2、条件:生成弱电解质
3、本质:促进了水的电离
4、规律:谁弱谁水解,谁强显谁性
堂上练习参考答案:
Mg 粉与NH4+ 水解产生的H+反应,使NH4+ 水解反应不断向右进行,产生大量的H+,从而产生大量的氢气。总的离子方程式2NH4+ +2H2O+ Mg ≒2 NH3·H2O+Mg2+ +H2↑
2、NH3·H2O( aq) 、、CH3COONa(aq)、KCl( aq)、(NH4)2SO4(aq)、CH3COOH(aq)
一、课标要求
认识盐类水解的原理.
二、教学目标
1、知识与技能
认识盐类水解的定义,发生的条件和本质以及水解的规律。
2、过程与方法
通过实验并运用归纳法分析盐类的溶液呈不同酸碱性的原因;从微观角度探究盐类水解的本质原因,让学生在学习过程中掌握从宏观到微观、从静态到动态的探究方法。
3、情感、态度与价值观
通过探究不同的盐溶液呈现不同酸碱性的本质原因,学会透过现象看本质;领悟矛盾的“对立与统一”以及矛盾 “特殊性与普遍性”的哲学观点。
三、教学重、难点
探究盐类水解的本质
四、设计思路
本节内容分两阶段进行,第一部分是寻找规律,从学生比较熟悉的盐类物质入手,引导学生通过实验并运用归纳法分析盐类的组成与盐溶液酸、碱性的对应关系,找出找出盐类溶液酸碱性的规律。第二部分是分析原因,引导学生以水的电离平衡为基础,分析盐类电离出的阴、阳离子与水电离出的H+和OH-结合成弱酸或弱碱的趋势,明确不同盐溶液呈现不同酸碱性的本质原因。分析盐类水解的条件。让学生在学习过程中掌握从宏观到微观、从静态到动态的探究方法,领悟矛盾的“对立与统一”以及矛盾 “特殊性与普遍性”的哲学观点。
五、教学过程:
教学进程 教师活动 学生活动 活动目标及说明
课堂引入 演示实验:镁粉加入到NH4Cl溶液中,会有何现象产生?说明溶液呈酸性?还是碱性呢? 观察思考 激发兴趣引入新问题实验操作示范
提问 如何检验NH4Cl溶液的酸碱性 思考、回答: 测定NH4Cl溶液的PH值。一个学生演示该实验
设问 其他的盐溶液有没有类似的情况呢?。若有,它们之间又有什么规规律呢? 思考 引入课堂探究
实验探究 试用pH试纸检验下列溶液的酸碱性。完成表一,找出其中规律。CH3COONa 、Na2S 、Na2CO3、NH4Cl、Al Cl3 、CuSO4NaCl 、KNO3 分组实验、记录(附表一)汇报实验结果(教师总表)交流分析、归纳、填表 培养实验探究能力。培养归纳问题、总结规律的能力
过渡 溶液的酸碱性与溶液中的 C(H+)、C(OH-)的大小有关吗? 思考 C(H+) > C(OH-)酸性C(H+)
问题探究 到底是什么原因导致了某些盐溶液中C(H+)和C(OH-)不等?请根据表二提示,分组讨论,共同找出原因 [思考与交流]:根据下表,对在水中分别加入三类不同盐的过程中,溶液的各种粒子变化情况进行比较、分析,试着从中找出不同类型盐溶液呈现不同酸碱性的原因。(见附表二) 引导思考宏观到微观;静态到动态
生生互动 引导学生从盐溶入水中过程的三个阶段粒子的变化进行分析点评 汇报结果NH4++H2O≒ NH3·H2O + H+平衡时C(H+) > C(OH-)小结:弱碱阳离子NH4+与水电离产生的OH-形成了弱碱NH3·H2O,从而促进了水的电离,导致溶液的C(H+)增大,使溶液呈现酸性,这就是NH4Cl溶液呈酸性的根本原因。 树立“对立与统一”的哲学观点。培养分析、归纳能力。
现疑、答疑 对该同学分析还有什么疑问呢 提出疑问讨论交流,汇报结果 提高学生发现问题、解决问题能力
问题探究 从过程分析看,NH4+ 与H+ 反应,为么总的离子方程式中反应物写H2O不写 H+呢? 思考、回答H2O是弱电解质,NH4+ 与H2O电离出来的少量H+ 反应,促进谁电离平衡向右移动,所以总的离子方程式中反应物写H2O不写 H+ 。 解开疑团
播放动画 播放NH4Cl溶液粒子变化的动画 加深对整个粒子变化过程的理解 微观变化过程形象化、具体化
生生互动 试用类似方法分析CH3COONa溶液呈酸性的根本原因引导、点拨 平衡时C(H+)
提问 通过上述分析,不同类型盐溶液呈现不同酸碱性的原因是什么? 思考与交流,回答:在溶液中盐电离出来的离子与水所电离出来的H+和OH- 结合生成弱电解质促使水的电离平衡发生移动,使溶液显酸性、碱性。 培养分析、归纳能力
试归纳:1、盐类水解的定义2、、盐类水解的本质 讨论归纳盐类水解:在溶液中盐电离出来的离子跟水电离出来的H+或OH—结合生成弱电解质的反应盐类水解实质: 促进了水的电离 培养分析、归纳能力
师生互动 引导归纳水解反应的离子方程式注意事项 分析归纳:1、可逆≒2、没有↑或↓ 培养分析、归纳能力
设问 盐发生水解要具备什么条件? 思考、回答:生成弱电解质 引入新问题
提问 解释氯化钠溶液呈中性的原因是什么? 因其电离出的阴、阳离子都不能与水电离出的H+或OH-生成弱电解质,也就是说强酸强碱盐不发生水解,溶液中C(H+)=C(OH-) 具体问题具体分析
问题探究 从水解的离子看盐类水解还有规律? 思考,回答盐发生水解还有规律-谁弱谁水解 完善知识
知识应用 1、镁粉加入到NH4Cl溶液中,为什么?(以离子方程式和简要的文字说明)产生大量的氢气2、等物质的量浓度的CH3COOH(aq) 、CH3COONa(aq)、(NH4)2SO4(aq) NH3·H2O( aq) 、KCl( aq),PH由大到的小排列的顺序是 思考、写出结果。Mg 粉与NH4+ 水解产生的H+反应,使NH4+ 水解反应不断向右进行,产生大量的H+,从而产生大量的氢气。总的离子方程式2NH4+ +2H2O+ Mg ≒2 NH3·H2O+Mg2+ +H2↑2、NH3·H2O( aq) 、、CH3COONa(aq)、KCl( aq)、(NH4)2SO4(aq)、CH3COOH(aq) 巩固知识
课堂小结 1、知识总结2、方法总结 1、知识总结:盐类水解(1)定义(2)条件(3)本质(4)规律2、方法总结:实验探究、从宏观到微观、从静态到动态的探究方法 知识升华培养归纳能力
布置作业 1、《优化设计》P40 -1、2、3、52、明矾为什么能净水?(以离子方程式和简要的文字说明)3、草木灰(主要成分为K2CO3)和铵态氮肥(如主要成分为NH4Cl)为什么不能混合使用 认真完成 巩固知识
附一(表一):
(教师汇总表)
加入的盐 pH(> 、<或=7) 溶液酸碱性 该盐的类型 规律
CH3COONa 、Na2S 、Na2CO3 pH> 7 碱性 强碱弱酸盐 谁强显谁性
NH4Cl、Al Cl3 、CuSO4 pH<7 酸性 强酸弱碱盐
NaCl 、KNO3 pH=7 中性 强酸强碱盐 两强显中性
附二(表二):
加入盐分析内容 NH4Cl CH3COONa NaCl
加入盐前溶液(水)中粒子 H+ OH- H+ OH- H+ OH-
刚加入盐时溶液中的粒子 NH4+、Cl- H+ OH- CH3COO- Na+ H+ OH- Na+ Cl— H+ OH-
进一步的粒子变化 有无弱电解质生成 NH3·H2O CH3COOH 无
水的电离平衡移动 向右 向右 不移动
C(H+)、C(OH-)的相对大小 C(H+) >C(OH-) C(H+)
板书设计:第三节 盐类水解
1、定义 : 盐与水的作用
2、条件:生成弱电解质
3、本质:促进了水的电离
4、规律:谁弱谁水解,谁强显谁性
堂上练习参考答案:
Mg 粉与NH4+ 水解产生的H+反应,使NH4+ 水解反应不断向右进行,产生大量的H+,从而产生大量的氢气。总的离子方程式2NH4+ +2H2O+ Mg ≒2 NH3·H2O+Mg2+ +H2↑
2、NH3·H2O( aq) 、、CH3COONa(aq)、KCl( aq)、(NH4)2SO4(aq)、CH3COOH(aq)
