2023年普通高中化学学业水平考试学考复习——专题2 离子反应(23张ppt)
文档属性
| 名称 | 2023年普通高中化学学业水平考试学考复习——专题2 离子反应(23张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-27 14:34:42 | ||
图片预览







文档简介
(共23张PPT)
组织建设
化学 · 学考
专题2 离子反应
【学业水平目标】
1.了解电解质的概念,认识酸、碱、盐等电解质在水溶液中或熔融状态下的电离。
2.会书写电解质的电离方程式。
3.能书写离子方程式,并能判断离子方程式的正误。
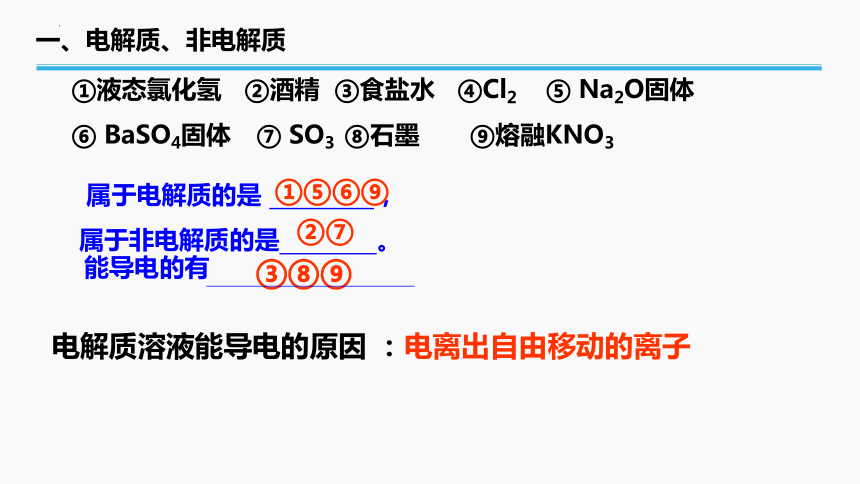
①液态氯化氢 ②酒精 ③食盐水 ④Cl2 ⑤ Na2O固体
⑥ BaSO4固体 ⑦ SO3 ⑧石墨 ⑨熔融KNO3
属于电解质的是 ,
属于非电解质的是 。
能导电的有
③⑧⑨
②⑦
①⑤⑥⑨
电解质溶液能导电的原因 :电离出自由移动的离子
一、电解质、非电解质
(1)不是电解质的物质不一定是非电解质。
单质和混合物既不是电解质也不是非电解质。如Fe、Cu、石墨等是单质,而稀盐酸属于混合物。
(2)一定条件下,电解质不一定导电。
如电解质BaSO4等不易溶于水,其水溶液导电性差,熔融条件下可以导电;而电解质HCl液态时不导电,溶于水才导电。
(3)溶于水能导电的化合物不一定是电解质。
如CO2、SO2、NH3的水溶液能导电,但CO2、SO2、NH3自身不电离,不是电解质,H2CO3、H2SO3、NH3·H2O是电解质。
易错辨析
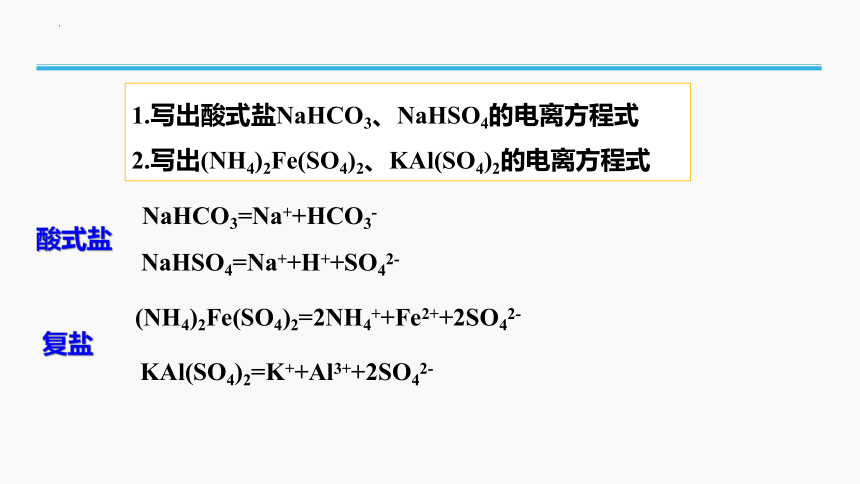
1.写出酸式盐NaHCO3、NaHSO4的电离方程式
2.写出(NH4)2Fe(SO4)2、KAl(SO4)2的电离方程式
NaHCO3=Na++HCO3-
NaHSO4=Na++H++SO42-
(NH4)2Fe(SO4)2=2NH4++Fe2++2SO42-
KAl(SO4)2=K++Al3++2SO42-
酸式盐
复盐
辨析
(1)Cl2的水溶液能导电,所以Cl2是电解质( )
(2)BaSO4的水溶液不易导电,所以BaSO4是弱电解质( )
(3)CO2、NH3溶于水均能导电,所以二者均为电解质( )
(4)电解质发生电离,是在通电条件下才发生的( )
×
×
×
×
(5)硫酸在水溶液中能完全电离,所以稀硫酸是强电解质( )
(6)强电解质都是离子化合物,弱电解质都是共价化合物( )
(7)NaCl是电解质,但NaCl固体不能导电( )
(8)强电解质溶液导电性比弱电解质溶液导电性强( )
(9)NaHSO4在水溶液中可以电离出H+,所以NaHSO4属于酸( )
×
×
√
×
×
2.(2021·浙江7月学考)下列物质属于电解质的是( )
A.NaCl溶液 B.Cu
C.CH4 D.H2SO4
D
3.(2021·浙江1月学考)下列物质属于强电解质的是( )
A.KOH B.H2CO3
C.SO3 D.C2H6
A
4.(2020·浙江1月学考,7)下列属于强电解质的是( )
A.Al B.CH3OH
C.NH3·H2O D.BaSO4
D
(1)NaHCO3与HCl
(2)NaHCO3与NaOH
3.写出下列离子反应的离子方程式
(3)Na与水
(4)CuO溶于盐酸
HCO3-+H+=CO2↑+H2O
HCO3-+OH-=CO32-+H2O
2Na++2H2O=2Na++2OH-+H2 ↑
CuO+2H+=Cu2++H2O
(8)硫酸与氢氧化钡溶液
(7)醋酸溶液与氨水混合
(6)醋酸溶液与NaOH溶液混合
(5)稀硝酸和KOH溶液混合
H++OH-=H2O
CH3COOH+OH-=CH3COO-+H2O
CH3COOH+ NH3·H2O=NH4++ CH3COO-+H2O
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
二、离子反应
5.(2021·浙江7月学考)下列方程式书写不正确的是( )
A
6.(2021·浙江1月学考)下列方程式书写不正确的是( )
C
7.(2020·浙江7月学考)下列方程式书写正确的是( )
A.醋酸的电离方程式:CH3COOH===CH3COO-+H+
B.钠与水反应的离子方程式:Na+2H2O===Na++2OH-+H2↑
C.用过量氨水吸收二氧化硫气体:NH3·H2O+SO2===NH4HSO3
D.乙烯使溴的四氯化碳溶液褪色:CH2===CH2+Br2―→CH2BrCH2Br
D
8.(2019·浙江11月学考)能正确表示下列变化的离子方程式是( )
A
9.(2019·浙江4月选考)不能正确表示下列变化的离子方程式是( )
D
(2020·浙江7月学考)某固体混合物X可能含有Cu、Fe、Fe2O3、Ca(OH)2和Na2CO3中的几种。为确定其组成,某同学进行了如下实验:
已知:向溶液B中滴加KSCN溶液,未出现红色。
下列推断正确的是( )
A.固体混合物X中一定含Ca(OH)2和Na2CO3
B.固体混合物X中若含Cu,则一定还含Fe2O3
C.气体B一定是纯净物
D.溶液B中一定含2种金属阳离子
[变式训练1] (2020·浙江1月学考)某固体X可能含有FeO、Fe2O3、MnO2、K2SO3、Na2CO3、NaClO、K2SO4中的一种或几种物质,进行如下实验以确定其组成:
下列有关说法正确的是( )
A.若固体X中不含K2SO4,则一定含NaClO
B.固体X中一定含有Fe2O3
C.滤液A中一定含有Na+
D.气体B一定是纯净物
如离子间相互间可以反应,则不能大量共存:
如(1)产生沉淀(包括微溶物)、气体、难电离物质
(2)发生氧化还原反应等。
还需注意下列情况
(1)溶液的颜色(与透明无关)
(2)溶液的酸碱性
Cu2+:蓝色,Fe3+:黄色;Fe2+ :浅绿色 MnO4-:紫红色
如:强碱性条件下,Ca2+不能大量存在
三、离子共存的判断
D
11.(2021·浙江金华高一月考,17)下列可以大量共存且溶液是无色的离子组是
( )
D
四、常见离子的检验和推断
12.(2019·浙江11月学考)通过实验得出的结论正确的是( )
C
13.(2017·浙江11月学考)取某固体样品,进行如下实验
①取一定量的样品,加足量水充分溶解,过滤得到滤液和滤渣;
②取少量滤液,加入BaCl2溶液,有白色沉淀产生;
③取少量滤渣,加入稀盐酸,滤渣全部溶解,同时有气体产生。
根据上述实验现象,该固体样品的成分可能是( )
A.K2SO4、Ba(OH)2、Na2CO3 B.Na2CO3、AgNO3、KNO3
C.K2CO3、NaCl、Ba(NO3)2 D.KNO3、MgCl2、NaOH
C
组织建设
化学 · 学考
专题2 离子反应
【学业水平目标】
1.了解电解质的概念,认识酸、碱、盐等电解质在水溶液中或熔融状态下的电离。
2.会书写电解质的电离方程式。
3.能书写离子方程式,并能判断离子方程式的正误。
①液态氯化氢 ②酒精 ③食盐水 ④Cl2 ⑤ Na2O固体
⑥ BaSO4固体 ⑦ SO3 ⑧石墨 ⑨熔融KNO3
属于电解质的是 ,
属于非电解质的是 。
能导电的有
③⑧⑨
②⑦
①⑤⑥⑨
电解质溶液能导电的原因 :电离出自由移动的离子
一、电解质、非电解质
(1)不是电解质的物质不一定是非电解质。
单质和混合物既不是电解质也不是非电解质。如Fe、Cu、石墨等是单质,而稀盐酸属于混合物。
(2)一定条件下,电解质不一定导电。
如电解质BaSO4等不易溶于水,其水溶液导电性差,熔融条件下可以导电;而电解质HCl液态时不导电,溶于水才导电。
(3)溶于水能导电的化合物不一定是电解质。
如CO2、SO2、NH3的水溶液能导电,但CO2、SO2、NH3自身不电离,不是电解质,H2CO3、H2SO3、NH3·H2O是电解质。
易错辨析
1.写出酸式盐NaHCO3、NaHSO4的电离方程式
2.写出(NH4)2Fe(SO4)2、KAl(SO4)2的电离方程式
NaHCO3=Na++HCO3-
NaHSO4=Na++H++SO42-
(NH4)2Fe(SO4)2=2NH4++Fe2++2SO42-
KAl(SO4)2=K++Al3++2SO42-
酸式盐
复盐
辨析
(1)Cl2的水溶液能导电,所以Cl2是电解质( )
(2)BaSO4的水溶液不易导电,所以BaSO4是弱电解质( )
(3)CO2、NH3溶于水均能导电,所以二者均为电解质( )
(4)电解质发生电离,是在通电条件下才发生的( )
×
×
×
×
(5)硫酸在水溶液中能完全电离,所以稀硫酸是强电解质( )
(6)强电解质都是离子化合物,弱电解质都是共价化合物( )
(7)NaCl是电解质,但NaCl固体不能导电( )
(8)强电解质溶液导电性比弱电解质溶液导电性强( )
(9)NaHSO4在水溶液中可以电离出H+,所以NaHSO4属于酸( )
×
×
√
×
×
2.(2021·浙江7月学考)下列物质属于电解质的是( )
A.NaCl溶液 B.Cu
C.CH4 D.H2SO4
D
3.(2021·浙江1月学考)下列物质属于强电解质的是( )
A.KOH B.H2CO3
C.SO3 D.C2H6
A
4.(2020·浙江1月学考,7)下列属于强电解质的是( )
A.Al B.CH3OH
C.NH3·H2O D.BaSO4
D
(1)NaHCO3与HCl
(2)NaHCO3与NaOH
3.写出下列离子反应的离子方程式
(3)Na与水
(4)CuO溶于盐酸
HCO3-+H+=CO2↑+H2O
HCO3-+OH-=CO32-+H2O
2Na++2H2O=2Na++2OH-+H2 ↑
CuO+2H+=Cu2++H2O
(8)硫酸与氢氧化钡溶液
(7)醋酸溶液与氨水混合
(6)醋酸溶液与NaOH溶液混合
(5)稀硝酸和KOH溶液混合
H++OH-=H2O
CH3COOH+OH-=CH3COO-+H2O
CH3COOH+ NH3·H2O=NH4++ CH3COO-+H2O
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
二、离子反应
5.(2021·浙江7月学考)下列方程式书写不正确的是( )
A
6.(2021·浙江1月学考)下列方程式书写不正确的是( )
C
7.(2020·浙江7月学考)下列方程式书写正确的是( )
A.醋酸的电离方程式:CH3COOH===CH3COO-+H+
B.钠与水反应的离子方程式:Na+2H2O===Na++2OH-+H2↑
C.用过量氨水吸收二氧化硫气体:NH3·H2O+SO2===NH4HSO3
D.乙烯使溴的四氯化碳溶液褪色:CH2===CH2+Br2―→CH2BrCH2Br
D
8.(2019·浙江11月学考)能正确表示下列变化的离子方程式是( )
A
9.(2019·浙江4月选考)不能正确表示下列变化的离子方程式是( )
D
(2020·浙江7月学考)某固体混合物X可能含有Cu、Fe、Fe2O3、Ca(OH)2和Na2CO3中的几种。为确定其组成,某同学进行了如下实验:
已知:向溶液B中滴加KSCN溶液,未出现红色。
下列推断正确的是( )
A.固体混合物X中一定含Ca(OH)2和Na2CO3
B.固体混合物X中若含Cu,则一定还含Fe2O3
C.气体B一定是纯净物
D.溶液B中一定含2种金属阳离子
[变式训练1] (2020·浙江1月学考)某固体X可能含有FeO、Fe2O3、MnO2、K2SO3、Na2CO3、NaClO、K2SO4中的一种或几种物质,进行如下实验以确定其组成:
下列有关说法正确的是( )
A.若固体X中不含K2SO4,则一定含NaClO
B.固体X中一定含有Fe2O3
C.滤液A中一定含有Na+
D.气体B一定是纯净物
如离子间相互间可以反应,则不能大量共存:
如(1)产生沉淀(包括微溶物)、气体、难电离物质
(2)发生氧化还原反应等。
还需注意下列情况
(1)溶液的颜色(与透明无关)
(2)溶液的酸碱性
Cu2+:蓝色,Fe3+:黄色;Fe2+ :浅绿色 MnO4-:紫红色
如:强碱性条件下,Ca2+不能大量存在
三、离子共存的判断
D
11.(2021·浙江金华高一月考,17)下列可以大量共存且溶液是无色的离子组是
( )
D
四、常见离子的检验和推断
12.(2019·浙江11月学考)通过实验得出的结论正确的是( )
C
13.(2017·浙江11月学考)取某固体样品,进行如下实验
①取一定量的样品,加足量水充分溶解,过滤得到滤液和滤渣;
②取少量滤液,加入BaCl2溶液,有白色沉淀产生;
③取少量滤渣,加入稀盐酸,滤渣全部溶解,同时有气体产生。
根据上述实验现象,该固体样品的成分可能是( )
A.K2SO4、Ba(OH)2、Na2CO3 B.Na2CO3、AgNO3、KNO3
C.K2CO3、NaCl、Ba(NO3)2 D.KNO3、MgCl2、NaOH
C
同课章节目录
