2023年普通高中化学学业水平考试学考复习——专题3 氧化还原反应(26张ppt)
文档属性
| 名称 | 2023年普通高中化学学业水平考试学考复习——专题3 氧化还原反应(26张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-27 14:35:57 | ||
图片预览





文档简介
(共26张PPT)
组织建设
化学 · 学考
专题3 氧化还原反应
【学业水平目标】
1.知道有化合价变化的反应是氧化还原反应。
2.了解氧化还原反应的本质是电子的转移。
3.知道常见的氧化剂和还原剂。
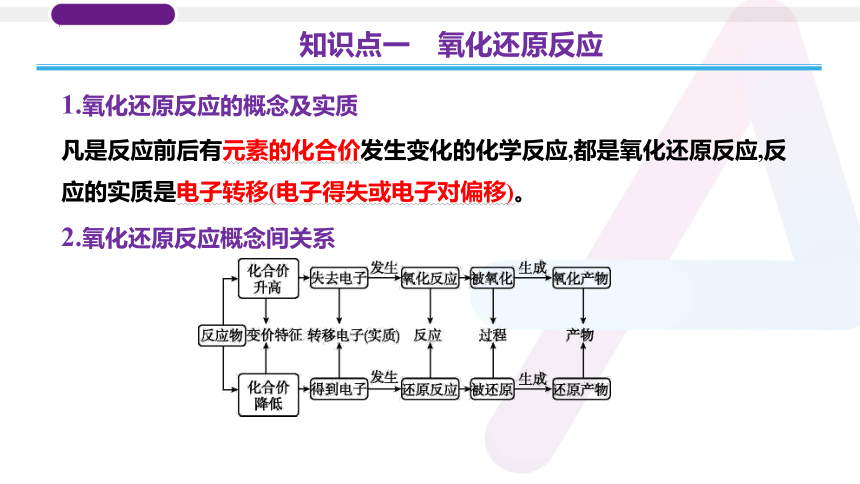
1.氧化还原反应的概念及实质
凡是反应前后有元素的化合价发生变化的化学反应,都是氧化还原反应,反应的实质是电子转移(电子得失或电子对偏移)。
2.氧化还原反应概念间关系
知识点一 氧化还原反应
3.氧化还原反应中电子转移的表示方法
双线桥法表示的注意点:
(1)两条线的箭头均由反应物指向生成物,且连接化合价变化的同一种元素。
(2)线上要标明得到(或失去)电子及其数目,可表示为
[注意] 氧化还原反应中,氧化剂得到的电子总数等于还原剂失去的电子总数,表现为化合价升高总数等于化合价降低总数。
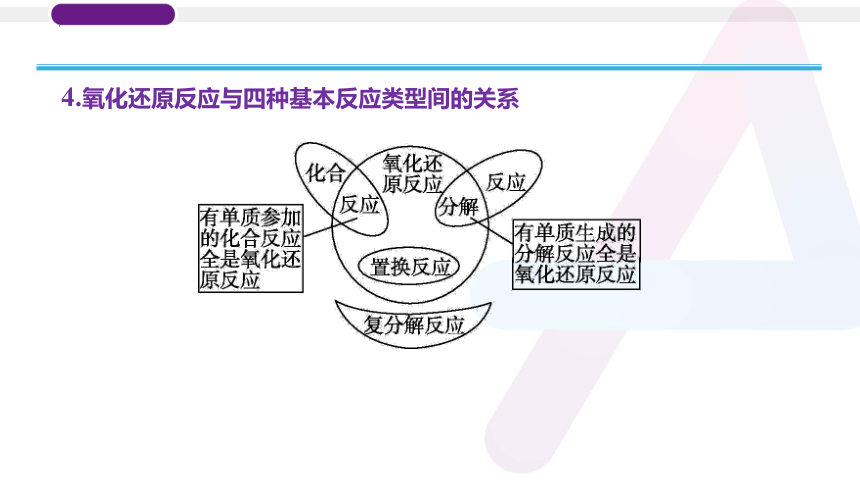
4.氧化还原反应与四种基本反应类型间的关系
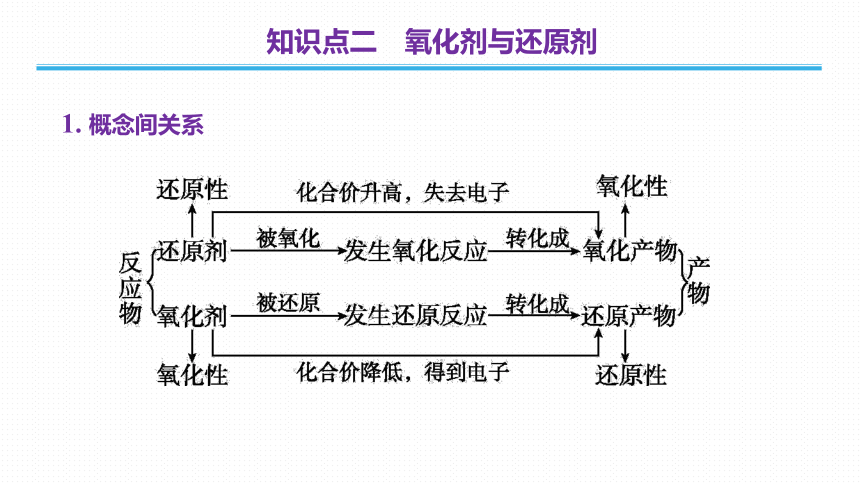
1. 概念间关系
知识点二 氧化剂与还原剂
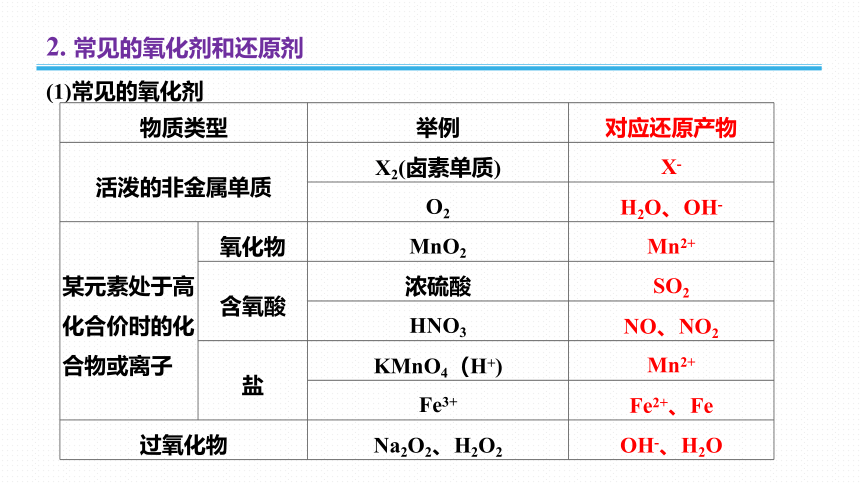
2. 常见的氧化剂和还原剂
(1)常见的氧化剂
物质类型 举例 对应还原产物
活泼的非金属单质 X2(卤素单质) X-
O2 H2O、OH-
某元素处于高化合价时的化合物或离子 氧化物 MnO2 Mn2+
含氧酸 浓硫酸 SO2
HNO3 NO、NO2
盐 KMnO4(H+) Mn2+
Fe3+ Fe2+、Fe
过氧化物 Na2O2、H2O2 OH-、H2O
(2)常见的还原剂
①活泼的金属单质,如Na、Mg、Al、Fe等。
②某些活泼的非金属单质,如H2、C、Si等。
③某元素处于低化合价时的物质,如CO、Fe2+、S2-、I-等。
3.氧化性与还原性
(1)氧化性:表示氧化剂得电子能力强弱的性质。
还原性:表示还原剂失电子能力强弱的性质。
(2)氧化性、还原性强弱比较
①依据元素化合价判断
②依据氧化还原反应方程式判断
氧化剂+还原剂 还原产物+氧化产物
氧化性:氧化剂>氧化产物。还原性:还原剂>还原产物。
1.辨析
(1)有单质参加或有单质生成的化学反应一定是氧化还原反应( )
(2)水作还原剂时,产物中一般有O2( )
(3)NO2溶于水发生氧化还原反应( )
(4)氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原( )
(5)某元素从游离态变为化合态,该元素可能被氧化也可能被还原( )
(6)在氧化还原反应中,金属单质作反应物时一定是还原剂( )
(7)元素处于最高化合价时一定具有强氧化性( )
(8)强氧化剂与强还原剂混合不一定能发生氧化还原反应( )
×
√
√
×
√
√
×
√
考查点1 氧化还原反应
例1 [2021 浙江1月学考改编] 关于反应8NH3+6NO2 = 7N2+12H2O,下列说法正确的是( )
A.NH3中H元素被氧化
B.NO2在反应过程中失去电子
C.还原剂与氧化剂的物质的量之比为3∶4
D.氧化产物与还原产物的质量之比为4∶3
D
变式 ClO2是一种高效消毒剂,可通过以下反应制得:2KClO3+H2C2O4+H2SO4 = 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
A.ClO2作消毒剂是利用了其强氧化性
B.氧化性:KClO3>CO2
C.1 mol KClO3参加反应得到44.8 L气体
D.1 mol H2C2O4参加反应时有2 mol电子转移
C
变式 下列表示氧化还原反应转移电子数的方法不正确的是 ( )
A. B.
C. D.
B
例2 [2021 浙江7月学考]反应2Al+Fe2O3 Al2O3+2Fe中,氧化剂是( )
A.Al B.Fe2O3 C.Al2O3 D.Fe
B
考查点2 氧化剂和还原剂
7.(2021·浙江浙北6月联考)下列反应中,电子转移方向和数目正确的是( )
D
A
A
10.(2021·浙江东阳6月学考模拟)常温下,发生下列反应:
B
11.配平下列反应方程式。
四、氧化还原反应方程式的书写与配平
四、氧化还原反应方程式的书写与配平
[变式训练1] 配平下列方程式
答案:2 1 1 2 2 1 2
答案:2 10 8 2 1 5 8
四、氧化还原反应方程式的书写与配平
(2)被氧化的原子与被还原的原子数目之比为 。
(3)HI在反应中表现的性质是 (填字母)。
A.只有还原性 B.只有氧化性
C.还原性和酸性 D.氧化性和酸性
四、氧化还原反应方程式的书写与配平
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是 → 。
(3)写出该反应的化学方程式(配平): 。
五、氧化还原反应计算
[2020·浙江7月学考] 将1.660 g草酸钾固体(K2C2O4,M=166 g·mol-1)溶于水配成溶液,用20.00 mL 0.200 0 mol·L-1酸性KMnO4溶液恰好将其完全氧化。则KMnO4的还原产物是( )
A.Mn B.MnO2 C.MnO(OH) D.Mn2+
D
五、氧化还原反应计算
变式 [2020·浙江温州十五校联合体联考] 已知M2可与R2-反应,R2-被氧化为R单质, M2的还原产物中M为+3价;又已知100 mL c(M2)=0.2 mol·L-1的溶液可与100 mL c(R2-)=0.6 mol·L-1的溶液恰好完全反应,则n值为 ( )
A.1 B.2 C.3 D.4
B
五、氧化还原反应计算
组织建设
化学 · 学考
专题3 氧化还原反应
【学业水平目标】
1.知道有化合价变化的反应是氧化还原反应。
2.了解氧化还原反应的本质是电子的转移。
3.知道常见的氧化剂和还原剂。
1.氧化还原反应的概念及实质
凡是反应前后有元素的化合价发生变化的化学反应,都是氧化还原反应,反应的实质是电子转移(电子得失或电子对偏移)。
2.氧化还原反应概念间关系
知识点一 氧化还原反应
3.氧化还原反应中电子转移的表示方法
双线桥法表示的注意点:
(1)两条线的箭头均由反应物指向生成物,且连接化合价变化的同一种元素。
(2)线上要标明得到(或失去)电子及其数目,可表示为
[注意] 氧化还原反应中,氧化剂得到的电子总数等于还原剂失去的电子总数,表现为化合价升高总数等于化合价降低总数。
4.氧化还原反应与四种基本反应类型间的关系
1. 概念间关系
知识点二 氧化剂与还原剂
2. 常见的氧化剂和还原剂
(1)常见的氧化剂
物质类型 举例 对应还原产物
活泼的非金属单质 X2(卤素单质) X-
O2 H2O、OH-
某元素处于高化合价时的化合物或离子 氧化物 MnO2 Mn2+
含氧酸 浓硫酸 SO2
HNO3 NO、NO2
盐 KMnO4(H+) Mn2+
Fe3+ Fe2+、Fe
过氧化物 Na2O2、H2O2 OH-、H2O
(2)常见的还原剂
①活泼的金属单质,如Na、Mg、Al、Fe等。
②某些活泼的非金属单质,如H2、C、Si等。
③某元素处于低化合价时的物质,如CO、Fe2+、S2-、I-等。
3.氧化性与还原性
(1)氧化性:表示氧化剂得电子能力强弱的性质。
还原性:表示还原剂失电子能力强弱的性质。
(2)氧化性、还原性强弱比较
①依据元素化合价判断
②依据氧化还原反应方程式判断
氧化剂+还原剂 还原产物+氧化产物
氧化性:氧化剂>氧化产物。还原性:还原剂>还原产物。
1.辨析
(1)有单质参加或有单质生成的化学反应一定是氧化还原反应( )
(2)水作还原剂时,产物中一般有O2( )
(3)NO2溶于水发生氧化还原反应( )
(4)氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原( )
(5)某元素从游离态变为化合态,该元素可能被氧化也可能被还原( )
(6)在氧化还原反应中,金属单质作反应物时一定是还原剂( )
(7)元素处于最高化合价时一定具有强氧化性( )
(8)强氧化剂与强还原剂混合不一定能发生氧化还原反应( )
×
√
√
×
√
√
×
√
考查点1 氧化还原反应
例1 [2021 浙江1月学考改编] 关于反应8NH3+6NO2 = 7N2+12H2O,下列说法正确的是( )
A.NH3中H元素被氧化
B.NO2在反应过程中失去电子
C.还原剂与氧化剂的物质的量之比为3∶4
D.氧化产物与还原产物的质量之比为4∶3
D
变式 ClO2是一种高效消毒剂,可通过以下反应制得:2KClO3+H2C2O4+H2SO4 = 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
A.ClO2作消毒剂是利用了其强氧化性
B.氧化性:KClO3>CO2
C.1 mol KClO3参加反应得到44.8 L气体
D.1 mol H2C2O4参加反应时有2 mol电子转移
C
变式 下列表示氧化还原反应转移电子数的方法不正确的是 ( )
A. B.
C. D.
B
例2 [2021 浙江7月学考]反应2Al+Fe2O3 Al2O3+2Fe中,氧化剂是( )
A.Al B.Fe2O3 C.Al2O3 D.Fe
B
考查点2 氧化剂和还原剂
7.(2021·浙江浙北6月联考)下列反应中,电子转移方向和数目正确的是( )
D
A
A
10.(2021·浙江东阳6月学考模拟)常温下,发生下列反应:
B
11.配平下列反应方程式。
四、氧化还原反应方程式的书写与配平
四、氧化还原反应方程式的书写与配平
[变式训练1] 配平下列方程式
答案:2 1 1 2 2 1 2
答案:2 10 8 2 1 5 8
四、氧化还原反应方程式的书写与配平
(2)被氧化的原子与被还原的原子数目之比为 。
(3)HI在反应中表现的性质是 (填字母)。
A.只有还原性 B.只有氧化性
C.还原性和酸性 D.氧化性和酸性
四、氧化还原反应方程式的书写与配平
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是 → 。
(3)写出该反应的化学方程式(配平): 。
五、氧化还原反应计算
[2020·浙江7月学考] 将1.660 g草酸钾固体(K2C2O4,M=166 g·mol-1)溶于水配成溶液,用20.00 mL 0.200 0 mol·L-1酸性KMnO4溶液恰好将其完全氧化。则KMnO4的还原产物是( )
A.Mn B.MnO2 C.MnO(OH) D.Mn2+
D
五、氧化还原反应计算
变式 [2020·浙江温州十五校联合体联考] 已知M2可与R2-反应,R2-被氧化为R单质, M2的还原产物中M为+3价;又已知100 mL c(M2)=0.2 mol·L-1的溶液可与100 mL c(R2-)=0.6 mol·L-1的溶液恰好完全反应,则n值为 ( )
A.1 B.2 C.3 D.4
B
五、氧化还原反应计算
同课章节目录
