2023年普通高中化学学业水平考试学考复习——专题4 钠及其化合物(22张ppt)
文档属性
| 名称 | 2023年普通高中化学学业水平考试学考复习——专题4 钠及其化合物(22张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-28 07:20:41 | ||
图片预览





文档简介
(共22张PPT)
组织建设
化学 · 学考
专题4 钠及其化合物
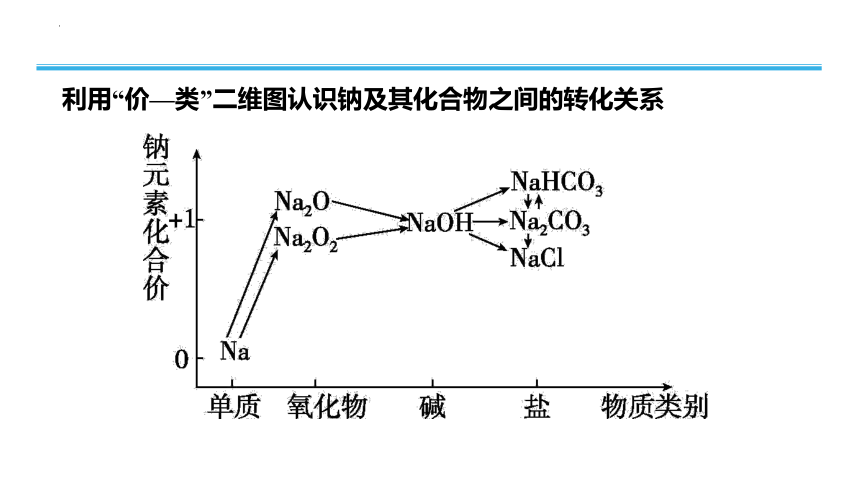
利用“价—类”二维图认识钠及其化合物之间的转化关系
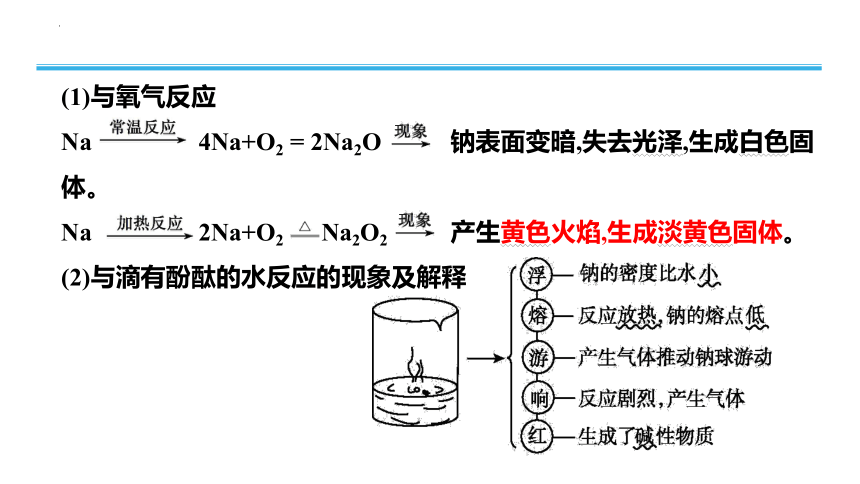
(1)与氧气反应
Na 4Na+O2 = 2Na2O 钠表面变暗,失去光泽,生成白色固体。
Na 2Na+O2 Na2O2 产生黄色火焰,生成淡黄色固体。
(2)与滴有酚酞的水反应的现象及解释
(3)钠与乙醇反应:
2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑
反思归纳
1.钠与水、酸、盐溶液反应的本质与顺序:本质上均是与H+的反应,反应顺序是:有酸酸在前,无酸水为先。
2.钠与乙醇反应的特点——慢、沉
钠与乙醇反应,钠块先沉在液面下,后上下浮动、能看到表面冒出气泡,并不能熔化成小球。
1.(2020·浙江东阳中学月考)关于钠的说法错误的是( )
A.钠的密度比水大 B.钠是强还原剂
C.钠的熔点比较低 D.钠呈银白色
A
2.(2021·浙江10月高一联考)下列说法正确的是( )
A.Na在空气中燃烧生成Na2O
B.钠只有在加热条件下才能与氯气反应
C.Na-K合金用作快中子反应堆的导热剂
D.Na加入到CuCl2溶液中可得Cu
C
3.(2021·浙江7月“七彩阳光”高一联考)下列关于钠的说法中,正确的是 ( )
A.钠在空气中燃烧生成白色固体
B.钠着火后可用水来灭火
C.钠的化学性质比较活泼,少量的钠可以保存在与钠不反应的煤油中
D.当钠与硫酸铜溶液反应时,有大量红色固体铜出现
C
二、钠的几种化合物
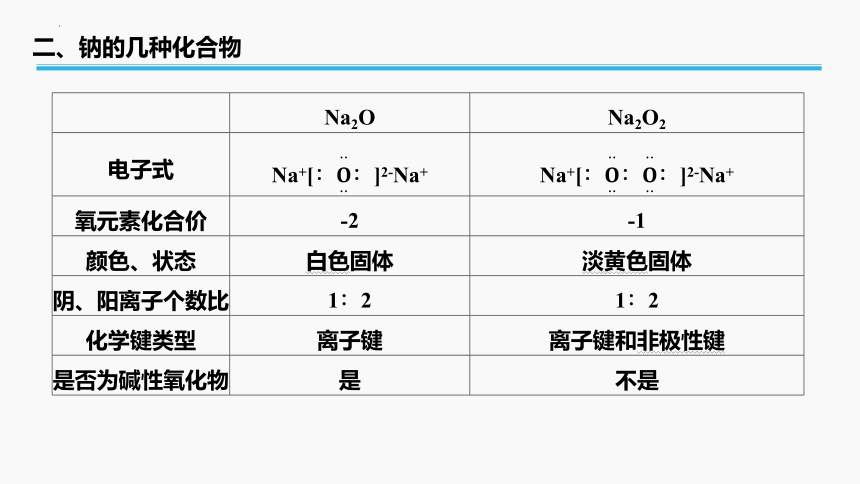
Na2O Na2O2
电子式 Na+[∶∶]2-Na+ Na+[∶∶∶]2-Na+
氧元素化合价 -2 -1
颜色、状态 白色固体 淡黄色固体
阴、阳离子个数比 1∶2 1∶2
化学键类型 离子键 离子键和非极性键
是否为碱性氧化物 是 不是
[注意] 金属钠在空气中无论生成单一的Na2O或Na2O2,还是生成二者的混合物,1 mol Na只能转移1 mol电子(此知识点在NA的判断考题中常有考查)。
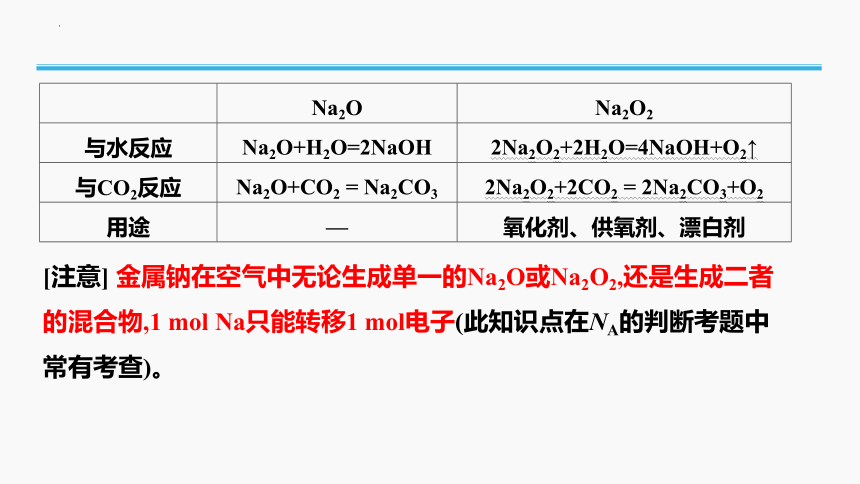
Na2O Na2O2
与水反应 Na2O+H2O=2NaOH 2Na2O2+2H2O=4NaOH+O2↑
与CO2反应 Na2O+CO2 = Na2CO3 2Na2O2+2CO2 = 2Na2CO3+O2
用途 — 氧化剂、供氧剂、漂白剂
(二)碳酸钠和碳酸氢钠
性质 Na2CO3(纯碱、苏打) NaHCO3 (小苏打) 性质比较
水溶性 易溶 易溶 相同温度下,Na2CO3的溶解度大于NaHCO3
溶液的酸碱性 碱性 碱性 物质的量浓度相同时,Na2CO3溶液的pH比NaHCO3 溶液的大
热稳定性 稳定 不稳定 2NaHCO3 Na2CO3+CO2↑+H2O
与酸反应 反应 反应 与同浓度的盐酸反应,都可放出CO2气体,但NaHCO3比Na2CO3反应速率快
[注意] 区别钠的几种化合物的俗称:火碱、烧碱、苛性钠——NaOH;
纯碱、苏打——Na2CO3,其俗称虽为纯碱,但不属于碱,而属于盐;
小苏打——NaHCO3。
(2)Na2CO3、NaHCO3的鉴别与除杂
①Na2CO3、NaHCO3的鉴别方法
②Na2CO3和NaHCO3混合物的除杂方法
序号 混合物(括号内为杂质) 除杂方法
① Na2CO3(s)(NaHCO3) 加热法
② NaHCO3(aq)(Na2CO3) 通入足量CO2
③ Na2CO3(aq)(NaHCO3) 滴加适量NaOH溶液
辨析易错易混
(1)Na2O2与H2O的反应中,H2O是还原剂( )
(2)Na2O与Na2O2的阴、阳离子个数比均为1∶2( )
(3)Na2O2与CO2反应时有单质O2发生,该反应属于置换反应( )
(4)在酒精灯加热条件下,Na2CO3、NaHCO3固体都会分解( )
×
√
×
×
(5)向Na2CO3饱和溶液中通入足量CO2,会有NaHCO3晶体析出( )
(6)将稀盐酸滴入碳酸钠与氢氧化钠的混合溶液中,立即产生气泡( )
(7)在日常生活中,小苏打常用作食用碱使用而苏打不能( )
(8)碳酸氢钠可用于治疗胃酸过多( )
(9)Na2CO3俗称纯碱,所以Na2CO3属于碱( )
√
×
×
√
×
[2021·浙江台州六校高一联考] 将绿豆大小的金属钠放入滴有紫色石蕊的溶液中,下列现象不正确的是( )
A.金属钠浮在液面上
B.金属钠熔成闪亮的银白色小球
C.金属钠四处游动,发出嘶嘶的响声
D.溶液呈红色
D
[2021 浙江绍兴鲁迅中学高一月考] 下列关于氧化钠和过氧化钠的叙述正确的是( )
A.都是白色固体 B.与水反应都能生成氢氧化钠
C.都可在呼吸面具中作为氧气的来源 D.都属于碱性氧化物
B
变式 用一团棉花包裹少量过氧化钠并放在石棉网上,将CO2气体缓缓通入棉花中的过氧化钠上,棉花很快燃烧起来,分析实验可知,下列说法不正确的是( )
A.反应生成的O2有利于棉花燃烧
B.过氧化钠与CO2反应放热
C.CO2对棉花燃烧起助燃作用
D.过氧化钠与CO2的反应属于氧化还原反应
C
5.(2020·浙江1月学考)某化学兴趣小组设计如下装置(棉花球沾有无水硫酸铜粉末),并完成实验。
下列说法不正确的是( )
A.Na2CO3处的温度高于NaHCO3
处的温度
B.加热一段时间后,棉花球处变蓝色
C.实验结束时,应先熄灭酒精灯,再移开烧杯A、B
D.烧杯A中没有出现浑浊,烧杯B中出现浑浊,说明Na2CO3热稳定性比
NaHCO3强
C
[2021·浙江台州六校期末] 关于碳酸钠和碳酸氢钠的叙述不正确的是( )
A.相同质量的碳酸钠和碳酸氢钠,后者与足量的盐酸反应产生的气体多
B.向碳酸钠溶液中缓慢滴入稀盐酸,开始无气泡,一段时间后产生气泡
C.用澄清石灰水可以鉴别碳酸钠和碳酸氢钠溶液
D.相同浓度的碳酸钠和碳酸氢钠溶液,滴入酚酞后,前者颜色较深
C
6.(2020·浙江7月学考改编)实验室中有一瓶碳酸氢钠固体,因受热而部分变质(杂质为Na2CO3,假设杂质分布均匀)。为测定其组成,称取1.892 g样品溶于水,配成500 mL溶液。取出25.00 mL该溶液,加入0.050 mol · L-1 Ba(OH)2溶液至22.00 mL时沉淀量达到最大。
请计算:
(1)25 ℃时,0.050 mol ·L-1 Ba (OH)2溶液的c(OH-)=________。
(2)样品中n(NaHCO3)∶n(Na2CO3)=________。
答案 (1)0.10 mol ·L-1 (2)10∶1
三、焰色试验
1.定义
很多金属或它们的化合物在灼烧时都会使火焰呈现特征颜色。
2.操作
7.(2020·浙江余姚中学月考)绚丽的焰火其实就包含化学知识“焰色试验”的应用。下列说法中正确的是( )
A.做焰色试验时,一定有氧化还原反应发生
B.NaCl与Na2CO3灼烧时,火焰颜色相同
C.做焰色试验时,如果没有铂丝可用铁丝,铜丝代替来蘸取待测物在火焰上灼烧
D.焰色试验后,金属丝应用硫酸清洗并在外焰上灼烧至没有颜色,再蘸取其他样品灼烧
B
8.(2021·浙江杭州7月学考模拟)下列现象涉及焰色试验的是( )
A.硝石(KNO3)强烧之,紫青烟起
B.绿蚁新醅酒,红泥小火炉
C.一道残阳铺水中,半江瑟瑟半江红
D.日照香炉生紫烟,遥看瀑布挂前川
A
组织建设
化学 · 学考
专题4 钠及其化合物
利用“价—类”二维图认识钠及其化合物之间的转化关系
(1)与氧气反应
Na 4Na+O2 = 2Na2O 钠表面变暗,失去光泽,生成白色固体。
Na 2Na+O2 Na2O2 产生黄色火焰,生成淡黄色固体。
(2)与滴有酚酞的水反应的现象及解释
(3)钠与乙醇反应:
2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑
反思归纳
1.钠与水、酸、盐溶液反应的本质与顺序:本质上均是与H+的反应,反应顺序是:有酸酸在前,无酸水为先。
2.钠与乙醇反应的特点——慢、沉
钠与乙醇反应,钠块先沉在液面下,后上下浮动、能看到表面冒出气泡,并不能熔化成小球。
1.(2020·浙江东阳中学月考)关于钠的说法错误的是( )
A.钠的密度比水大 B.钠是强还原剂
C.钠的熔点比较低 D.钠呈银白色
A
2.(2021·浙江10月高一联考)下列说法正确的是( )
A.Na在空气中燃烧生成Na2O
B.钠只有在加热条件下才能与氯气反应
C.Na-K合金用作快中子反应堆的导热剂
D.Na加入到CuCl2溶液中可得Cu
C
3.(2021·浙江7月“七彩阳光”高一联考)下列关于钠的说法中,正确的是 ( )
A.钠在空气中燃烧生成白色固体
B.钠着火后可用水来灭火
C.钠的化学性质比较活泼,少量的钠可以保存在与钠不反应的煤油中
D.当钠与硫酸铜溶液反应时,有大量红色固体铜出现
C
二、钠的几种化合物
Na2O Na2O2
电子式 Na+[∶∶]2-Na+ Na+[∶∶∶]2-Na+
氧元素化合价 -2 -1
颜色、状态 白色固体 淡黄色固体
阴、阳离子个数比 1∶2 1∶2
化学键类型 离子键 离子键和非极性键
是否为碱性氧化物 是 不是
[注意] 金属钠在空气中无论生成单一的Na2O或Na2O2,还是生成二者的混合物,1 mol Na只能转移1 mol电子(此知识点在NA的判断考题中常有考查)。
Na2O Na2O2
与水反应 Na2O+H2O=2NaOH 2Na2O2+2H2O=4NaOH+O2↑
与CO2反应 Na2O+CO2 = Na2CO3 2Na2O2+2CO2 = 2Na2CO3+O2
用途 — 氧化剂、供氧剂、漂白剂
(二)碳酸钠和碳酸氢钠
性质 Na2CO3(纯碱、苏打) NaHCO3 (小苏打) 性质比较
水溶性 易溶 易溶 相同温度下,Na2CO3的溶解度大于NaHCO3
溶液的酸碱性 碱性 碱性 物质的量浓度相同时,Na2CO3溶液的pH比NaHCO3 溶液的大
热稳定性 稳定 不稳定 2NaHCO3 Na2CO3+CO2↑+H2O
与酸反应 反应 反应 与同浓度的盐酸反应,都可放出CO2气体,但NaHCO3比Na2CO3反应速率快
[注意] 区别钠的几种化合物的俗称:火碱、烧碱、苛性钠——NaOH;
纯碱、苏打——Na2CO3,其俗称虽为纯碱,但不属于碱,而属于盐;
小苏打——NaHCO3。
(2)Na2CO3、NaHCO3的鉴别与除杂
①Na2CO3、NaHCO3的鉴别方法
②Na2CO3和NaHCO3混合物的除杂方法
序号 混合物(括号内为杂质) 除杂方法
① Na2CO3(s)(NaHCO3) 加热法
② NaHCO3(aq)(Na2CO3) 通入足量CO2
③ Na2CO3(aq)(NaHCO3) 滴加适量NaOH溶液
辨析易错易混
(1)Na2O2与H2O的反应中,H2O是还原剂( )
(2)Na2O与Na2O2的阴、阳离子个数比均为1∶2( )
(3)Na2O2与CO2反应时有单质O2发生,该反应属于置换反应( )
(4)在酒精灯加热条件下,Na2CO3、NaHCO3固体都会分解( )
×
√
×
×
(5)向Na2CO3饱和溶液中通入足量CO2,会有NaHCO3晶体析出( )
(6)将稀盐酸滴入碳酸钠与氢氧化钠的混合溶液中,立即产生气泡( )
(7)在日常生活中,小苏打常用作食用碱使用而苏打不能( )
(8)碳酸氢钠可用于治疗胃酸过多( )
(9)Na2CO3俗称纯碱,所以Na2CO3属于碱( )
√
×
×
√
×
[2021·浙江台州六校高一联考] 将绿豆大小的金属钠放入滴有紫色石蕊的溶液中,下列现象不正确的是( )
A.金属钠浮在液面上
B.金属钠熔成闪亮的银白色小球
C.金属钠四处游动,发出嘶嘶的响声
D.溶液呈红色
D
[2021 浙江绍兴鲁迅中学高一月考] 下列关于氧化钠和过氧化钠的叙述正确的是( )
A.都是白色固体 B.与水反应都能生成氢氧化钠
C.都可在呼吸面具中作为氧气的来源 D.都属于碱性氧化物
B
变式 用一团棉花包裹少量过氧化钠并放在石棉网上,将CO2气体缓缓通入棉花中的过氧化钠上,棉花很快燃烧起来,分析实验可知,下列说法不正确的是( )
A.反应生成的O2有利于棉花燃烧
B.过氧化钠与CO2反应放热
C.CO2对棉花燃烧起助燃作用
D.过氧化钠与CO2的反应属于氧化还原反应
C
5.(2020·浙江1月学考)某化学兴趣小组设计如下装置(棉花球沾有无水硫酸铜粉末),并完成实验。
下列说法不正确的是( )
A.Na2CO3处的温度高于NaHCO3
处的温度
B.加热一段时间后,棉花球处变蓝色
C.实验结束时,应先熄灭酒精灯,再移开烧杯A、B
D.烧杯A中没有出现浑浊,烧杯B中出现浑浊,说明Na2CO3热稳定性比
NaHCO3强
C
[2021·浙江台州六校期末] 关于碳酸钠和碳酸氢钠的叙述不正确的是( )
A.相同质量的碳酸钠和碳酸氢钠,后者与足量的盐酸反应产生的气体多
B.向碳酸钠溶液中缓慢滴入稀盐酸,开始无气泡,一段时间后产生气泡
C.用澄清石灰水可以鉴别碳酸钠和碳酸氢钠溶液
D.相同浓度的碳酸钠和碳酸氢钠溶液,滴入酚酞后,前者颜色较深
C
6.(2020·浙江7月学考改编)实验室中有一瓶碳酸氢钠固体,因受热而部分变质(杂质为Na2CO3,假设杂质分布均匀)。为测定其组成,称取1.892 g样品溶于水,配成500 mL溶液。取出25.00 mL该溶液,加入0.050 mol · L-1 Ba(OH)2溶液至22.00 mL时沉淀量达到最大。
请计算:
(1)25 ℃时,0.050 mol ·L-1 Ba (OH)2溶液的c(OH-)=________。
(2)样品中n(NaHCO3)∶n(Na2CO3)=________。
答案 (1)0.10 mol ·L-1 (2)10∶1
三、焰色试验
1.定义
很多金属或它们的化合物在灼烧时都会使火焰呈现特征颜色。
2.操作
7.(2020·浙江余姚中学月考)绚丽的焰火其实就包含化学知识“焰色试验”的应用。下列说法中正确的是( )
A.做焰色试验时,一定有氧化还原反应发生
B.NaCl与Na2CO3灼烧时,火焰颜色相同
C.做焰色试验时,如果没有铂丝可用铁丝,铜丝代替来蘸取待测物在火焰上灼烧
D.焰色试验后,金属丝应用硫酸清洗并在外焰上灼烧至没有颜色,再蘸取其他样品灼烧
B
8.(2021·浙江杭州7月学考模拟)下列现象涉及焰色试验的是( )
A.硝石(KNO3)强烧之,紫青烟起
B.绿蚁新醅酒,红泥小火炉
C.一道残阳铺水中,半江瑟瑟半江红
D.日照香炉生紫烟,遥看瀑布挂前川
A
同课章节目录
