2023年普通高中化学学业水平考试学考复习——专题5 氯及其化合物(24张ppt)
文档属性
| 名称 | 2023年普通高中化学学业水平考试学考复习——专题5 氯及其化合物(24张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-28 07:48:07 | ||
图片预览






文档简介
(共24张PPT)
组织建设
化学 · 学考
专题5 氯及其化合物
【学业水平目标】
1.了解氯元素的原子结构、存在和氯气的物理性质。
2.认识氯气及其重要化合物以及氯水的主要性质及应用。
3.掌握氯气的实验室制法及氯离子的检验方法。
4.以卤族元素为例,了解同主族元素性质的递变规律。
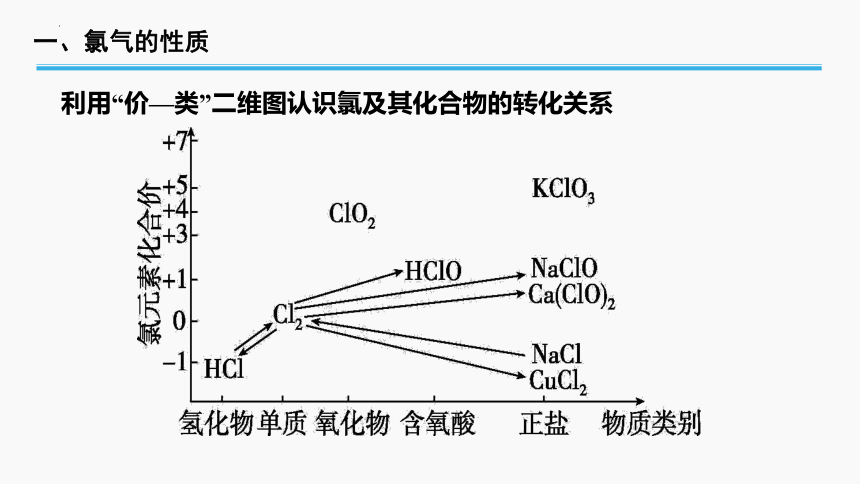
一、氯气的性质
利用“价—类”二维图认识氯及其化合物的转化关系
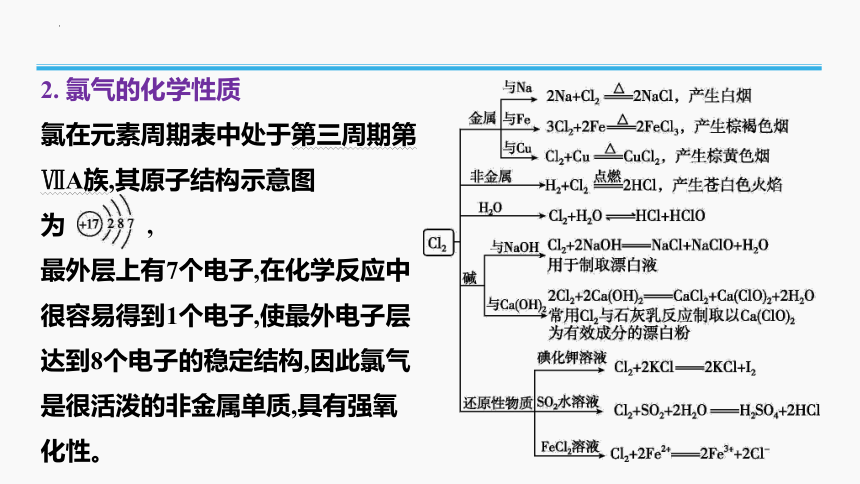
2. 氯气的化学性质
氯在元素周期表中处于第三周期第ⅦA族,其原子结构示意图为 ,
最外层上有7个电子,在化学反应中很容易得到1个电子,使最外电子层达到8个电子的稳定结构,因此氯气是很活泼的非金属单质,具有强氧化性。
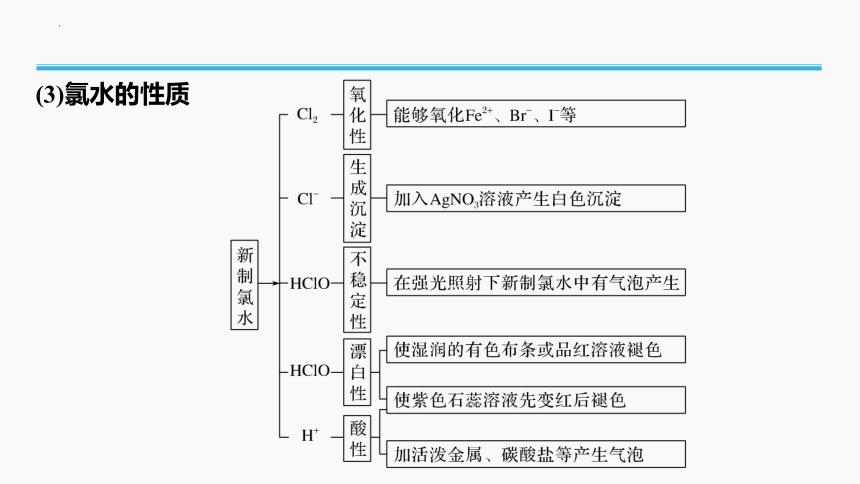
(3)氯水的性质
4.与碱的反应
(1)与NaOH反应——制漂白液,漂白液的有效成分为NaClO。
(2)与Ca(OH)2反应——制漂白粉,漂白粉的主要成分为CaCl2和Ca(ClO)2,有效成分为Ca(ClO)2。
[规律小结] 液氯、新制氯水、久置氯水的区别
液氯 新制氯水 久置氯水
分类 纯净物 混合物
颜色 黄绿色 浅黄绿色 无色
性质 氧化性 酸性、氧化性、漂白性 酸性
粒子 Cl2 Cl2、H2O、HClO、H+、Cl-、ClO-、 H2O、H+、Cl-、
1.辨析
(1)新制氯水中只含Cl2分子和H2O分子( )
(2)新制氯水可使蓝色石蕊试纸先变红后褪色( )
(3)加入NaOH溶液,氯水的浅黄绿色消失,说明有HClO存在( )
(4)向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+( )
×
√
×
√
(5)向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO( )
(6)往氯水中加入有色布条,片刻后有色布条褪色,说明有Cl2存在( )
(7)氯水放置数天后,溶液的酸性将减弱( )
(8)新制氯水漂白作用强,久置氯水无漂白作用( )
×
×
×
√
2.(2021·浙江7月“七彩阳光”高一联考) 下列说法中正确的是( )
A.Cl2有毒性,Cl-也有毒性
B.氯水呈黄绿色,含Cl-的溶液也呈黄绿色
C.纯净的H2在氯气中能安静地燃烧,发出苍白色火焰
D.Cl2不溶于水,所以可用排水法收集
C
3.(2021·浙江杭州7月学考模拟)氯水中含有多种成分,因而具有多种性质,根据氯水分别与图中四种物质发生的反应(a、b、c、d重合部分代表物质间可反应,且氯水足量)。能证明氯水具有漂白性的是( )
A.a B.b
C.c D.d
D
4.(2021·浙江杭州7月学考模拟)下列关于氯水的说法正确的是( )
A.新制氯水含有Cl2、HCl、HClO、H2O分子
B.紫色石蕊试剂滴入新制氯水中,溶液先变红后变无色
C.氯水和液氯都能使干燥的有色布条褪色
D.新制氯水的pH要比久置氯水的pH小
B
5.(2021·浙江1月学考)下列关于可溶性盐Ca(ClO)Cl的说法不正确的是( )
A.具有强氧化性,可作漂白剂
B.水溶液呈中性,滴加碳酸钠溶液出现白色浑浊
C.能与空气中的CO2和水蒸气反应而变质
D.与盐酸反应的离子方程式:ClO-+Cl-+2H+===Cl2↑+H2O
B
6.(2021·浙大附中6月测试)将Cl2制成漂白粉的最主要目的是:①使它转变成较易溶于水的物质 ②转变成较稳定、便于贮存的物质 ③提高氯的质量分数 ④提高漂白能力( )
A.①②③ B.②④
C.②③ D.②
D
三、氯气的制法
1. 实验室制取氯气的反应原理
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,
离子方程式为MnO2+4H++2Cl- Mn2++Cl2↑+2H2O。
2.实验装置
(2)氯气的净化、收集、检验及尾气的处理
①净化装置:先用饱和食盐水除去HCl,再用浓硫酸干燥。
②收集方法
向上排空气法——氯气的密度比空气的大;
排饱和食盐水法——氯气能溶于水,难溶于饱和食盐水。
③尾气处理:用NaOH溶液吸收尾气,原理:Cl2+2OH- = Cl-+ClO-+H2O。
④检验方法:用湿润的淀粉KI试纸检验,试纸变蓝证明生成了氯气,原理: Cl2+2I- = 2Cl-+I2。
[2021·浙江1月学考] 含氯消毒剂在新冠肺炎疫情防控中发挥了巨大作用。实验室中利用图装置模拟制备“84”消毒液(有效成分为NaClO),下列说法不正确的是( )
A.盛放浓盐酸的仪器是分液漏斗
B.为除去Cl2中的HCl,装置a中的
试剂为饱和Na2CO3溶液
C.装置b中,采用冰水浴冷却有利于NaClO的生成
D.装置c的作用是吸收尾气
B
变式 如图为实验室制取和收集纯净干燥
的氯气,并进行氯气性质探究的实验装置图:
已知:Cl2+2KI = 2KCl+I2
(1)反应前,在装置A的 (填写仪
器名称)中装入MnO2固体, (填
写仪器名称)中装浓盐酸,装置A中发生反应的化学方程式为 。
分液漏斗
圆底烧瓶
MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O
变式 如图为实验室制取和收集纯净干燥
的氯气,并进行氯气性质探究的实验装置图:
已知:Cl2+2KI = 2KCl+I2
(2)装置B中的现象是 。
(3)装置D中所装试剂是 ,
作用是 。
(4)装置F中发生反应的化学方程式为 。
溶液变蓝
浓硫酸
干燥Cl2
Cl2+2NaOH=NaCl+NaClO+H2O
8.(2021·浙江东阳中学月考)实验室制取氯气时,如图所示操作正确的是( )
D
A.用装置Ⅰ制取少量氯气
B.用装置Ⅱ除去氯气中混有的少量氯化氢
C.用装置Ⅲ制取氯气
D.用装置Ⅳ干燥氯气
9.实验室用MnO2和浓盐酸反应制取Cl2,气体发生和收集装置如图。请回答:
(1)实验装置连接完成后,首先应进行的操作是___________________________________。
(2)MnO2和浓盐酸反应制取Cl2的化学方程式为_____________________________。
(3)为得到干燥、纯净的Cl2,在收集Cl2之前应依次通过装有________、________(填试剂名称)的洗气瓶。
1.银盐法
四、Cl-的检验
10.(2021·浙江金华曙光6月测试)检验Cl-时所用试剂HNO3的作用是( )
A
11.(2021·浙江台州六校7月联考)下列检验Cl-的方法正确的是( )
A.向某溶液中滴加AgNO3溶液,若产生白色沉淀说明该溶液中有Cl-
B.向某溶液中先滴加盐酸,再滴加AgNO3溶液,若产生白色沉淀,说明溶液中有Cl-
C.向某溶液中先滴加AgNO3溶液,产生白色沉淀,再滴加盐酸,沉淀不消失,说明溶液中有Cl-
D.向某溶液中滴加用HNO3酸化的AgNO3溶液,若产生白色沉淀,说明溶液中有Cl-
D
组织建设
化学 · 学考
专题5 氯及其化合物
【学业水平目标】
1.了解氯元素的原子结构、存在和氯气的物理性质。
2.认识氯气及其重要化合物以及氯水的主要性质及应用。
3.掌握氯气的实验室制法及氯离子的检验方法。
4.以卤族元素为例,了解同主族元素性质的递变规律。
一、氯气的性质
利用“价—类”二维图认识氯及其化合物的转化关系
2. 氯气的化学性质
氯在元素周期表中处于第三周期第ⅦA族,其原子结构示意图为 ,
最外层上有7个电子,在化学反应中很容易得到1个电子,使最外电子层达到8个电子的稳定结构,因此氯气是很活泼的非金属单质,具有强氧化性。
(3)氯水的性质
4.与碱的反应
(1)与NaOH反应——制漂白液,漂白液的有效成分为NaClO。
(2)与Ca(OH)2反应——制漂白粉,漂白粉的主要成分为CaCl2和Ca(ClO)2,有效成分为Ca(ClO)2。
[规律小结] 液氯、新制氯水、久置氯水的区别
液氯 新制氯水 久置氯水
分类 纯净物 混合物
颜色 黄绿色 浅黄绿色 无色
性质 氧化性 酸性、氧化性、漂白性 酸性
粒子 Cl2 Cl2、H2O、HClO、H+、Cl-、ClO-、 H2O、H+、Cl-、
1.辨析
(1)新制氯水中只含Cl2分子和H2O分子( )
(2)新制氯水可使蓝色石蕊试纸先变红后褪色( )
(3)加入NaOH溶液,氯水的浅黄绿色消失,说明有HClO存在( )
(4)向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+( )
×
√
×
√
(5)向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO( )
(6)往氯水中加入有色布条,片刻后有色布条褪色,说明有Cl2存在( )
(7)氯水放置数天后,溶液的酸性将减弱( )
(8)新制氯水漂白作用强,久置氯水无漂白作用( )
×
×
×
√
2.(2021·浙江7月“七彩阳光”高一联考) 下列说法中正确的是( )
A.Cl2有毒性,Cl-也有毒性
B.氯水呈黄绿色,含Cl-的溶液也呈黄绿色
C.纯净的H2在氯气中能安静地燃烧,发出苍白色火焰
D.Cl2不溶于水,所以可用排水法收集
C
3.(2021·浙江杭州7月学考模拟)氯水中含有多种成分,因而具有多种性质,根据氯水分别与图中四种物质发生的反应(a、b、c、d重合部分代表物质间可反应,且氯水足量)。能证明氯水具有漂白性的是( )
A.a B.b
C.c D.d
D
4.(2021·浙江杭州7月学考模拟)下列关于氯水的说法正确的是( )
A.新制氯水含有Cl2、HCl、HClO、H2O分子
B.紫色石蕊试剂滴入新制氯水中,溶液先变红后变无色
C.氯水和液氯都能使干燥的有色布条褪色
D.新制氯水的pH要比久置氯水的pH小
B
5.(2021·浙江1月学考)下列关于可溶性盐Ca(ClO)Cl的说法不正确的是( )
A.具有强氧化性,可作漂白剂
B.水溶液呈中性,滴加碳酸钠溶液出现白色浑浊
C.能与空气中的CO2和水蒸气反应而变质
D.与盐酸反应的离子方程式:ClO-+Cl-+2H+===Cl2↑+H2O
B
6.(2021·浙大附中6月测试)将Cl2制成漂白粉的最主要目的是:①使它转变成较易溶于水的物质 ②转变成较稳定、便于贮存的物质 ③提高氯的质量分数 ④提高漂白能力( )
A.①②③ B.②④
C.②③ D.②
D
三、氯气的制法
1. 实验室制取氯气的反应原理
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,
离子方程式为MnO2+4H++2Cl- Mn2++Cl2↑+2H2O。
2.实验装置
(2)氯气的净化、收集、检验及尾气的处理
①净化装置:先用饱和食盐水除去HCl,再用浓硫酸干燥。
②收集方法
向上排空气法——氯气的密度比空气的大;
排饱和食盐水法——氯气能溶于水,难溶于饱和食盐水。
③尾气处理:用NaOH溶液吸收尾气,原理:Cl2+2OH- = Cl-+ClO-+H2O。
④检验方法:用湿润的淀粉KI试纸检验,试纸变蓝证明生成了氯气,原理: Cl2+2I- = 2Cl-+I2。
[2021·浙江1月学考] 含氯消毒剂在新冠肺炎疫情防控中发挥了巨大作用。实验室中利用图装置模拟制备“84”消毒液(有效成分为NaClO),下列说法不正确的是( )
A.盛放浓盐酸的仪器是分液漏斗
B.为除去Cl2中的HCl,装置a中的
试剂为饱和Na2CO3溶液
C.装置b中,采用冰水浴冷却有利于NaClO的生成
D.装置c的作用是吸收尾气
B
变式 如图为实验室制取和收集纯净干燥
的氯气,并进行氯气性质探究的实验装置图:
已知:Cl2+2KI = 2KCl+I2
(1)反应前,在装置A的 (填写仪
器名称)中装入MnO2固体, (填
写仪器名称)中装浓盐酸,装置A中发生反应的化学方程式为 。
分液漏斗
圆底烧瓶
MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O
变式 如图为实验室制取和收集纯净干燥
的氯气,并进行氯气性质探究的实验装置图:
已知:Cl2+2KI = 2KCl+I2
(2)装置B中的现象是 。
(3)装置D中所装试剂是 ,
作用是 。
(4)装置F中发生反应的化学方程式为 。
溶液变蓝
浓硫酸
干燥Cl2
Cl2+2NaOH=NaCl+NaClO+H2O
8.(2021·浙江东阳中学月考)实验室制取氯气时,如图所示操作正确的是( )
D
A.用装置Ⅰ制取少量氯气
B.用装置Ⅱ除去氯气中混有的少量氯化氢
C.用装置Ⅲ制取氯气
D.用装置Ⅳ干燥氯气
9.实验室用MnO2和浓盐酸反应制取Cl2,气体发生和收集装置如图。请回答:
(1)实验装置连接完成后,首先应进行的操作是___________________________________。
(2)MnO2和浓盐酸反应制取Cl2的化学方程式为_____________________________。
(3)为得到干燥、纯净的Cl2,在收集Cl2之前应依次通过装有________、________(填试剂名称)的洗气瓶。
1.银盐法
四、Cl-的检验
10.(2021·浙江金华曙光6月测试)检验Cl-时所用试剂HNO3的作用是( )
A
11.(2021·浙江台州六校7月联考)下列检验Cl-的方法正确的是( )
A.向某溶液中滴加AgNO3溶液,若产生白色沉淀说明该溶液中有Cl-
B.向某溶液中先滴加盐酸,再滴加AgNO3溶液,若产生白色沉淀,说明溶液中有Cl-
C.向某溶液中先滴加AgNO3溶液,产生白色沉淀,再滴加盐酸,沉淀不消失,说明溶液中有Cl-
D.向某溶液中滴加用HNO3酸化的AgNO3溶液,若产生白色沉淀,说明溶液中有Cl-
D
同课章节目录
