2023年普通高中化学学业水平考试学考复习——专题7 铁及其化合物(29张ppt)
文档属性
| 名称 | 2023年普通高中化学学业水平考试学考复习——专题7 铁及其化合物(29张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-28 07:50:05 | ||
图片预览






文档简介
(共29张PPT)
组织建设
化学 · 学考
专题7 铁及其化合物
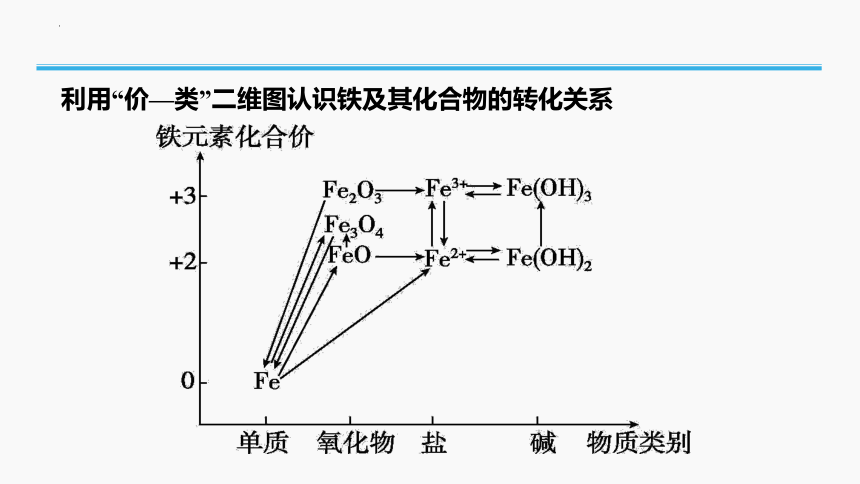
利用“价—类”二维图认识铁及其化合物的转化关系
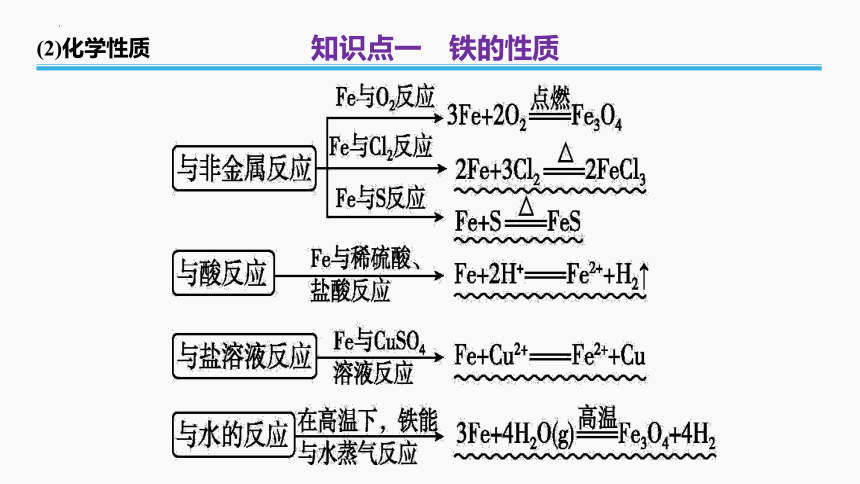
(2)化学性质
知识点一 铁的性质
1.(2021·浙江诸暨中学月考)下列固体不是由金属在对应的气体中燃烧所得的产物的是( )
A.CuCl2 B.Fe2O3 C.Na2O2 D.FeCl3
B
2.(2021·浙江东阳中学月考)下列实验中,对现象的叙述正确的是( )
A.铁在氯气中燃烧出现红棕色烟雾
B.铜在氯气中燃烧产生绿色的烟
C.氢气在氯气中燃烧发出淡蓝色火焰
D.钠在氯气中燃烧生成白色的固体
D
3.(2021·浙江温州5月期末)下列有关说法正确的是( )
A.钢铁在潮湿空气中生锈主要是发生了化学腐蚀
B.还原铁粉可用作贮存富脂类食品时的脱氧剂
C.煮沸FeCl3饱和溶液可制得氢氧化铁胶体
D.过量的Fe在Cl2中燃烧得到FeCl2
B
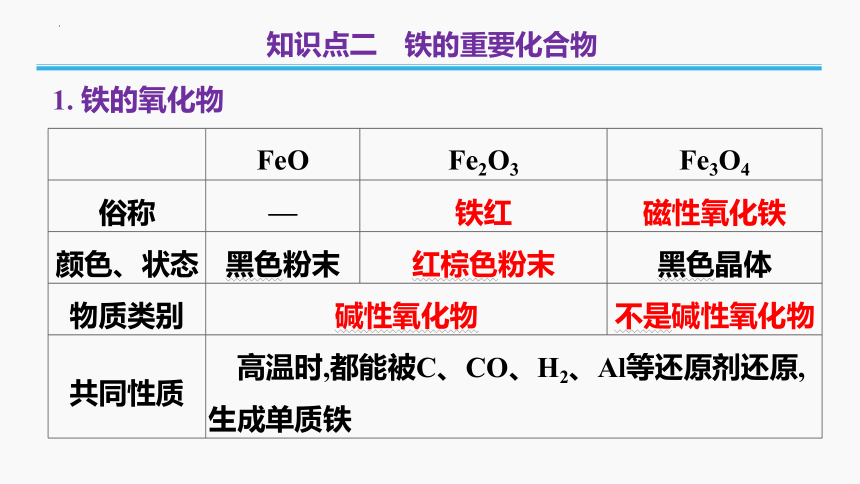
1. 铁的氧化物
知识点二 铁的重要化合物
FeO Fe2O3 Fe3O4
俗称 — 铁红 磁性氧化铁
颜色、状态 黑色粉末 红棕色粉末 黑色晶体
物质类别 碱性氧化物 不是碱性氧化物
共同性质 高温时,都能被C、CO、H2、Al等还原剂还原,生成单质铁
2. 铁的两种氢氧化物
Fe(OH)2 Fe(OH)3
颜色、状态 白色固体 红褐色固体
热稳定性 — 2Fe(OH)3 Fe2O3+3H2O
制备方法 可溶性亚铁盐与碱反应: Fe2++2OH- = Fe(OH)2↓ 可溶性铁盐与碱反应:Fe3++3OH- = Fe(OH)3↓
二者的转化 在空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,白色沉淀迅速变成灰绿色,最后变成红褐色:4Fe(OH)2+O2+2H2O=4Fe(OH)3
(1)Fe2+的性质
①Fe2+中Fe元素显+2价,处于中间价态,既有氧化性,又有还原性。遇氧化性较强的物质如Br2、Cl2、H2O2、O2、N(H+)、Mn(H+)等,均表现还原性。
Cl2+2Fe2+ = 2Fe3++2Cl-; 2Fe2++2H++H2O2 = 2Fe3++2H2O;
配制Fe2+的盐溶液时要加少量铁粉防止Fe2+被氧化。
3. 铁盐和亚铁盐
(2)Fe3+的性质
①Fe3+具有较强的氧化性,它能氧化Fe、Cu、HI、H2S等,因此Fe3+与S2-、I-等不能大量共存。
2Fe3++Fe = 3Fe2+; 2Fe3++Cu = 2Fe2++Cu2+; 2Fe3++2I- = 2Fe2++I2。
②Fe3+能与碱溶液反应生成Fe(OH)3红褐色沉淀。
③Fe3+与KSCN溶液反应 Fe3++3SCN- Fe(SCN)3,溶液变红色,常用于检验溶液中是否含Fe3+。
4. Fe2+、Fe3+的检验
(1)利用显色反应
①用KSCN溶液和氯水
②用NaOH溶液
1.(浙江学考组合题)判断正误。
(1)(2021·浙江7月学考)氯化铁溶液与铁反应的离子方程式:2Fe3++Fe===3Fe2+( )
(2)(2018·浙江4月学考)氢氧化铁胶体能用于净水( )
(3)(2017·浙江4月学考)氯化铁溶液可用于制作印刷铜电路板( )
√
√
√
例1 [2021·杭州西湖高级中学检测] 把铁片放入下列溶液中,发生化学反应且溶液的质量减小的是 ( )
A.稀盐酸 B.CuCl2溶液 C.FeCl3溶液 D.Na2SO4溶液
B
考查点1 铁及其化合物的性质
变式 [2020·浙江7月学考] 某固体混合物X可能含有Cu、Fe、Fe2O3、Ca(OH)2和Na2CO3中的几种。为确定其组成,某同学进行了如下实验:
已知:向溶液B中滴加KSCN溶液,未出现血红色。下列推断正确的是( )
A.固体混合物X中一定含Ca(OH)2和Na2CO3
B.固体混合物X中若含Cu,则一定还含Fe2O3
C.气体B一定是纯净物
D.溶液B中一定含2种金属阳离子
B
例2 [2021·浙江余姚中学期中] 将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100 mL 4.40 mol·L-1盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28 g。过滤,滤液中无Cu2+,将滤液加水稀释到200 mL,测得其中c(H+)为0.40 mol·L-1。则原混合物中氧化铁的质量是( )
A.3.2 g B.4.8 g C.6.4 g D.8 g
C
考查点2 与铁及其化合物相关的计算
变式 将3.84 g Fe和Fe2O3的混合物溶于120 mL的盐酸,刚好完全反应,生成0.03 mol H2,若反应后的溶液中无Fe3+,且溶液体积不变。试求:
(1)原混合物中Fe2O3的质量为 g;
(2)原盐酸的物质的量浓度为 mol·L-1。
1.6
1
5.(2021·浙江苍南卫城中学7月学考模拟)下列有关铁及其化合物的说法中正确的是( )
A.Fe3O4为红棕色晶体
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.除去FeCl3溶液中的FeCl2杂质可以向溶液中通入氯气
D.Fe3+与KSCN试剂产生红色沉淀
C
6.(2021·浙江温州5月高一联考)“百炼成钢”是指反复将炽热的生铁在空气中锤打,转化为坚硬的钢,其实质是对生铁的不断除杂过程。下列关于物质的除杂叙述不正确的是( )
D
选项 被提纯物质 杂质 除杂试剂或方法
A FeCl3溶液 FeCl2 通入适量Cl2
B FeCl2溶液 FeCl3 加入过量铁粉并过滤
C 铁粉 铝粉 加入过量NaOH溶液并过滤
D Fe(OH)3 Fe(OH)2 在空气中灼烧
1. 合金及其性质
知识点三 金属材料
2. 铝及其化合物的性质
(1)铝的单质
(2)氧化铝
(3)氢氧化铝
①Al(OH)3+3H+ = Al3++3H2O;
②Al(OH)3+OH- = Al+2H2O;
③2Al(OH)3 Al2O3+3H2O。
例3 下列反应的离子方程式书写正确的是( )
A.氧化铝溶于盐酸:Al2O3+6H+ = 2Al3++3H2O
B.铝溶于NaOH溶液:Al+2OH- = Al+H2↑
C.铝溶于盐酸:Al+2H+ = Al3++H2↑
D.氧化铝溶于NaOH溶液:Al2O3+OH- = Al+H2O
A
考查点3 铝及其化合物的基本性质
5.铝与盐酸和氢氧化钠溶液反应的量的关系:
(1)等量的铝分别与足量的盐酸和氢氧化钠溶液反应,消耗盐酸和氢氧化钠的物质的量之比为________。
(2)等量的铝分别与足量的盐酸和氢氧化钠溶液反应,相同状况下,产生H2的体积比为________。
(3)足量的铝分别与等物质的量浓度、等体积的盐酸和氢氧化钠溶液反应,相同状况下,产生H2的体积比为________。
6.下列物质中,既能与强酸反应,又能与强碱反应的是( )
①Na2CO3 ②Al ③Al2O3 ④Al(OH)3 ⑤NaHCO3
A.②③④ B.②③④⑤ C.①③④⑤ D.①②③④⑤
B
7.下列说法正确的是( )
A.铁易生锈,而铝在空气中较稳定,所以铁比铝活泼
B.铝不能与氯气反应
C.氧化镁、氧化铝都可用作耐火材料
D.工业上均用电解熔融氧化物的方法制金属镁和铝
C
变式 如图是从铝土矿(主要成分是Al2O3,含有Fe2O3杂质)中提纯Al2O3的简单示意图。其中涉及的一个反应是2NaAlO2+CO2+3H2O = Na2CO3+2Al(OH)3↓。
(1)图示中实验操作a是 ;加入的试剂②是 (填化学式)。
过滤
Ca(OH)2或Ba(OH)2
(2)试写出下列物质(或溶液中的主要溶质)的化学式:
B ;D ;H 。
(3)写出下列化学方程式。
①铝土矿→A: 。
②E→F: 。
Al2O3+2NaOH=2NaAlO2+H2O
2Al(OH)3 Al2O3+3H2O
NaAlO2
Na2CO3
CaCO3或BaCO3
12.(2021·浙江台州书生中学6月学考模拟) 将2.80 g含氧化镁的镁条完全溶于50.0 mL硫酸溶液后,滴加2.00 mol/L氢氧化钠液,恰好完全沉淀时用去200.0 mL。将所得沉淀灼烧、冷却后称量得固体质量为4.40 g。
(1)上述硫酸的物质的量浓度c(H2SO4)=________________________。
(2)镁条中氧化镁和镁的物质的量之比为n(MgO)∶n(Mg)=____________________。
答案 (1) 4.0 mol· L-1 (2)1∶10
9.(2021·浙江丽水测试)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。将15.8 g KMnO4与足量的浓盐酸充分反应,产生气体的体积均在标准状况下测定,请计算:
(1)高锰酸钾的物质的量是________ mol。
(2)产生的Cl2的体积是________ L。
(3)若用MnO2与足量的浓盐酸反应制取相同体积的Cl2,理论上需要MnO2的质量是________克。
答案 (1)0.3 mol (2)6.72 L
组织建设
化学 · 学考
专题7 铁及其化合物
利用“价—类”二维图认识铁及其化合物的转化关系
(2)化学性质
知识点一 铁的性质
1.(2021·浙江诸暨中学月考)下列固体不是由金属在对应的气体中燃烧所得的产物的是( )
A.CuCl2 B.Fe2O3 C.Na2O2 D.FeCl3
B
2.(2021·浙江东阳中学月考)下列实验中,对现象的叙述正确的是( )
A.铁在氯气中燃烧出现红棕色烟雾
B.铜在氯气中燃烧产生绿色的烟
C.氢气在氯气中燃烧发出淡蓝色火焰
D.钠在氯气中燃烧生成白色的固体
D
3.(2021·浙江温州5月期末)下列有关说法正确的是( )
A.钢铁在潮湿空气中生锈主要是发生了化学腐蚀
B.还原铁粉可用作贮存富脂类食品时的脱氧剂
C.煮沸FeCl3饱和溶液可制得氢氧化铁胶体
D.过量的Fe在Cl2中燃烧得到FeCl2
B
1. 铁的氧化物
知识点二 铁的重要化合物
FeO Fe2O3 Fe3O4
俗称 — 铁红 磁性氧化铁
颜色、状态 黑色粉末 红棕色粉末 黑色晶体
物质类别 碱性氧化物 不是碱性氧化物
共同性质 高温时,都能被C、CO、H2、Al等还原剂还原,生成单质铁
2. 铁的两种氢氧化物
Fe(OH)2 Fe(OH)3
颜色、状态 白色固体 红褐色固体
热稳定性 — 2Fe(OH)3 Fe2O3+3H2O
制备方法 可溶性亚铁盐与碱反应: Fe2++2OH- = Fe(OH)2↓ 可溶性铁盐与碱反应:Fe3++3OH- = Fe(OH)3↓
二者的转化 在空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,白色沉淀迅速变成灰绿色,最后变成红褐色:4Fe(OH)2+O2+2H2O=4Fe(OH)3
(1)Fe2+的性质
①Fe2+中Fe元素显+2价,处于中间价态,既有氧化性,又有还原性。遇氧化性较强的物质如Br2、Cl2、H2O2、O2、N(H+)、Mn(H+)等,均表现还原性。
Cl2+2Fe2+ = 2Fe3++2Cl-; 2Fe2++2H++H2O2 = 2Fe3++2H2O;
配制Fe2+的盐溶液时要加少量铁粉防止Fe2+被氧化。
3. 铁盐和亚铁盐
(2)Fe3+的性质
①Fe3+具有较强的氧化性,它能氧化Fe、Cu、HI、H2S等,因此Fe3+与S2-、I-等不能大量共存。
2Fe3++Fe = 3Fe2+; 2Fe3++Cu = 2Fe2++Cu2+; 2Fe3++2I- = 2Fe2++I2。
②Fe3+能与碱溶液反应生成Fe(OH)3红褐色沉淀。
③Fe3+与KSCN溶液反应 Fe3++3SCN- Fe(SCN)3,溶液变红色,常用于检验溶液中是否含Fe3+。
4. Fe2+、Fe3+的检验
(1)利用显色反应
①用KSCN溶液和氯水
②用NaOH溶液
1.(浙江学考组合题)判断正误。
(1)(2021·浙江7月学考)氯化铁溶液与铁反应的离子方程式:2Fe3++Fe===3Fe2+( )
(2)(2018·浙江4月学考)氢氧化铁胶体能用于净水( )
(3)(2017·浙江4月学考)氯化铁溶液可用于制作印刷铜电路板( )
√
√
√
例1 [2021·杭州西湖高级中学检测] 把铁片放入下列溶液中,发生化学反应且溶液的质量减小的是 ( )
A.稀盐酸 B.CuCl2溶液 C.FeCl3溶液 D.Na2SO4溶液
B
考查点1 铁及其化合物的性质
变式 [2020·浙江7月学考] 某固体混合物X可能含有Cu、Fe、Fe2O3、Ca(OH)2和Na2CO3中的几种。为确定其组成,某同学进行了如下实验:
已知:向溶液B中滴加KSCN溶液,未出现血红色。下列推断正确的是( )
A.固体混合物X中一定含Ca(OH)2和Na2CO3
B.固体混合物X中若含Cu,则一定还含Fe2O3
C.气体B一定是纯净物
D.溶液B中一定含2种金属阳离子
B
例2 [2021·浙江余姚中学期中] 将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100 mL 4.40 mol·L-1盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28 g。过滤,滤液中无Cu2+,将滤液加水稀释到200 mL,测得其中c(H+)为0.40 mol·L-1。则原混合物中氧化铁的质量是( )
A.3.2 g B.4.8 g C.6.4 g D.8 g
C
考查点2 与铁及其化合物相关的计算
变式 将3.84 g Fe和Fe2O3的混合物溶于120 mL的盐酸,刚好完全反应,生成0.03 mol H2,若反应后的溶液中无Fe3+,且溶液体积不变。试求:
(1)原混合物中Fe2O3的质量为 g;
(2)原盐酸的物质的量浓度为 mol·L-1。
1.6
1
5.(2021·浙江苍南卫城中学7月学考模拟)下列有关铁及其化合物的说法中正确的是( )
A.Fe3O4为红棕色晶体
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.除去FeCl3溶液中的FeCl2杂质可以向溶液中通入氯气
D.Fe3+与KSCN试剂产生红色沉淀
C
6.(2021·浙江温州5月高一联考)“百炼成钢”是指反复将炽热的生铁在空气中锤打,转化为坚硬的钢,其实质是对生铁的不断除杂过程。下列关于物质的除杂叙述不正确的是( )
D
选项 被提纯物质 杂质 除杂试剂或方法
A FeCl3溶液 FeCl2 通入适量Cl2
B FeCl2溶液 FeCl3 加入过量铁粉并过滤
C 铁粉 铝粉 加入过量NaOH溶液并过滤
D Fe(OH)3 Fe(OH)2 在空气中灼烧
1. 合金及其性质
知识点三 金属材料
2. 铝及其化合物的性质
(1)铝的单质
(2)氧化铝
(3)氢氧化铝
①Al(OH)3+3H+ = Al3++3H2O;
②Al(OH)3+OH- = Al+2H2O;
③2Al(OH)3 Al2O3+3H2O。
例3 下列反应的离子方程式书写正确的是( )
A.氧化铝溶于盐酸:Al2O3+6H+ = 2Al3++3H2O
B.铝溶于NaOH溶液:Al+2OH- = Al+H2↑
C.铝溶于盐酸:Al+2H+ = Al3++H2↑
D.氧化铝溶于NaOH溶液:Al2O3+OH- = Al+H2O
A
考查点3 铝及其化合物的基本性质
5.铝与盐酸和氢氧化钠溶液反应的量的关系:
(1)等量的铝分别与足量的盐酸和氢氧化钠溶液反应,消耗盐酸和氢氧化钠的物质的量之比为________。
(2)等量的铝分别与足量的盐酸和氢氧化钠溶液反应,相同状况下,产生H2的体积比为________。
(3)足量的铝分别与等物质的量浓度、等体积的盐酸和氢氧化钠溶液反应,相同状况下,产生H2的体积比为________。
6.下列物质中,既能与强酸反应,又能与强碱反应的是( )
①Na2CO3 ②Al ③Al2O3 ④Al(OH)3 ⑤NaHCO3
A.②③④ B.②③④⑤ C.①③④⑤ D.①②③④⑤
B
7.下列说法正确的是( )
A.铁易生锈,而铝在空气中较稳定,所以铁比铝活泼
B.铝不能与氯气反应
C.氧化镁、氧化铝都可用作耐火材料
D.工业上均用电解熔融氧化物的方法制金属镁和铝
C
变式 如图是从铝土矿(主要成分是Al2O3,含有Fe2O3杂质)中提纯Al2O3的简单示意图。其中涉及的一个反应是2NaAlO2+CO2+3H2O = Na2CO3+2Al(OH)3↓。
(1)图示中实验操作a是 ;加入的试剂②是 (填化学式)。
过滤
Ca(OH)2或Ba(OH)2
(2)试写出下列物质(或溶液中的主要溶质)的化学式:
B ;D ;H 。
(3)写出下列化学方程式。
①铝土矿→A: 。
②E→F: 。
Al2O3+2NaOH=2NaAlO2+H2O
2Al(OH)3 Al2O3+3H2O
NaAlO2
Na2CO3
CaCO3或BaCO3
12.(2021·浙江台州书生中学6月学考模拟) 将2.80 g含氧化镁的镁条完全溶于50.0 mL硫酸溶液后,滴加2.00 mol/L氢氧化钠液,恰好完全沉淀时用去200.0 mL。将所得沉淀灼烧、冷却后称量得固体质量为4.40 g。
(1)上述硫酸的物质的量浓度c(H2SO4)=________________________。
(2)镁条中氧化镁和镁的物质的量之比为n(MgO)∶n(Mg)=____________________。
答案 (1) 4.0 mol· L-1 (2)1∶10
9.(2021·浙江丽水测试)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。将15.8 g KMnO4与足量的浓盐酸充分反应,产生气体的体积均在标准状况下测定,请计算:
(1)高锰酸钾的物质的量是________ mol。
(2)产生的Cl2的体积是________ L。
(3)若用MnO2与足量的浓盐酸反应制取相同体积的Cl2,理论上需要MnO2的质量是________克。
答案 (1)0.3 mol (2)6.72 L
同课章节目录
