2023年普通高中化学学业水平考试学考复习——专题8 金属材料(23张ppt)
文档属性
| 名称 | 2023年普通高中化学学业水平考试学考复习——专题8 金属材料(23张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-28 08:01:05 | ||
图片预览







文档简介
(共23张PPT)
组织建设
化学 · 学考
专题8 金属材料
【学业水平目标】
1.知道合金的概念,了解常见合金的分类、组成和用途。
2.了解合金在生产、生活中的应用,会合理选用金属材料。
3.掌握物质的量在化学方程式中的应用,学会用化学方程式计算的一般方法和
步骤。
一、合金
二、铝与氧化铝的化学性质
///////
///////
三、物质的量在化学方程式计算中的应用
///////
(一)合金的概念
1.定义:由两种或两种以上的金属或金属与非金属熔合而成的具有金属特性的物质。
2.性质:合金具有许多优良的物理、化学或机械性能,在许多方面不同于各成分金属。
(1)硬度:合金的硬度一般大于成分金属。
(2)熔点:合金的熔点多数低于成分金属。
一、合金
(二)常见合金
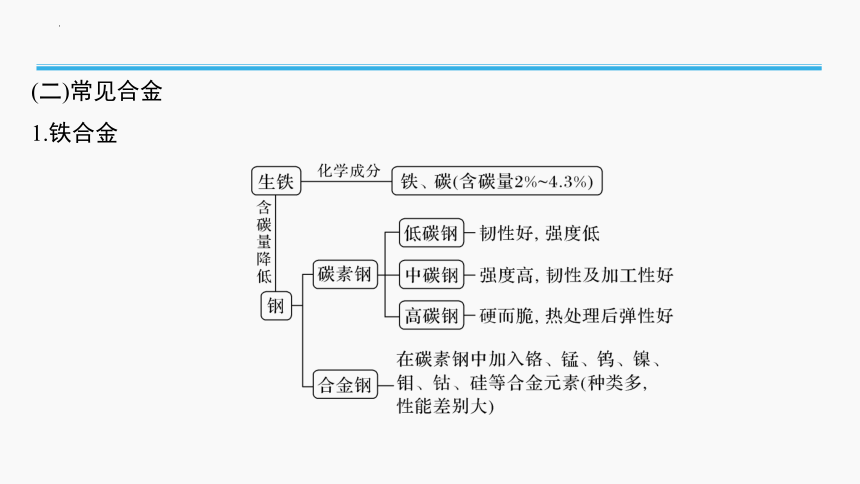
1.铁合金
向铝中加入少量合金元素,如Cu、Mg、Si、Mn、Zn及稀土元素等,可制成铝合金,例如硬铝。
2.铝合金
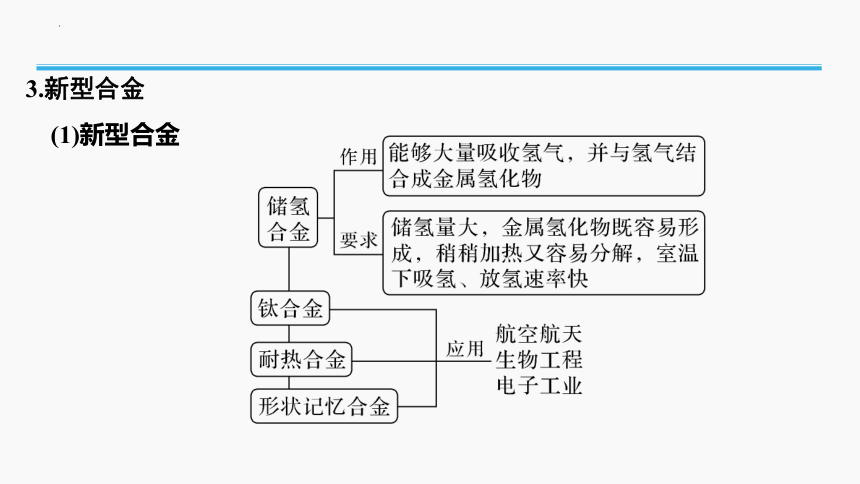
3.新型合金
(1)新型合金
(2)用途广泛的稀土金属
①镧系元素(57~71号元素)及钇和钪,共17种元素为稀土元素。
我国拥有丰富的稀土资源,现已查明的世界稀土资源中,80%分布在我国,并且品种齐全。
②稀土金属有着广泛的用途,它既可以单独使用,也可用于生产合金。在合金中加入适量稀土金属,能大大改善合金的性能。因而,稀土元素又被称为冶金工业的维生素。
③稀土金属可用于制造引火合金、永磁材料、超导材料和发光材料等。稀土金属除广泛应用在冶金、石油化工、材料工业、医药及农业领域外,还逐渐深入到许多现代科技领域。
1.(2021·浙江1月仿真模拟)钢铁是铁碳合金的总称,其强度高、价格便宜、应
用广泛。在以下关于不锈钢和普通钢的认识中,你认为正确的是( )
A.它们的组成元素是相同的
B.耐腐蚀的性能不同
C.它们都属于钢,因此物理性质相同
D.构成普通钢和不锈钢的主要元素都是铁,因此它们的化学性质相同
B
2.(2021·浙江台州书生中学高一测试)下列说法正确的是( )
A.用来制造储存氢气所用钢瓶的合金是储氢合金
B.不锈钢是最常见的新型合金
C.新型合金主要应用于航天航空﹑生物工程等领域
D.碳纤维复合材料属于新型合金材料
C
3.(2021·浙江金华曙光中学6月测试)下列出土文物中,不属于金属材料的是
( )
A
4.(2021·浙江温州越秀中学5月测试)我国“蛟龙”号载人潜水器已成功下潜至海中7 062.68米处。“蛟龙”号载人潜水器的外壳是耐超高压的钛合金,下列有关合金的说法正确的是( )
A.钛合金是一种新型金属单质
B.钛合金熔点比钛金属高
C.钛合金的硬度与钛单质相同
D.青铜、合金钢和硬铝都是合金
D
二、铝与氧化铝的化学性质
1.Al与O2的反应:4Al+3O2===2Al2O3。
2.Al、Al2O3分别与盐酸的反应
2Al+6HCl===2AlCl3+3H2↑。
Al2O3+6HCl===2AlCl3+3H2O。
3.Al、Al2O3分别与NaOH溶液的反应
2Al+2NaOH+2H2O===2NaAlO2+3H2↑。
Al2O3+2NaOH===2NaAlO2+H2O。
4.两性氧化物
像Al2O3这类既能与酸反应,生成盐和水,又能与碱反应,生成盐和水的氧化物,叫两性氧化物。
5.铝与盐酸和氢氧化钠溶液反应的量的关系:
(1)等量的铝分别与足量的盐酸和氢氧化钠溶液反应,消耗盐酸和氢氧化钠的物质的量之比为________。
(2)等量的铝分别与足量的盐酸和氢氧化钠溶液反应,相同状况下,产生H2的体积比为________。
(3)足量的铝分别与等物质的量浓度、等体积的盐酸和氢氧化钠溶液反应,相同状况下,产生H2的体积比为________。
6.下列物质中,既能与强酸反应,又能与强碱反应的是( )
①Na2CO3 ②Al ③Al2O3 ④Al(OH)3 ⑤NaHCO3
A.②③④ B.②③④⑤ C.①③④⑤ D.①②③④⑤
B
7.下列说法正确的是( )
A.铁易生锈,而铝在空气中较稳定,所以铁比铝活泼
B.铝不能与氯气反应
C.氧化镁、氧化铝都可用作耐火材料
D.工业上均用电解熔融氧化物的方法制金属镁和铝
C
8.(2021·浙江浙北6月高一联考)下列有关铝的说法正确的是( )
A.铝制品表面虽然有致密的氧化膜,但若遇到酸、碱及氯化钠溶液均会发生反应而被腐蚀
B.利用铝热反应可以焊接钢轨,也可以用于冶炼各种活泼金属
C.铝元素在人体中积累可使人慢性中毒,因此要严禁明使矾用于食物膨化剂中
D.将一块铝投入到硫酸铜溶液中, 一段时间内无明显现象, 说明铝不能与硫酸铜溶液反应
A
三、物质的量在化学方程式计算中的应用
(一)物质的量与各物理量之间的关系
(二)物质的量在化学方程式计算中的应用
化学方程式 2Na+2H2O===2NaOH+H2↑
化学计量数之比 2∶2∶2∶1
扩大NA倍之后 2NA∶2NA∶2NA∶NA
物质的量之比 2 mol∶2 mol∶2 mol∶1 mol
结论 化学方程式中各物质的化学计量数之比=各物质的粒子数之比=各物质的物质的量之比
9.(2021·浙江丽水测试)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。将15.8 g KMnO4与足量的浓盐酸充分反应,产生气体的体积均在标准状况下测定,请计算:
(1)高锰酸钾的物质的量是________ mol。
(2)产生的Cl2的体积是________ L。
(3)若用MnO2与足量的浓盐酸反应制取相同体积的Cl2,理论上需要MnO2的质量是________克。
答案 (1)0.3 mol (2)6.72 L
12.(2021·浙江台州书生中学6月学考模拟) 将2.80 g含氧化镁的镁条完全溶于50.0 mL硫酸溶液后,滴加2.00 mol/L氢氧化钠液,恰好完全沉淀时用去200.0 mL。将所得沉淀灼烧、冷却后称量得固体质量为4.40 g。
(1)上述硫酸的物质的量浓度c(H2SO4)=________________________。
(2)镁条中氧化镁和镁的物质的量之比为n(MgO)∶n(Mg)=____________________。
答案 (1) 4.0 mol· L-1 (2)1∶10
组织建设
化学 · 学考
专题8 金属材料
【学业水平目标】
1.知道合金的概念,了解常见合金的分类、组成和用途。
2.了解合金在生产、生活中的应用,会合理选用金属材料。
3.掌握物质的量在化学方程式中的应用,学会用化学方程式计算的一般方法和
步骤。
一、合金
二、铝与氧化铝的化学性质
///////
///////
三、物质的量在化学方程式计算中的应用
///////
(一)合金的概念
1.定义:由两种或两种以上的金属或金属与非金属熔合而成的具有金属特性的物质。
2.性质:合金具有许多优良的物理、化学或机械性能,在许多方面不同于各成分金属。
(1)硬度:合金的硬度一般大于成分金属。
(2)熔点:合金的熔点多数低于成分金属。
一、合金
(二)常见合金
1.铁合金
向铝中加入少量合金元素,如Cu、Mg、Si、Mn、Zn及稀土元素等,可制成铝合金,例如硬铝。
2.铝合金
3.新型合金
(1)新型合金
(2)用途广泛的稀土金属
①镧系元素(57~71号元素)及钇和钪,共17种元素为稀土元素。
我国拥有丰富的稀土资源,现已查明的世界稀土资源中,80%分布在我国,并且品种齐全。
②稀土金属有着广泛的用途,它既可以单独使用,也可用于生产合金。在合金中加入适量稀土金属,能大大改善合金的性能。因而,稀土元素又被称为冶金工业的维生素。
③稀土金属可用于制造引火合金、永磁材料、超导材料和发光材料等。稀土金属除广泛应用在冶金、石油化工、材料工业、医药及农业领域外,还逐渐深入到许多现代科技领域。
1.(2021·浙江1月仿真模拟)钢铁是铁碳合金的总称,其强度高、价格便宜、应
用广泛。在以下关于不锈钢和普通钢的认识中,你认为正确的是( )
A.它们的组成元素是相同的
B.耐腐蚀的性能不同
C.它们都属于钢,因此物理性质相同
D.构成普通钢和不锈钢的主要元素都是铁,因此它们的化学性质相同
B
2.(2021·浙江台州书生中学高一测试)下列说法正确的是( )
A.用来制造储存氢气所用钢瓶的合金是储氢合金
B.不锈钢是最常见的新型合金
C.新型合金主要应用于航天航空﹑生物工程等领域
D.碳纤维复合材料属于新型合金材料
C
3.(2021·浙江金华曙光中学6月测试)下列出土文物中,不属于金属材料的是
( )
A
4.(2021·浙江温州越秀中学5月测试)我国“蛟龙”号载人潜水器已成功下潜至海中7 062.68米处。“蛟龙”号载人潜水器的外壳是耐超高压的钛合金,下列有关合金的说法正确的是( )
A.钛合金是一种新型金属单质
B.钛合金熔点比钛金属高
C.钛合金的硬度与钛单质相同
D.青铜、合金钢和硬铝都是合金
D
二、铝与氧化铝的化学性质
1.Al与O2的反应:4Al+3O2===2Al2O3。
2.Al、Al2O3分别与盐酸的反应
2Al+6HCl===2AlCl3+3H2↑。
Al2O3+6HCl===2AlCl3+3H2O。
3.Al、Al2O3分别与NaOH溶液的反应
2Al+2NaOH+2H2O===2NaAlO2+3H2↑。
Al2O3+2NaOH===2NaAlO2+H2O。
4.两性氧化物
像Al2O3这类既能与酸反应,生成盐和水,又能与碱反应,生成盐和水的氧化物,叫两性氧化物。
5.铝与盐酸和氢氧化钠溶液反应的量的关系:
(1)等量的铝分别与足量的盐酸和氢氧化钠溶液反应,消耗盐酸和氢氧化钠的物质的量之比为________。
(2)等量的铝分别与足量的盐酸和氢氧化钠溶液反应,相同状况下,产生H2的体积比为________。
(3)足量的铝分别与等物质的量浓度、等体积的盐酸和氢氧化钠溶液反应,相同状况下,产生H2的体积比为________。
6.下列物质中,既能与强酸反应,又能与强碱反应的是( )
①Na2CO3 ②Al ③Al2O3 ④Al(OH)3 ⑤NaHCO3
A.②③④ B.②③④⑤ C.①③④⑤ D.①②③④⑤
B
7.下列说法正确的是( )
A.铁易生锈,而铝在空气中较稳定,所以铁比铝活泼
B.铝不能与氯气反应
C.氧化镁、氧化铝都可用作耐火材料
D.工业上均用电解熔融氧化物的方法制金属镁和铝
C
8.(2021·浙江浙北6月高一联考)下列有关铝的说法正确的是( )
A.铝制品表面虽然有致密的氧化膜,但若遇到酸、碱及氯化钠溶液均会发生反应而被腐蚀
B.利用铝热反应可以焊接钢轨,也可以用于冶炼各种活泼金属
C.铝元素在人体中积累可使人慢性中毒,因此要严禁明使矾用于食物膨化剂中
D.将一块铝投入到硫酸铜溶液中, 一段时间内无明显现象, 说明铝不能与硫酸铜溶液反应
A
三、物质的量在化学方程式计算中的应用
(一)物质的量与各物理量之间的关系
(二)物质的量在化学方程式计算中的应用
化学方程式 2Na+2H2O===2NaOH+H2↑
化学计量数之比 2∶2∶2∶1
扩大NA倍之后 2NA∶2NA∶2NA∶NA
物质的量之比 2 mol∶2 mol∶2 mol∶1 mol
结论 化学方程式中各物质的化学计量数之比=各物质的粒子数之比=各物质的物质的量之比
9.(2021·浙江丽水测试)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。将15.8 g KMnO4与足量的浓盐酸充分反应,产生气体的体积均在标准状况下测定,请计算:
(1)高锰酸钾的物质的量是________ mol。
(2)产生的Cl2的体积是________ L。
(3)若用MnO2与足量的浓盐酸反应制取相同体积的Cl2,理论上需要MnO2的质量是________克。
答案 (1)0.3 mol (2)6.72 L
12.(2021·浙江台州书生中学6月学考模拟) 将2.80 g含氧化镁的镁条完全溶于50.0 mL硫酸溶液后,滴加2.00 mol/L氢氧化钠液,恰好完全沉淀时用去200.0 mL。将所得沉淀灼烧、冷却后称量得固体质量为4.40 g。
(1)上述硫酸的物质的量浓度c(H2SO4)=________________________。
(2)镁条中氧化镁和镁的物质的量之比为n(MgO)∶n(Mg)=____________________。
答案 (1) 4.0 mol· L-1 (2)1∶10
同课章节目录
