2023年普通高中化学学业水平考试学考复习——专题11 硫及其化合物(24张ppt)
文档属性
| 名称 | 2023年普通高中化学学业水平考试学考复习——专题11 硫及其化合物(24张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-28 00:00:00 | ||
图片预览







文档简介
(共24张PPT)
组织建设
化学 · 学考
专题11 硫及其化合物
利用“价—类”二维图认识硫及其化合物的转化关系
1. 物理性质
硫(俗称硫黄)是一种黄色晶体,质脆,易研成粉末。硫难溶于水,微溶于酒精,易溶于二硫化碳。
2.化学性质
硫在元素周期表中处于第三周期第ⅥA族,其原子结构示意图为 ,最外层上有6个电子。
知识点一 硫的性质
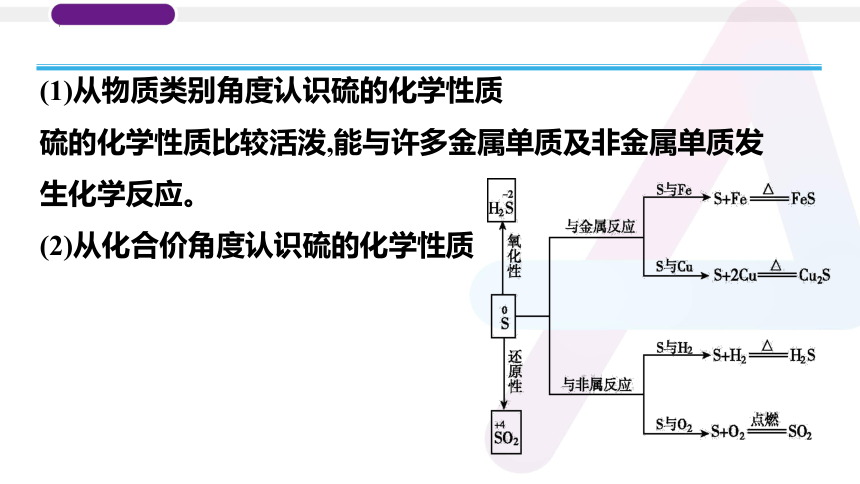
(1)从物质类别角度认识硫的化学性质
硫的化学性质比较活泼,能与许多金属单质及非金属单质发生化学反应。
(2)从化合价角度认识硫的化学性质
酸性氧化 物的性质 (与CO2性 质相似) (1)SO2+H2O H2SO3
(2)与NaOH溶液反应:
SO2(少量)+2NaOH=Na2SO3+H2O
SO2(过量)+NaOH=NaHSO3
(3)通入澄清石灰水,生成白色沉淀:
SO2+Ca(OH)2 = CaSO3↓+H2O
弱氧化性 SO2+2H2S = 3S+2H2O
知识点二 二氧化硫的性质
强还原性 能使酸性高锰酸钾溶液、氯水、溴水、碘水褪色,能被氧气、双氧水氧:SO2+Cl2+2H2O=H2SO4+2HCl
2SO2+O2 2SO3(工业制硫酸的关键步骤) SO2+H2O2 = H2SO4
漂白性 能与某些有色物质生成不稳定的无色物质而使其褪色,加热时无色物质又会分解,恢复原来的颜色,因此常用品红溶液检验SO2
1. 浓硫酸的特性
浓硫酸主要以硫酸分子存在,除了具有酸的通性,还具有以下特性:
(1)吸水性(物质有H2O时)
浓硫酸具有吸水性,常用作干燥剂[不可干燥碱性和还原性气体(SO2除外)]。
(2)脱水性(物质无H2O时)
浓硫酸按水的组成比,夺取某些有机物中的氢、氧原子形成水分子。
知识点三 浓硫酸的特性及工业制法
(3)强氧化性
常温可以与铁、铝反应使其钝化,加热时可与绝大部分金属和一些非金属及某些化合物反应。
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O;
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。
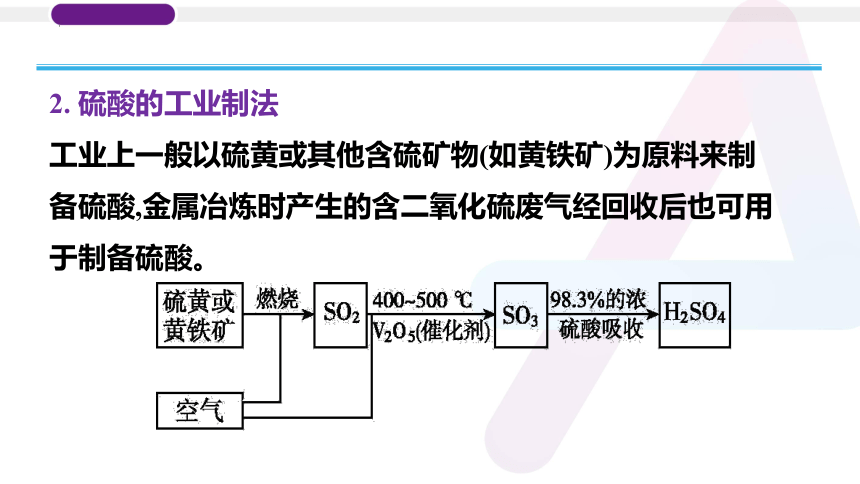
2. 硫酸的工业制法
工业上一般以硫黄或其他含硫矿物(如黄铁矿)为原料来制备硫酸,金属冶炼时产生的含二氧化硫废气经回收后也可用于制备硫酸。
1.辨析易错易混
(1)硫与汞反应生成硫化亚汞,体现了硫的弱氧化性( )
(2)硫在空气中燃烧的产物是二氧化硫,在纯氧中燃烧的产物是三氧化硫( )
(3)硫黄易溶于CS2,所以可用CS2溶解试管内壁的硫( )
(4)硫和氯气分别与铁反应后铁元素的价态相同( )
×
×
√
×
(5)SO2气体通入BaCl2溶液产生白色沉淀BaSO3( )
(6)SO2是酸性氧化物,溶于水能得到稳定的亚硫酸( )
(7)因为SO2具有漂白性,所以它能使品红溶液、酸性KMnO4溶液、含有酚酞的NaOH溶液褪色( )
×
×
×
例1 制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是( )
A.制取SO2 B.验证漂白性 C.收集SO2 D.尾气处理
B
考查点1 二氧化硫的性质
变式 已知Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O。如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。
下列有关说法不正确的是( )
A.蓝色石蕊试纸先变红后褪色
B.品红试纸、蘸有酸性KMnO4溶液的
滤纸均褪色,前者证明SO2的漂白性,后
者说明SO2的还原性
C.湿润的淀粉-KI试纸未变蓝说明SO2的氧化性弱于I2
D.NaOH溶液可用于除去实验中多余的SO2
A
例2 下列关于硫酸性质的描述中,正确的是( )
A.浓H2SO4有强氧化性,稀H2SO4完全没有氧化性
B.浓硫酸使蓝矾(CuSO4·5H2O)变成白色粉末,体现了浓硫酸的强氧化性
C.稀硫酸不与铜反应,但把铜片放在浓H2SO4中立即发生剧烈反应
D.常温下铁制容器能盛装浓硫酸,在受热时铁制容器的安全性大大降低
D
考查点2 浓硫酸的性质
变式 某同学欲探究浓硫酸与铜反应及有关产物的性质,设计实验装置如下,回答:
(1)①铜丝的底端设计成螺旋状,其优点是 。
②浸有NaOH溶液的棉团的作用是 。
(2)下列有关实验现象和操作正确的是 。
A.Ⅱ试管中的品红溶液红色褪去
B.Ⅲ试管中的石蕊溶液先变红后褪色
C.实验完成后先停止加热,再断开连接处的橡胶管
D.实验完成后,将Ⅰ试管中的物质慢慢倒入少量水中,得到蓝色溶液
增大接触面积,加快反应速率
吸收尾气(SO2),防止污染空气
AD
例3 元素的“价—类”二维图是学习元素及其化合物的重要模型和工具。如图为硫元素的“价—类”二维图,其中的箭头表示部分物质间的转化关系。下列说法正确的是( )
A.附着有X的试管常用酒精清洗
B.Y使溴水褪色体现了其漂白性
C.加热条件下,Z的浓溶液与铜反
应能实现转化②
D.Y与H2S气体混合能实现转化①
C
考查点3 含硫物质之间的相互转化
2.(2021·浙江9月联考)下列说法正确的是( )
A.二氧化硫可用于漂白纸浆以及草帽等编织物
B.二氧化硫有毒,严禁将其添加到任何食品和饮料中
C.二氧化硫使品红、溴水褪色的原因是它有漂白性
D.二氧化硫可以使石蕊试液褪色
A
3.(2021·浙江“七彩阳光”6月测试)将二氧化硫通入下列试剂,能依次证明SO2具有还原性、漂白性、氧化性、酸性氧化物性质的是( )
①溴水 ②品红溶液 ③酸性高锰酸钾溶液 ④硝酸钡溶液 ⑤含酚酞的氢氧化钠溶液 ⑥氢硫酸 ⑦紫色石蕊试液 ⑧氯化铁溶液
A.①⑤⑥④ B.⑧②⑥⑤
C.③⑦⑥⑤ D.④②⑤①
B
4.(2020·浙江1月学考)100%硫酸吸收SO3可生成焦硫酸(分子式为H2S2O7或H2SO4·SO3)。下列说法不正确的是( )
A.Na2S2O7水溶液呈中性
B.焦硫酸具有强氧化性
C.Na2S2O7可与碱性氧化物反应生成新盐
D.100%硫酸吸收SO3生成焦硫酸的变化是化学变化
A
9.(2021·浙江金华曙光中学6月测试)为了验证木炭可被浓硫酸氧化成CO2,选用如图所示装置(内含物质)进行实验。
(1)按气流由左向右的流向,连接如图所示装置的正确顺序是______(填字母,下同)接______,______接______,______接______。
(2)若实验检验出有CO2生成,则装置乙、丙中的现象分别为:装置乙中______,装置丙中______。
(3)装置丁中酸性KMnO4溶液的作用是______________________。
(4)写出装置甲中所发生反应的化学方程式: _________________。
10.(2021·浙江杭州学军中学6月高一测试)硫是生物必需的营养元素之一,下列关于自然界中硫循环(如图所示)说法正确的是( )
A.含硫杆菌及好氧/厌氧菌促进了硫的循环
B.硫循环中硫的化合物均为无机物
C.上述硫循环中硫元素均被氧化
D.烧煤时加石灰石,可减少酸雨及温室气体的排放
A
11.(2021·浙江杭州富阳区5月联考)硫在空气中燃烧生成气体A,把A溶于水得溶液B,向B中滴加溴水,溴水褪色,B变成C,在C里加Na2S产生气体D,把D通入B溶液得浅黄色沉淀E。A、B、C、D、E都含同一种元素。下列按A、B、C、D、E顺序排序的是( )
A.SO2、H2SO4、H2SO3、H2S、S
B.SO2、H2SO3、H2SO4、H2S、S
C.SO2、H2SO3、H2SO4、SO3、Na2S2O3
D.SO3、H2SO4、H2SO3、SO2、Na2S2O3
B
13.(2021·浙江金华曙光中学6月高一测试)硫及
部分含硫化合物的转化关系如图所示。
回答下列问题:
(1)上述转化中需加入还原剂才能实现的是________(填序号)。
(2)反应②转化方法之一是使S与浓硫酸在加热条件下反应,该反应的化学方程式为________________________________________________________。
(3)反应③可由SO2与H2S混合实现,反应的化学方程式为________________。
(4)反应④可由SO2与某过氧化物化合实现,该过氧化物为____________。
(5)常温下,上述转化中涉及的气体不能用浓硫酸干燥的是____________________(填化学式)。
14.(2019·浙江1月学考)为了探究某固体化合物X(仅含3种元素,相对分子质量小于200)的组成和性质,设计并完成如下实验,其中X、A、B、C、D均为常见化合物。
请回答:
(1)黄色溶液中的金属阳离子是________。
(2)固体A→白色沉淀B的离子方程式是__________________。
(3)X的化学式是___________。
组织建设
化学 · 学考
专题11 硫及其化合物
利用“价—类”二维图认识硫及其化合物的转化关系
1. 物理性质
硫(俗称硫黄)是一种黄色晶体,质脆,易研成粉末。硫难溶于水,微溶于酒精,易溶于二硫化碳。
2.化学性质
硫在元素周期表中处于第三周期第ⅥA族,其原子结构示意图为 ,最外层上有6个电子。
知识点一 硫的性质
(1)从物质类别角度认识硫的化学性质
硫的化学性质比较活泼,能与许多金属单质及非金属单质发生化学反应。
(2)从化合价角度认识硫的化学性质
酸性氧化 物的性质 (与CO2性 质相似) (1)SO2+H2O H2SO3
(2)与NaOH溶液反应:
SO2(少量)+2NaOH=Na2SO3+H2O
SO2(过量)+NaOH=NaHSO3
(3)通入澄清石灰水,生成白色沉淀:
SO2+Ca(OH)2 = CaSO3↓+H2O
弱氧化性 SO2+2H2S = 3S+2H2O
知识点二 二氧化硫的性质
强还原性 能使酸性高锰酸钾溶液、氯水、溴水、碘水褪色,能被氧气、双氧水氧:SO2+Cl2+2H2O=H2SO4+2HCl
2SO2+O2 2SO3(工业制硫酸的关键步骤) SO2+H2O2 = H2SO4
漂白性 能与某些有色物质生成不稳定的无色物质而使其褪色,加热时无色物质又会分解,恢复原来的颜色,因此常用品红溶液检验SO2
1. 浓硫酸的特性
浓硫酸主要以硫酸分子存在,除了具有酸的通性,还具有以下特性:
(1)吸水性(物质有H2O时)
浓硫酸具有吸水性,常用作干燥剂[不可干燥碱性和还原性气体(SO2除外)]。
(2)脱水性(物质无H2O时)
浓硫酸按水的组成比,夺取某些有机物中的氢、氧原子形成水分子。
知识点三 浓硫酸的特性及工业制法
(3)强氧化性
常温可以与铁、铝反应使其钝化,加热时可与绝大部分金属和一些非金属及某些化合物反应。
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O;
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。
2. 硫酸的工业制法
工业上一般以硫黄或其他含硫矿物(如黄铁矿)为原料来制备硫酸,金属冶炼时产生的含二氧化硫废气经回收后也可用于制备硫酸。
1.辨析易错易混
(1)硫与汞反应生成硫化亚汞,体现了硫的弱氧化性( )
(2)硫在空气中燃烧的产物是二氧化硫,在纯氧中燃烧的产物是三氧化硫( )
(3)硫黄易溶于CS2,所以可用CS2溶解试管内壁的硫( )
(4)硫和氯气分别与铁反应后铁元素的价态相同( )
×
×
√
×
(5)SO2气体通入BaCl2溶液产生白色沉淀BaSO3( )
(6)SO2是酸性氧化物,溶于水能得到稳定的亚硫酸( )
(7)因为SO2具有漂白性,所以它能使品红溶液、酸性KMnO4溶液、含有酚酞的NaOH溶液褪色( )
×
×
×
例1 制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是( )
A.制取SO2 B.验证漂白性 C.收集SO2 D.尾气处理
B
考查点1 二氧化硫的性质
变式 已知Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O。如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。
下列有关说法不正确的是( )
A.蓝色石蕊试纸先变红后褪色
B.品红试纸、蘸有酸性KMnO4溶液的
滤纸均褪色,前者证明SO2的漂白性,后
者说明SO2的还原性
C.湿润的淀粉-KI试纸未变蓝说明SO2的氧化性弱于I2
D.NaOH溶液可用于除去实验中多余的SO2
A
例2 下列关于硫酸性质的描述中,正确的是( )
A.浓H2SO4有强氧化性,稀H2SO4完全没有氧化性
B.浓硫酸使蓝矾(CuSO4·5H2O)变成白色粉末,体现了浓硫酸的强氧化性
C.稀硫酸不与铜反应,但把铜片放在浓H2SO4中立即发生剧烈反应
D.常温下铁制容器能盛装浓硫酸,在受热时铁制容器的安全性大大降低
D
考查点2 浓硫酸的性质
变式 某同学欲探究浓硫酸与铜反应及有关产物的性质,设计实验装置如下,回答:
(1)①铜丝的底端设计成螺旋状,其优点是 。
②浸有NaOH溶液的棉团的作用是 。
(2)下列有关实验现象和操作正确的是 。
A.Ⅱ试管中的品红溶液红色褪去
B.Ⅲ试管中的石蕊溶液先变红后褪色
C.实验完成后先停止加热,再断开连接处的橡胶管
D.实验完成后,将Ⅰ试管中的物质慢慢倒入少量水中,得到蓝色溶液
增大接触面积,加快反应速率
吸收尾气(SO2),防止污染空气
AD
例3 元素的“价—类”二维图是学习元素及其化合物的重要模型和工具。如图为硫元素的“价—类”二维图,其中的箭头表示部分物质间的转化关系。下列说法正确的是( )
A.附着有X的试管常用酒精清洗
B.Y使溴水褪色体现了其漂白性
C.加热条件下,Z的浓溶液与铜反
应能实现转化②
D.Y与H2S气体混合能实现转化①
C
考查点3 含硫物质之间的相互转化
2.(2021·浙江9月联考)下列说法正确的是( )
A.二氧化硫可用于漂白纸浆以及草帽等编织物
B.二氧化硫有毒,严禁将其添加到任何食品和饮料中
C.二氧化硫使品红、溴水褪色的原因是它有漂白性
D.二氧化硫可以使石蕊试液褪色
A
3.(2021·浙江“七彩阳光”6月测试)将二氧化硫通入下列试剂,能依次证明SO2具有还原性、漂白性、氧化性、酸性氧化物性质的是( )
①溴水 ②品红溶液 ③酸性高锰酸钾溶液 ④硝酸钡溶液 ⑤含酚酞的氢氧化钠溶液 ⑥氢硫酸 ⑦紫色石蕊试液 ⑧氯化铁溶液
A.①⑤⑥④ B.⑧②⑥⑤
C.③⑦⑥⑤ D.④②⑤①
B
4.(2020·浙江1月学考)100%硫酸吸收SO3可生成焦硫酸(分子式为H2S2O7或H2SO4·SO3)。下列说法不正确的是( )
A.Na2S2O7水溶液呈中性
B.焦硫酸具有强氧化性
C.Na2S2O7可与碱性氧化物反应生成新盐
D.100%硫酸吸收SO3生成焦硫酸的变化是化学变化
A
9.(2021·浙江金华曙光中学6月测试)为了验证木炭可被浓硫酸氧化成CO2,选用如图所示装置(内含物质)进行实验。
(1)按气流由左向右的流向,连接如图所示装置的正确顺序是______(填字母,下同)接______,______接______,______接______。
(2)若实验检验出有CO2生成,则装置乙、丙中的现象分别为:装置乙中______,装置丙中______。
(3)装置丁中酸性KMnO4溶液的作用是______________________。
(4)写出装置甲中所发生反应的化学方程式: _________________。
10.(2021·浙江杭州学军中学6月高一测试)硫是生物必需的营养元素之一,下列关于自然界中硫循环(如图所示)说法正确的是( )
A.含硫杆菌及好氧/厌氧菌促进了硫的循环
B.硫循环中硫的化合物均为无机物
C.上述硫循环中硫元素均被氧化
D.烧煤时加石灰石,可减少酸雨及温室气体的排放
A
11.(2021·浙江杭州富阳区5月联考)硫在空气中燃烧生成气体A,把A溶于水得溶液B,向B中滴加溴水,溴水褪色,B变成C,在C里加Na2S产生气体D,把D通入B溶液得浅黄色沉淀E。A、B、C、D、E都含同一种元素。下列按A、B、C、D、E顺序排序的是( )
A.SO2、H2SO4、H2SO3、H2S、S
B.SO2、H2SO3、H2SO4、H2S、S
C.SO2、H2SO3、H2SO4、SO3、Na2S2O3
D.SO3、H2SO4、H2SO3、SO2、Na2S2O3
B
13.(2021·浙江金华曙光中学6月高一测试)硫及
部分含硫化合物的转化关系如图所示。
回答下列问题:
(1)上述转化中需加入还原剂才能实现的是________(填序号)。
(2)反应②转化方法之一是使S与浓硫酸在加热条件下反应,该反应的化学方程式为________________________________________________________。
(3)反应③可由SO2与H2S混合实现,反应的化学方程式为________________。
(4)反应④可由SO2与某过氧化物化合实现,该过氧化物为____________。
(5)常温下,上述转化中涉及的气体不能用浓硫酸干燥的是____________________(填化学式)。
14.(2019·浙江1月学考)为了探究某固体化合物X(仅含3种元素,相对分子质量小于200)的组成和性质,设计并完成如下实验,其中X、A、B、C、D均为常见化合物。
请回答:
(1)黄色溶液中的金属阳离子是________。
(2)固体A→白色沉淀B的离子方程式是__________________。
(3)X的化学式是___________。
同课章节目录
