2023年普通高中化学学业水平考试学考复习——专题23物质的分离、提纯与检验(14张ppt)
文档属性
| 名称 | 2023年普通高中化学学业水平考试学考复习——专题23物质的分离、提纯与检验(14张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-28 11:41:14 | ||
图片预览




文档简介
(共14张PPT)
组织建设
化学 · 学考
第23讲 物质的分离、提纯与检验
1. 物质分离、提纯的区别
(1)物质的分离:将混合物中的各组分彼此分开得到相应纯净物的过程。
(2)物质的提纯:将混合物中的杂质除去的过程,也叫除杂。
知识点一 物质的分离与提纯
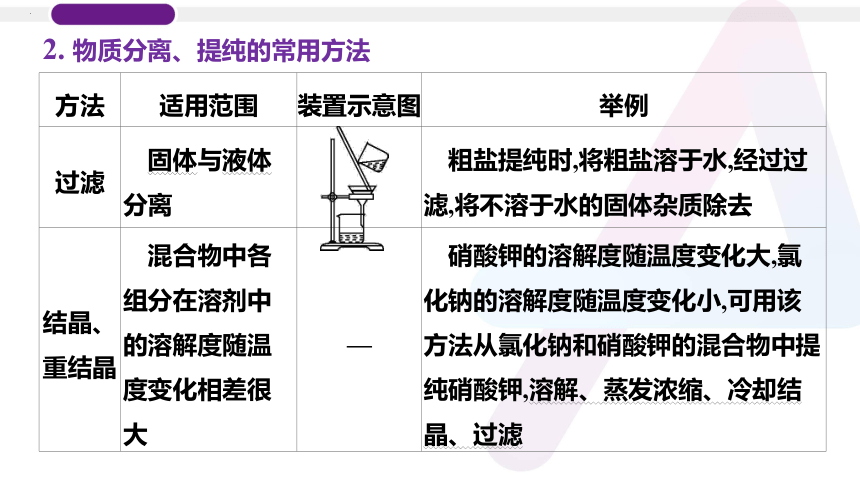
2. 物质分离、提纯的常用方法
方法 适用范围 装置示意图 举例
过滤 固体与液体分离 粗盐提纯时,将粗盐溶于水,经过过滤,将不溶于水的固体杂质除去
结晶、 重结晶 混合物中各组分在溶剂中的溶解度随温度变化相差很大 — 硝酸钾的溶解度随温度变化大,氯化钠的溶解度随温度变化小,可用该方法从氯化钠和硝酸钾的混合物中提纯硝酸钾,溶解、蒸发浓缩、冷却结晶、过滤
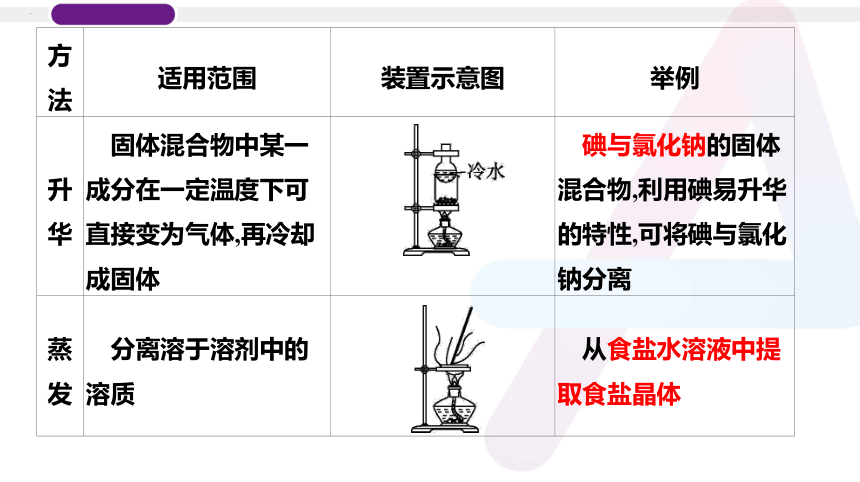
方法 适用范围 装置示意图 举例
升华 固体混合物中某一成分在一定温度下可直接变为气体,再冷却成固体 碘与氯化钠的固体混合物,利用碘易升华的特性,可将碘与氯化钠分离
蒸发 分离溶于溶剂中的溶质 从食盐水溶液中提取食盐晶体
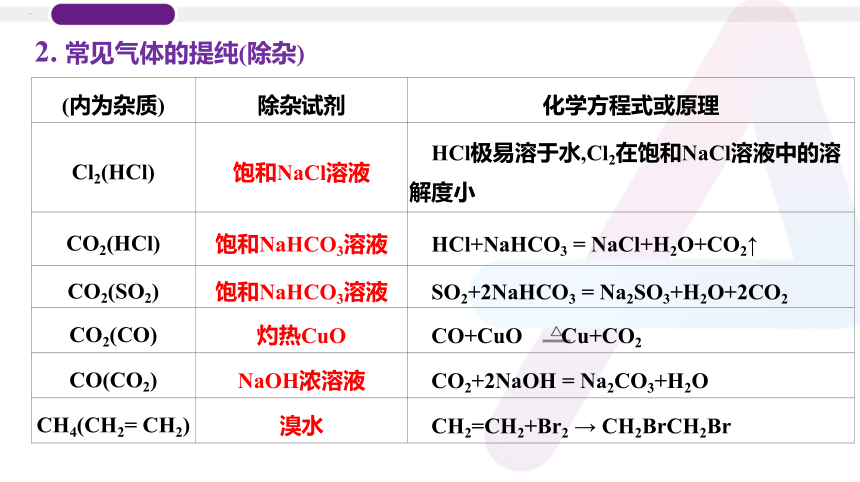
2. 常见气体的提纯(除杂)
(内为杂质) 除杂试剂 化学方程式或原理
Cl2(HCl) 饱和NaCl溶液 HCl极易溶于水,Cl2在饱和NaCl溶液中的溶解度小
CO2(HCl) 饱和NaHCO3溶液 HCl+NaHCO3 = NaCl+H2O+CO2↑
CO2(SO2) 饱和NaHCO3溶液 SO2+2NaHCO3 = Na2SO3+H2O+2CO2
CO2(CO) 灼热CuO CO+CuO Cu+CO2
CO(CO2) NaOH浓溶液 CO2+2NaOH = Na2CO3+H2O
CH4(CH2= CH2) 溴水 CH2=CH2+Br2 → CH2BrCH2Br
1. 常见离子的检验
知识点二 常见离子和气体的检验
离子 试剂 现象 原理或注意
沉 淀 法 Cl-、 Br-、 I- 稀硝酸和AgNO3溶液 AgCl白色沉淀、AgBr淡黄色沉淀、AgI黄色沉淀 Ag++Cl- = AgCl↓;
Ag++Br- = AgBr↓;
Ag++I- = AgI↓
稀盐酸和BaCl2溶液 白色沉淀
Fe2+ NaOH溶液 白色沉淀→灰绿色→红褐色沉淀 Fe2++2OH- = Fe(OH)2↓,
4Fe(OH)2+O2+2H2O = 4Fe(OH)3
Fe3+ NaOH溶液 红褐色沉淀 Fe3++3OH- Fe(OH)3↓
离子 试剂 现象 原理或注意
气 体 法 浓NaOH溶液和湿润的红色石蕊试纸 产生刺激性气味的气体,使试纸变蓝
稀盐酸和BaCl2溶液 生成无色无味的气体,使澄清石灰水变浑浊
稀H2SO4和品红溶液 品红溶液褪色
离子 试剂 现象 原理或注意
显 色 法 I- 氯水(适量), CCl4 下层为紫红色 加入氯水,溶液变为黄褐色,加入四氯化碳,液体分层,上层几乎无色,下层为紫红色:Cl2+2I- = 2Cl-+I2
氯水(适量), 淀粉溶液 溶液变蓝 加入氯水,溶液变为黄褐色,加入淀粉溶液,溶液变为蓝色
Br- 氯水(适量), CCl4 下层为橙红色 加入氯水,溶液变为橙黄色,加入四氯化碳,液体分层,上层几乎无色,下层为橙红色:Cl2+2Br- = 2Cl-+Br2
离子 试剂 现象 原理或注意
显 色 法 Fe2+ KSCN溶液,氯水 先是无变化,滴加氯水后变为红色 2Fe2++Cl2 = 2Fe3++2Cl-,
Fe3++3SCN- Fe(SCN)3
Fe3+ KSCN溶液 红色 Fe3++3SCN- Fe(SCN)3
Na+、 K+ 铂丝、稀盐酸、酒精灯 焰色分别为黄色、紫色 K+需要透过蓝色钴玻璃片观察
2. 常见气体的检验
常见气体 检验方法
H2 纯净的氢气在空气中燃烧呈淡蓝色火焰,生成物只有水;收集到不纯的氢气点燃有爆鸣声
O2 可使带火星的木条复燃
Cl2 黄绿色,能使湿润的碘化钾淀粉试纸变蓝
SO2 无色有刺激性气味的气体。能使品红溶液褪色,加热后又显红色;能使酸性高锰酸钾溶液褪色(常用于除去二氧化硫)
NH3 无色有刺激性气味的气体。能使湿润的红色石蕊试纸(或湿润的pH试纸)变蓝
CO2 无色无味的气体。能使澄清石灰水变浑浊(要避免二氧化硫的干扰)
例1 [2020·浙江7月学考] 粗盐中含有Ca2+、S等可溶性杂质和泥沙等不溶性杂质。实验室用下述方案模拟粗盐的精制:
粗盐 滤液 滤液 精制盐
下列说法正确的是( )
A.过滤操作中必须用到的玻璃仪器有烧杯、玻璃棒和分液漏斗
B.试剂1可选用BaCl2溶液,试剂2可选用Na2CO3溶液
C.调pH时,可选用盐酸或者硫酸
D.结晶时,应先加热蒸发形成较高温度下的饱和溶液,然后冷却到室温
B
考查点1 物质的分离与提纯
变式 某化学实验室产生的废液中含有Fe3+、Cu2+、Ag+三种金属离子,甲同学设计了如图所示的方案对废液进行处理,以回收金属,保护环境。据此分析,下列说法正确的是( )
A.沉淀A中含有2种金属单质
B.可用KSCN溶液检验溶液B
中所含的金属离子
C.溶液A若只经过操作③最终将无法得到沉淀C
D.操作①②③中都需要用到玻璃棒、漏斗
B
例2 [2021 浙江7月学考]根据实验操作和现象得出的结论不正确的是( )
D
考查点2 常见离子(气体)的检验
选项 实验操作和现象 结论
A 将淀粉和稀硫酸混合加热,冷却后加入NaOH溶液至碱性,再加入少量新制的Cu(OH)2,加热,有砖红色沉淀产生 淀粉已发生水解
B 向碳酸钠粉末中加少量水,碳酸钠结块变成晶体,温度升高 该过程放热
C 用铂丝蘸取X溶液进行焰色试验,透过蓝色钴玻璃观察,火焰呈紫色 X溶液中含有K+
D 用湿润的淀粉碘化钾试纸检验气体Y,试纸变蓝色 Y是Cl2
变式 [2021 浙江1月学考] 下列实验操作、现象和结论都正确的是( )
D
实验操作 现象 结论
A 向某溶液中加入稀HNO3酸化,再加入BaCl2溶液 产生白色沉淀
B 向试管中加入2 mL苯,再加入1 mL溴水,振荡、静置 分层,下层液体呈无色 苯与溴发生加成反应
C 向2 mL蛋白质溶液中加入适量的饱和硫酸铵溶液 产生沉淀 蛋白质发生变性
D 向5 mL KI溶液中加入1 mL相同浓度FeCl3溶液,充分反应后滴入KSCN溶液 溶液变红色 KI与FeCl3的反应有一定限度
组织建设
化学 · 学考
第23讲 物质的分离、提纯与检验
1. 物质分离、提纯的区别
(1)物质的分离:将混合物中的各组分彼此分开得到相应纯净物的过程。
(2)物质的提纯:将混合物中的杂质除去的过程,也叫除杂。
知识点一 物质的分离与提纯
2. 物质分离、提纯的常用方法
方法 适用范围 装置示意图 举例
过滤 固体与液体分离 粗盐提纯时,将粗盐溶于水,经过过滤,将不溶于水的固体杂质除去
结晶、 重结晶 混合物中各组分在溶剂中的溶解度随温度变化相差很大 — 硝酸钾的溶解度随温度变化大,氯化钠的溶解度随温度变化小,可用该方法从氯化钠和硝酸钾的混合物中提纯硝酸钾,溶解、蒸发浓缩、冷却结晶、过滤
方法 适用范围 装置示意图 举例
升华 固体混合物中某一成分在一定温度下可直接变为气体,再冷却成固体 碘与氯化钠的固体混合物,利用碘易升华的特性,可将碘与氯化钠分离
蒸发 分离溶于溶剂中的溶质 从食盐水溶液中提取食盐晶体
2. 常见气体的提纯(除杂)
(内为杂质) 除杂试剂 化学方程式或原理
Cl2(HCl) 饱和NaCl溶液 HCl极易溶于水,Cl2在饱和NaCl溶液中的溶解度小
CO2(HCl) 饱和NaHCO3溶液 HCl+NaHCO3 = NaCl+H2O+CO2↑
CO2(SO2) 饱和NaHCO3溶液 SO2+2NaHCO3 = Na2SO3+H2O+2CO2
CO2(CO) 灼热CuO CO+CuO Cu+CO2
CO(CO2) NaOH浓溶液 CO2+2NaOH = Na2CO3+H2O
CH4(CH2= CH2) 溴水 CH2=CH2+Br2 → CH2BrCH2Br
1. 常见离子的检验
知识点二 常见离子和气体的检验
离子 试剂 现象 原理或注意
沉 淀 法 Cl-、 Br-、 I- 稀硝酸和AgNO3溶液 AgCl白色沉淀、AgBr淡黄色沉淀、AgI黄色沉淀 Ag++Cl- = AgCl↓;
Ag++Br- = AgBr↓;
Ag++I- = AgI↓
稀盐酸和BaCl2溶液 白色沉淀
Fe2+ NaOH溶液 白色沉淀→灰绿色→红褐色沉淀 Fe2++2OH- = Fe(OH)2↓,
4Fe(OH)2+O2+2H2O = 4Fe(OH)3
Fe3+ NaOH溶液 红褐色沉淀 Fe3++3OH- Fe(OH)3↓
离子 试剂 现象 原理或注意
气 体 法 浓NaOH溶液和湿润的红色石蕊试纸 产生刺激性气味的气体,使试纸变蓝
稀盐酸和BaCl2溶液 生成无色无味的气体,使澄清石灰水变浑浊
稀H2SO4和品红溶液 品红溶液褪色
离子 试剂 现象 原理或注意
显 色 法 I- 氯水(适量), CCl4 下层为紫红色 加入氯水,溶液变为黄褐色,加入四氯化碳,液体分层,上层几乎无色,下层为紫红色:Cl2+2I- = 2Cl-+I2
氯水(适量), 淀粉溶液 溶液变蓝 加入氯水,溶液变为黄褐色,加入淀粉溶液,溶液变为蓝色
Br- 氯水(适量), CCl4 下层为橙红色 加入氯水,溶液变为橙黄色,加入四氯化碳,液体分层,上层几乎无色,下层为橙红色:Cl2+2Br- = 2Cl-+Br2
离子 试剂 现象 原理或注意
显 色 法 Fe2+ KSCN溶液,氯水 先是无变化,滴加氯水后变为红色 2Fe2++Cl2 = 2Fe3++2Cl-,
Fe3++3SCN- Fe(SCN)3
Fe3+ KSCN溶液 红色 Fe3++3SCN- Fe(SCN)3
Na+、 K+ 铂丝、稀盐酸、酒精灯 焰色分别为黄色、紫色 K+需要透过蓝色钴玻璃片观察
2. 常见气体的检验
常见气体 检验方法
H2 纯净的氢气在空气中燃烧呈淡蓝色火焰,生成物只有水;收集到不纯的氢气点燃有爆鸣声
O2 可使带火星的木条复燃
Cl2 黄绿色,能使湿润的碘化钾淀粉试纸变蓝
SO2 无色有刺激性气味的气体。能使品红溶液褪色,加热后又显红色;能使酸性高锰酸钾溶液褪色(常用于除去二氧化硫)
NH3 无色有刺激性气味的气体。能使湿润的红色石蕊试纸(或湿润的pH试纸)变蓝
CO2 无色无味的气体。能使澄清石灰水变浑浊(要避免二氧化硫的干扰)
例1 [2020·浙江7月学考] 粗盐中含有Ca2+、S等可溶性杂质和泥沙等不溶性杂质。实验室用下述方案模拟粗盐的精制:
粗盐 滤液 滤液 精制盐
下列说法正确的是( )
A.过滤操作中必须用到的玻璃仪器有烧杯、玻璃棒和分液漏斗
B.试剂1可选用BaCl2溶液,试剂2可选用Na2CO3溶液
C.调pH时,可选用盐酸或者硫酸
D.结晶时,应先加热蒸发形成较高温度下的饱和溶液,然后冷却到室温
B
考查点1 物质的分离与提纯
变式 某化学实验室产生的废液中含有Fe3+、Cu2+、Ag+三种金属离子,甲同学设计了如图所示的方案对废液进行处理,以回收金属,保护环境。据此分析,下列说法正确的是( )
A.沉淀A中含有2种金属单质
B.可用KSCN溶液检验溶液B
中所含的金属离子
C.溶液A若只经过操作③最终将无法得到沉淀C
D.操作①②③中都需要用到玻璃棒、漏斗
B
例2 [2021 浙江7月学考]根据实验操作和现象得出的结论不正确的是( )
D
考查点2 常见离子(气体)的检验
选项 实验操作和现象 结论
A 将淀粉和稀硫酸混合加热,冷却后加入NaOH溶液至碱性,再加入少量新制的Cu(OH)2,加热,有砖红色沉淀产生 淀粉已发生水解
B 向碳酸钠粉末中加少量水,碳酸钠结块变成晶体,温度升高 该过程放热
C 用铂丝蘸取X溶液进行焰色试验,透过蓝色钴玻璃观察,火焰呈紫色 X溶液中含有K+
D 用湿润的淀粉碘化钾试纸检验气体Y,试纸变蓝色 Y是Cl2
变式 [2021 浙江1月学考] 下列实验操作、现象和结论都正确的是( )
D
实验操作 现象 结论
A 向某溶液中加入稀HNO3酸化,再加入BaCl2溶液 产生白色沉淀
B 向试管中加入2 mL苯,再加入1 mL溴水,振荡、静置 分层,下层液体呈无色 苯与溴发生加成反应
C 向2 mL蛋白质溶液中加入适量的饱和硫酸铵溶液 产生沉淀 蛋白质发生变性
D 向5 mL KI溶液中加入1 mL相同浓度FeCl3溶液,充分反应后滴入KSCN溶液 溶液变红色 KI与FeCl3的反应有一定限度
同课章节目录
