5.3.1同素异形现象和同分异构现象课件2022-2023学年高一上学期化学苏教版(2019)必修第一册(19张ppt)
文档属性
| 名称 | 5.3.1同素异形现象和同分异构现象课件2022-2023学年高一上学期化学苏教版(2019)必修第一册(19张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 5.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-28 15:45:48 | ||
图片预览





文档简介
(共19张PPT)
5.3.1同素异形现象和同分异构现象
学习目标
1.通过同分异构现象和同素异形现象,认识物质的多样性与微观结构的关系。
2.证据推理与模型认知:理解同素异形体、同分异构体的区别与联系
课前导入
回忆一下同素异形体的概念是什么?
碳元素有几种同素异形体?
碳元素形成的几种单质
金刚石
石墨
纳米碳管
同一种元素形成几种不同单质的现象
1、同素异形现象:
2、同素异形体:
同一元素可形成的几种性质不同的单质
思考探究
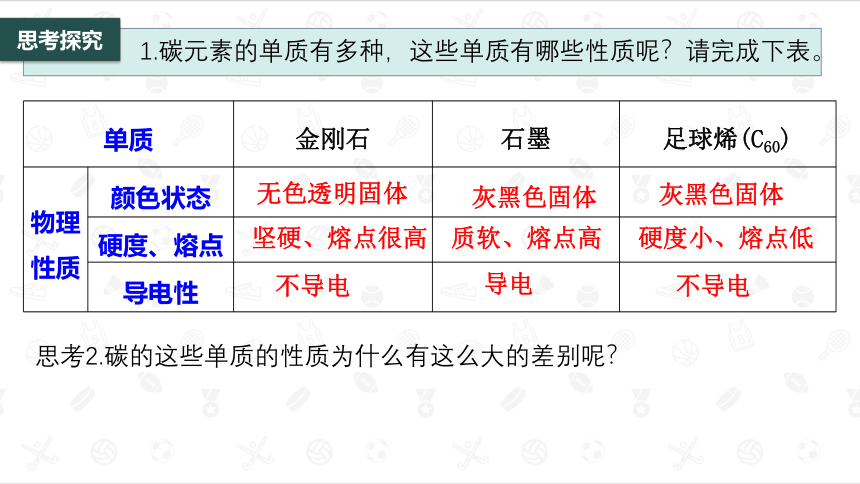
1.碳元素的单质有多种,这些单质有哪些性质呢?请完成下表。
单质 金刚石 石墨 足球烯(C60)
物理性质 颜色状态
硬度、熔点
导电性
无色透明固体
灰黑色固体
灰黑色固体
坚硬、熔点很高
质软、熔点高
硬度小、熔点低
不导电
导电
不导电
思考2.碳的这些单质的性质为什么有这么大的差别呢?
碳纳米管
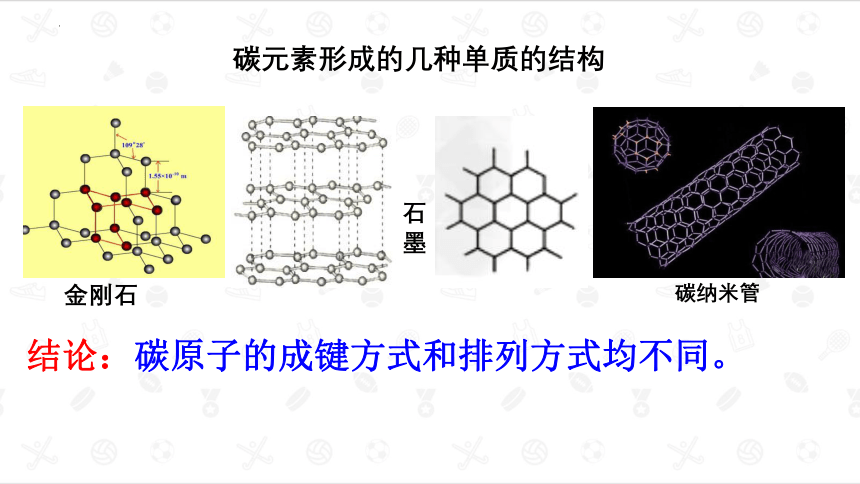
碳元素形成的几种单质的结构
金刚石
石墨
结论:碳原子的成键方式和排列方式均不同。
单质 氧气(O2) 臭氧(O3)
物理性质
化学性质
转化
差异分析
氧元素形成的两种单质
无色无味气体
有鱼腥味,淡蓝色气体
有强氧化性
氧化性比氧气更强
O2在放电时转化成O3,O3在催化剂存在时又可分解为O2
分子中氧原子个数和氧原子的成键方式不同
单质 白磷 红磷
性质 蜡状固体,有剧毒。白磷在空气中能自燃,应保存在冷水中 红棕色固体,在空气中能稳定存在,在加热或点燃时也能在空气中燃烧
结构 白磷分子和红磷分子中磷原子的个数和磷原子的成键方式不同
磷元素形成的两种单质
(1)组成元素:
(2)物质类别:
(3)性质关系:
(4)相互转化:
对同素异形体的理解
只含有一种元素。
互为同素异形体的只能是单质。
同素异形体之间的物理性质有差异,但化学性质相似。
这是因为不同单质中,原子排列情况不同的缘故
同素异形体之间的转化属于化学变化。
(5)同素异形体之间的转化,一般认为这种转化属于非氧化还原反应。
思考探究
同种元素可以形成不同的单质。分子式相同的物质,是否也会表现出结构和性质上的差异?
物质 正丁烷 异丁烷
分子式 C4H10 C4H10
沸点 -0.5℃ -11.7℃
结构式
球棍 模型
观察1:正丁烷和异丁烷
观察2:乙醇和二甲醚
物质 乙醇 二甲醚
分子式 C2H6O C2H6O
沸点 78℃ -23℃
结构式
球棍模型
3、特点:
(1)主要是在有机物之间。
(2)原子的连接方式不同,化学键类型相同,物质类别相同
(3)可以是不同类别的物质之间。
二、同分异构现象和同分异构体
化合物具有分子式相同而结构不同的现象
1、同分异构现象:
2、同分异构体:
分子式相同而结构不同的化合物互称为同分异构体
同分异构体的理解
(1)两化合物互为同分异构体的必备条件有两点:
①两者的分子式相同; ②两者的结构不同。
(2)两化合物互为同分异构体,则两化合物的相对分子质量及各元素的组成(含量)相同。
(3)从性质看:互为同分异构体的化合物,物理性质不同,化学性质可能相似。。
项目 同位素 同素异形体 同分异构体
对象 原子 单质 化合物
特点 质子数相同, 中子数不同 同种元素组成 分子式相同,
结构不同
性质 化学性质相同 化学性质相似, 物理性质不同 化学性质不一定相似,
物理性质不同
举例 H、D、T; 12C、14C O2和O3;红磷和白磷;金刚石和石墨 正丁烷和异丁烷;乙醇和二甲醚
同位素、同素异形体、同分异构体的比较
随堂练习
D
随堂练习
D
作业布置
1.预习《导与练》知识点3《晶体与非晶体》
谢谢聆听
5.3.1同素异形现象和同分异构现象
学习目标
1.通过同分异构现象和同素异形现象,认识物质的多样性与微观结构的关系。
2.证据推理与模型认知:理解同素异形体、同分异构体的区别与联系
课前导入
回忆一下同素异形体的概念是什么?
碳元素有几种同素异形体?
碳元素形成的几种单质
金刚石
石墨
纳米碳管
同一种元素形成几种不同单质的现象
1、同素异形现象:
2、同素异形体:
同一元素可形成的几种性质不同的单质
思考探究
1.碳元素的单质有多种,这些单质有哪些性质呢?请完成下表。
单质 金刚石 石墨 足球烯(C60)
物理性质 颜色状态
硬度、熔点
导电性
无色透明固体
灰黑色固体
灰黑色固体
坚硬、熔点很高
质软、熔点高
硬度小、熔点低
不导电
导电
不导电
思考2.碳的这些单质的性质为什么有这么大的差别呢?
碳纳米管
碳元素形成的几种单质的结构
金刚石
石墨
结论:碳原子的成键方式和排列方式均不同。
单质 氧气(O2) 臭氧(O3)
物理性质
化学性质
转化
差异分析
氧元素形成的两种单质
无色无味气体
有鱼腥味,淡蓝色气体
有强氧化性
氧化性比氧气更强
O2在放电时转化成O3,O3在催化剂存在时又可分解为O2
分子中氧原子个数和氧原子的成键方式不同
单质 白磷 红磷
性质 蜡状固体,有剧毒。白磷在空气中能自燃,应保存在冷水中 红棕色固体,在空气中能稳定存在,在加热或点燃时也能在空气中燃烧
结构 白磷分子和红磷分子中磷原子的个数和磷原子的成键方式不同
磷元素形成的两种单质
(1)组成元素:
(2)物质类别:
(3)性质关系:
(4)相互转化:
对同素异形体的理解
只含有一种元素。
互为同素异形体的只能是单质。
同素异形体之间的物理性质有差异,但化学性质相似。
这是因为不同单质中,原子排列情况不同的缘故
同素异形体之间的转化属于化学变化。
(5)同素异形体之间的转化,一般认为这种转化属于非氧化还原反应。
思考探究
同种元素可以形成不同的单质。分子式相同的物质,是否也会表现出结构和性质上的差异?
物质 正丁烷 异丁烷
分子式 C4H10 C4H10
沸点 -0.5℃ -11.7℃
结构式
球棍 模型
观察1:正丁烷和异丁烷
观察2:乙醇和二甲醚
物质 乙醇 二甲醚
分子式 C2H6O C2H6O
沸点 78℃ -23℃
结构式
球棍模型
3、特点:
(1)主要是在有机物之间。
(2)原子的连接方式不同,化学键类型相同,物质类别相同
(3)可以是不同类别的物质之间。
二、同分异构现象和同分异构体
化合物具有分子式相同而结构不同的现象
1、同分异构现象:
2、同分异构体:
分子式相同而结构不同的化合物互称为同分异构体
同分异构体的理解
(1)两化合物互为同分异构体的必备条件有两点:
①两者的分子式相同; ②两者的结构不同。
(2)两化合物互为同分异构体,则两化合物的相对分子质量及各元素的组成(含量)相同。
(3)从性质看:互为同分异构体的化合物,物理性质不同,化学性质可能相似。。
项目 同位素 同素异形体 同分异构体
对象 原子 单质 化合物
特点 质子数相同, 中子数不同 同种元素组成 分子式相同,
结构不同
性质 化学性质相同 化学性质相似, 物理性质不同 化学性质不一定相似,
物理性质不同
举例 H、D、T; 12C、14C O2和O3;红磷和白磷;金刚石和石墨 正丁烷和异丁烷;乙醇和二甲醚
同位素、同素异形体、同分异构体的比较
随堂练习
D
随堂练习
D
作业布置
1.预习《导与练》知识点3《晶体与非晶体》
谢谢聆听
