专题五第二单元第三课时分子间作用力课件2022-2023学年上学期高一化学苏教版(2019)必修第一册(18张ppt)
文档属性
| 名称 | 专题五第二单元第三课时分子间作用力课件2022-2023学年上学期高一化学苏教版(2019)必修第一册(18张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-28 15:46:56 | ||
图片预览





文档简介
(共18张PPT)
5.2.3 分子间的作用力
学习目标
1.认识分子间的作用力、氢键
2.学会区分物质发生变化时克服的作用力
3.掌握离子键、共价键、氢键之间的区别
课前导入
物质(如H2O)为什么会有三态变化?
当状态改变时化学键有没有被破坏?
不同物质为何熔、沸点不同?
一、分子间的作用力
(1)定义:
把分子聚集在一起的作用力叫做分子间作用力(也叫范德华力)。
①比化学键弱得多,是一种微弱的相互作用。
(2)对比化学键:
②分子间作用力主要影响物质的熔、沸点等物理性质,而化学键主要影响物质的化学性质。
H2O(l) H2O(g)
能量
在100℃、101 kPa时,将1 mol H2O(l)变成1 mol H2O(g)需吸收能量47.3 kJ。
1mol H2O
H + H
O
断裂2mol H-O键,需要436KJ能量将水分子分解为氢气和氧气需1000℃以上的高温
思考探究
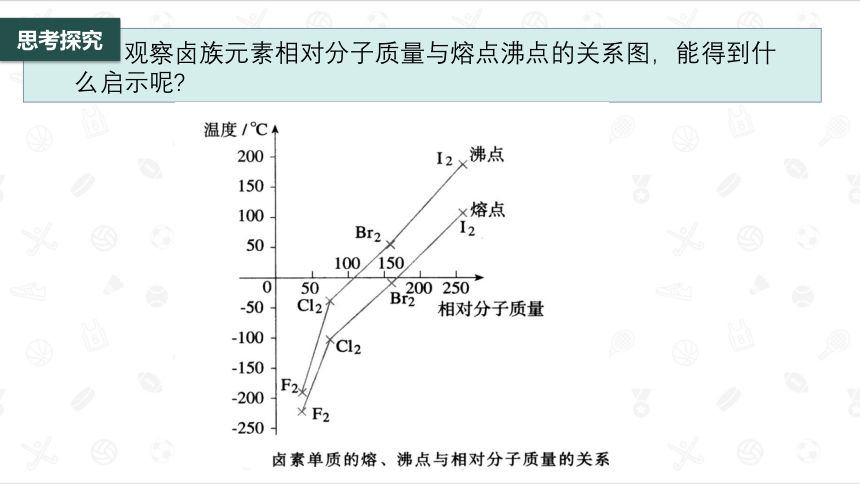
观察卤族元素相对分子质量与熔点沸点的关系图,能得到什么启示呢
1.分子间作用力
(3)影响因素:
一般来说,组成和结构相似的物质,相对分子质量越大,分子间作用力越大,熔沸点越高。
如熔沸点:①CF4分子间作用力主要存在于由分子构成的物质中。
如:多数非金属单质、稀有气体、非金属氧化物、酸、氢化物、有机物等。
(4)存在:
交流讨论
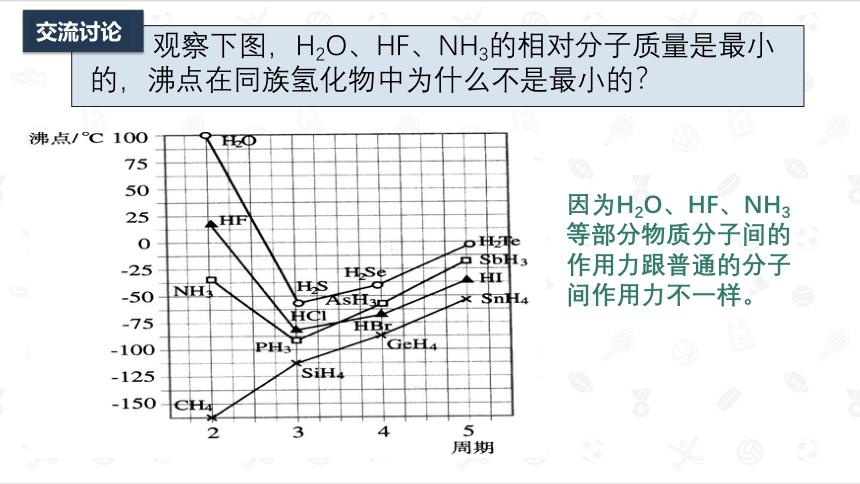
观察下图,H2O、HF、NH3的相对分子质量是最小的,沸点在同族氢化物中为什么不是最小的?
因为H2O、HF、NH3等部分物质分子间的作用力跟普通的分子间作用力不一样。
2.氢键
(1)形成:
一般来说,吸引电子能力强的原子(N、O、F)
和H原子间可形成氢键。
如H―F
氢键不是化学键
①氢键比化学键弱,但比分子间作用力稍强。可以把氢键看作是一种较强的分子间作用力。
(2)对比分子间作用力:
②分子间形成的氢键会使物质的熔点和沸点升高。
③氢键还会影响部分物质的溶解性,如氨气溶于水。
思考探究
“水受热不易分解,性质很稳定,这是由于水中存在氢键。”这种说法是否正确 为什么?
不正确,氢键属于分子间作用力,存在于分子之间,会影响熔点、沸点、密度等物理性质,不会影响化学性质。
课堂小结
原子
分子
离子
宏观
物质
或范德华力
得失电子
范德华力
氢键
共价键
金属键或共价键
离子键
1.干冰升华时,下列所述内容发生变化的是( )
A.分子内共价键 B.分子间作用力
C.分子质量 D.分子内原子间距离
B
随堂练习
4.化学键的破坏
(1)离子化合物的溶解或熔化
离子化合物溶于水或熔化后均电离成为可自由移动的阴、阳离子,所以离子键被破坏。
(2)共价化合物的溶解或熔化
①溶解过程
a.与水反应——共价键被破坏
如:CO2、SO2等酸性氧化物(酸酐)
b.电解质溶于水——共价键被破坏
如:HCl、H2SO4、HNO3等强酸
c.非电解质溶于水——分子扩散,分子本身不变,分子内的共价键不被破坏 如:乙醇、蔗糖等
(2)共价化合物的溶解或熔化
②熔化过程
a.由分子构成的共价化合物(分子晶体)——共价键不被破坏,
如:冰、干冰、蔗糖等多数共价化合物
b.由原子构成的共价化合物(原子晶体)——共价键被破坏
如:SiO2晶体等少数共价化合物
2.下列物质发生变化时,所克服的粒子相互作用属于同种类型的是( )
A.液溴和苯分别受热变为气体
B.干冰和氯化铵分别受热变为气体
C.食盐熔化和冰的融化
D.食盐和葡萄糖分别溶解在水中
A
随堂练习
3.下列物质的变化过程中,有共价键明显被破坏的是( )
A.从料酒中闻到了醇的香味
B.NaCl颗粒被粉碎
C.H2SO4溶于水得硫酸溶液
D.NaOH受热熔化
C
随堂练习
随堂练习
1、2、4
4.以下是同学们熟悉的物质:
①O2 ②金刚石 ③NaBr ④H2SO4 ⑤Na2CO3
⑥NH4Cl ⑦NaHSO4 ⑧Ne ⑨Na2O2 ⑩NaOH
(1)这些物质中,只含有共价键的是 (填序号,下同);只含有离子键的是 ;既含有共价键又含有离子键的是 ;不存在化学键的是 。
(2)属于共价化合物的是 ;属于离子化合物的是 。
(3)将NaHSO4溶于水,破坏了NaHSO4中的 ,写出其电离方程式: 。
3
5、6、7、9、10
8
4
3、5、6、7、9、10
离子键和共价键
作业布置
1.预习《导与练》第3单元《从微观结构看物质的多样性》
2.背默常见物质的电子式
谢谢聆听
5.2.3 分子间的作用力
学习目标
1.认识分子间的作用力、氢键
2.学会区分物质发生变化时克服的作用力
3.掌握离子键、共价键、氢键之间的区别
课前导入
物质(如H2O)为什么会有三态变化?
当状态改变时化学键有没有被破坏?
不同物质为何熔、沸点不同?
一、分子间的作用力
(1)定义:
把分子聚集在一起的作用力叫做分子间作用力(也叫范德华力)。
①比化学键弱得多,是一种微弱的相互作用。
(2)对比化学键:
②分子间作用力主要影响物质的熔、沸点等物理性质,而化学键主要影响物质的化学性质。
H2O(l) H2O(g)
能量
在100℃、101 kPa时,将1 mol H2O(l)变成1 mol H2O(g)需吸收能量47.3 kJ。
1mol H2O
H + H
O
断裂2mol H-O键,需要436KJ能量将水分子分解为氢气和氧气需1000℃以上的高温
思考探究
观察卤族元素相对分子质量与熔点沸点的关系图,能得到什么启示呢
1.分子间作用力
(3)影响因素:
一般来说,组成和结构相似的物质,相对分子质量越大,分子间作用力越大,熔沸点越高。
如熔沸点:①CF4
如:多数非金属单质、稀有气体、非金属氧化物、酸、氢化物、有机物等。
(4)存在:
交流讨论
观察下图,H2O、HF、NH3的相对分子质量是最小的,沸点在同族氢化物中为什么不是最小的?
因为H2O、HF、NH3等部分物质分子间的作用力跟普通的分子间作用力不一样。
2.氢键
(1)形成:
一般来说,吸引电子能力强的原子(N、O、F)
和H原子间可形成氢键。
如H―F
氢键不是化学键
①氢键比化学键弱,但比分子间作用力稍强。可以把氢键看作是一种较强的分子间作用力。
(2)对比分子间作用力:
②分子间形成的氢键会使物质的熔点和沸点升高。
③氢键还会影响部分物质的溶解性,如氨气溶于水。
思考探究
“水受热不易分解,性质很稳定,这是由于水中存在氢键。”这种说法是否正确 为什么?
不正确,氢键属于分子间作用力,存在于分子之间,会影响熔点、沸点、密度等物理性质,不会影响化学性质。
课堂小结
原子
分子
离子
宏观
物质
或范德华力
得失电子
范德华力
氢键
共价键
金属键或共价键
离子键
1.干冰升华时,下列所述内容发生变化的是( )
A.分子内共价键 B.分子间作用力
C.分子质量 D.分子内原子间距离
B
随堂练习
4.化学键的破坏
(1)离子化合物的溶解或熔化
离子化合物溶于水或熔化后均电离成为可自由移动的阴、阳离子,所以离子键被破坏。
(2)共价化合物的溶解或熔化
①溶解过程
a.与水反应——共价键被破坏
如:CO2、SO2等酸性氧化物(酸酐)
b.电解质溶于水——共价键被破坏
如:HCl、H2SO4、HNO3等强酸
c.非电解质溶于水——分子扩散,分子本身不变,分子内的共价键不被破坏 如:乙醇、蔗糖等
(2)共价化合物的溶解或熔化
②熔化过程
a.由分子构成的共价化合物(分子晶体)——共价键不被破坏,
如:冰、干冰、蔗糖等多数共价化合物
b.由原子构成的共价化合物(原子晶体)——共价键被破坏
如:SiO2晶体等少数共价化合物
2.下列物质发生变化时,所克服的粒子相互作用属于同种类型的是( )
A.液溴和苯分别受热变为气体
B.干冰和氯化铵分别受热变为气体
C.食盐熔化和冰的融化
D.食盐和葡萄糖分别溶解在水中
A
随堂练习
3.下列物质的变化过程中,有共价键明显被破坏的是( )
A.从料酒中闻到了醇的香味
B.NaCl颗粒被粉碎
C.H2SO4溶于水得硫酸溶液
D.NaOH受热熔化
C
随堂练习
随堂练习
1、2、4
4.以下是同学们熟悉的物质:
①O2 ②金刚石 ③NaBr ④H2SO4 ⑤Na2CO3
⑥NH4Cl ⑦NaHSO4 ⑧Ne ⑨Na2O2 ⑩NaOH
(1)这些物质中,只含有共价键的是 (填序号,下同);只含有离子键的是 ;既含有共价键又含有离子键的是 ;不存在化学键的是 。
(2)属于共价化合物的是 ;属于离子化合物的是 。
(3)将NaHSO4溶于水,破坏了NaHSO4中的 ,写出其电离方程式: 。
3
5、6、7、9、10
8
4
3、5、6、7、9、10
离子键和共价键
作业布置
1.预习《导与练》第3单元《从微观结构看物质的多样性》
2.背默常见物质的电子式
谢谢聆听
