化学人教版(2019)必修第一册1.3.3氧化剂与还原剂(共17张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.3.3氧化剂与还原剂(共17张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 182.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-29 07:47:54 | ||
图片预览




文档简介
(共17张PPT)
第三节 氧化还原反应
第3课时 氧化剂与还原剂
知识回顾
在Fe2O3+2Al == Al2O3+2Fe的反应中,____________元素的化合价升高,则该元素的原子________电子,被_________;而________元素的化合价降低,则该元素的原子__________电子,被________;该反 应中Fe2O3发生了__________反应.Al发生了________反应.
高温
0
0
+3
+3
-2
-2
Al
得到
氧化
Fe
失去
还原
还原
氧化
1、氧化剂与还原剂
Fe2O3+2Al == Al2O3+2Fe反应中,Fe得到电子,化合价降低,所以Fe2O3是氧化剂,发生了还原反应;而Al失去电子,化合价升高,所以Al是还原剂,发生了氧化反应。
高温
氧化剂:在氧化还原反应中,得到电子(或电子对偏向)的物质, 在反应时所含元素的化合价降低的反应物。
还原剂:在氧化还原反应中,失去电子(或电子对偏离)的物质, 在反应时所含元素的化合价升高的反应物。
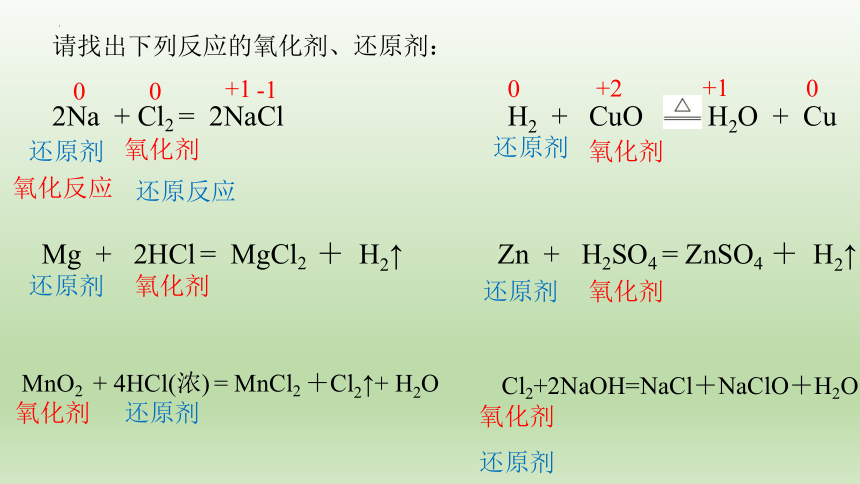
请找出下列反应的氧化剂、还原剂:
2Na + Cl2 = 2NaCl
H2 + CuO H2O + Cu
Mg + 2HCl = MgCl2 + H2↑
Zn + H2SO4 = ZnSO4 + H2↑
MnO2 + 4HCl(浓) = MnCl2 +Cl2↑+ H2O
Cl2+2NaOH=NaCl+NaClO+H2O
0
0
+1
-1
0
+2
+1
0
还原剂
氧化剂
氧化剂
还原剂
氧化剂
还原剂
氧化剂
还原剂
氧化剂
还原剂
氧化剂
还原剂
氧化反应
还原反应
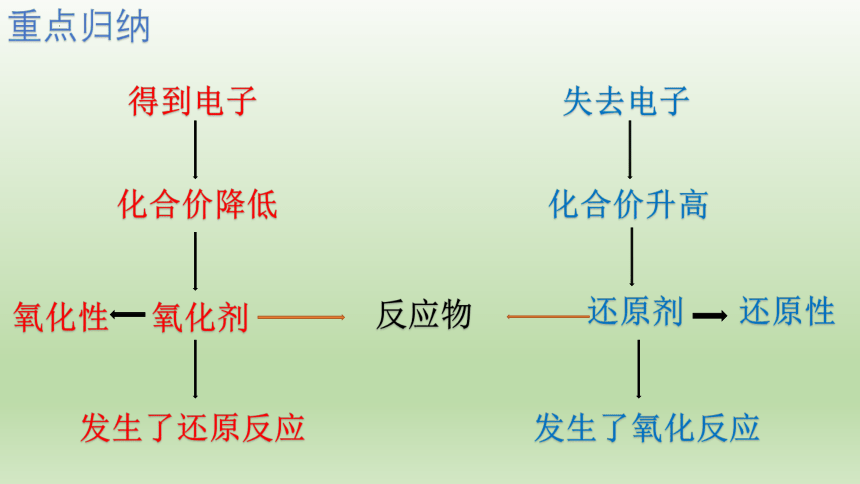
重点归纳
化合价降低
氧化剂
发生了还原反应
化合价升高
还原剂
发生了氧化反应
得到电子
失去电子
反应物
氧化性
还原性
2、氧化产物、还原产物
Fe2O3+2Al == Al2O3+2Fe反应中,Al发生了氧化反应,所以Al2O3是氧化产物, Fe2O3发生了还原反应,所以Fe是氧化产物;
高温
氧化产物:反应物中发生氧化反应的某些元素所对应的生成物。
还原剂:反应物中发生还原反应的某些元素所对应的生成物。
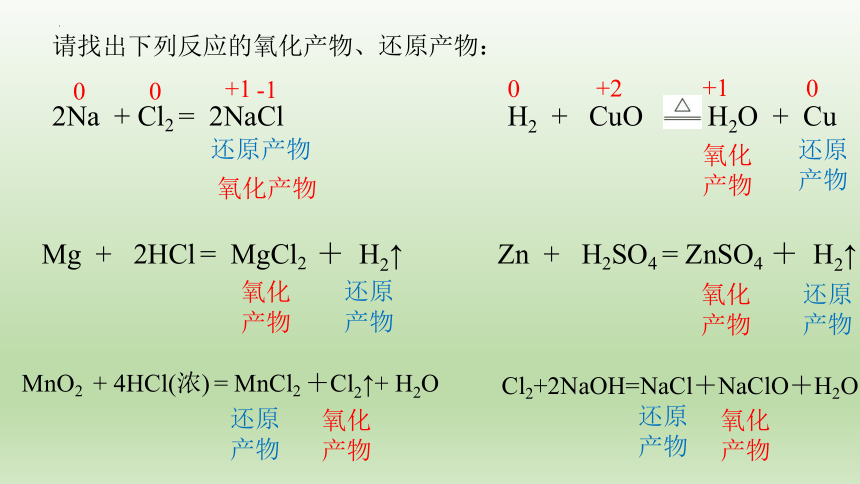
请找出下列反应的氧化产物、还原产物:
2Na + Cl2 = 2NaCl
H2 + CuO H2O + Cu
Mg + 2HCl = MgCl2 + H2↑
Zn + H2SO4 = ZnSO4 + H2↑
MnO2 + 4HCl(浓) = MnCl2 +Cl2↑+ H2O
Cl2+2NaOH=NaCl+NaClO+H2O
0
0
+1
-1
0
+2
+1
0
还原产物
氧化产物
氧化产物
还原产物
氧化产物
还原产物
氧化产物
还原产物
氧化产物
还原产物
氧化产物
还原产物
重点归纳
氧化剂
发生了还原反应
得到氧化产物
还原剂
发生了氧化反应
产物
得到还原产物
1.在氧化还原反应中,水作为氧化剂的是( )
A.C+H2O CO+H2 B.3NO2+H2O=2HNO3+NO
C.2Na2O2+2H2O=4NaOH+O2↑ D.2F2+2H2O=4HF+O2
A
2.盐酸能发生下列反应:①Zn+2HCl═ZnCl2+H2↑②2HCl+CuO═CuCl2+H2O ③MnO2+4HCl═MnCl2+Cl2↑+2H2O,因此盐酸具有的性质是( )
A.只有酸性 B.只有氧化性
C.只有还原性 D.以上三种均具有
D
3.氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既不是氧化剂也不是还原剂等。下列反应与C+H2O(g)CO+H2相比较,水的作用相同的是( )
A. 3Fe+4H2O(g) FeO4+4H2 B.Na2O+H2O= 2NaOH
C.2F2+2H2O =4HF+O2 D.3NO2+H2O =2HNO3+NO
A
4.下列变化过程属于氧化反应的是( )
A.HCl→H2 B.Mg→Mg2+
C.Cl-→AgCl D.CuO→Cu
B
3、常见的氧化剂与还原剂
(1)常见的氧化剂
活泼的非金属单质:O2、Cl2、Br2
含高价金属阳离子的化合物:FeCl3 (Fe3+ )、 CuCl2 (Cu2+ )
含某些较高化合价元素的化合物:浓H2SO4 、HNO3、KMnO4( MnO4-)、MnO2
(2)常见的还原剂
活泼或或较活泼的金属:K、Ca、Na、Al、Mg、Zn (按金 属活动性顺序,还原性递减)
含低价金属阳离子的化合物:Fe2+
某些非金属单质:C、H2
含有较低化合价元素的化合物:HCl 、H2S、HI、KI
注意:元素在最高价时只有氧化性,最低价时只有还原性。
1.下列粒子中,只有氧化性的是( )
①S2- ②Fe2+ ③Fe3+ ④S ⑤H+ ⑥Na+ ⑦Mg
A.①⑦ B.②④ C.③⑤⑥ D. ②④⑤⑥
C
2.下列物质中,按只有氧化性,只有还原性,既有氧化性又有还原性的顺序排列的一组是( )
A.Na+、K、HCl B.Cl2、Al、H2
C.NO2、Na、Al3+ D.O2、SO2、H2O
A
3.下列变化中,加入还原剂才能实现的是( )
A.Na2O→NaOH B.H2SO4→H2
C.CuO→CuSO4 D.SO2→SO3
B
4.吸入人体内的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体内的活性氧,由此推断Na2SeO3的作用是( )
A.作还原剂 B.作氧化剂
C.既作氧化剂又作还原剂 D.既不作氧化剂又不作还原剂
A
5.在下列变化中,需要加入合适的氧化剂才能实现的是( )
A.HCl→H2 B.CO2→CO
C.Fe2O3→Fe D.Br-→Br2
D
4、氧化性与还原性强弱比较
(1)氧化性
氧化剂
>
氧化产物
(2)还原性
还原剂
>
还原产物
例:Mg + 2HCl = MgCl2 + H2↑, HCl是氧化剂, MgCl2是氧化产物, Mg是还原剂, H2是还原产物
氧化性: HCl > MgCl2
还原性: Mg > H2
注意:反应遵循强制弱
1.已知在某温度时发生如下三个反应:
①C+CO2=2CO;②C+H2O(g) =CO+H2 ;③CO+H2O CO2+H2,由此可判断,在该温度下,C、CO、H2的还原性的顺序是( )
A.CO>C>H2 B.CO>H2>C C.C>H2>CO D.C>CO>H2
D
2.已知:①2FeCl3+2KI===2FeCl2+2KCl+I2;②2FeCl2+Cl2===2FeCl3.下列粒子的氧化性从强到弱的顺序正确的是( )
A.Cl2>Fe3+>I2 B.I2>Cl2>Fe3+
C.Fe3+>Cl2>I2 D.Cl2>I2>Fe3+
A
3.已知在相同条件下,下列几种微粒的还原性强弱顺序为SO2>I->Fe2+>Br->Cl-。由此判断下列反应不能发生的是( )
A.2Fe3++SO2+2H2O =SO42-+4H++2Fe2+ B.2Br-+SO42-+4H+ =SO2↑+Br2+2H2O
C.2Fe2++2Br-+2Cl2 =2Fe3++Br2+4Cl- D.2Fe3++2I- = 2Fe2++I2
B
4.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应的化学方程式不正确的是( )
A.3Cl2+6FeI2=2FeCl3+4FeI3 B.Cl2+FeI2=FeCl2+I2
C.Co2O3+6HCl=2CoCl2+Cl2↑+3H2O D.2Fe3++2I-=2Fe2++I2
A
第三节 氧化还原反应
第3课时 氧化剂与还原剂
知识回顾
在Fe2O3+2Al == Al2O3+2Fe的反应中,____________元素的化合价升高,则该元素的原子________电子,被_________;而________元素的化合价降低,则该元素的原子__________电子,被________;该反 应中Fe2O3发生了__________反应.Al发生了________反应.
高温
0
0
+3
+3
-2
-2
Al
得到
氧化
Fe
失去
还原
还原
氧化
1、氧化剂与还原剂
Fe2O3+2Al == Al2O3+2Fe反应中,Fe得到电子,化合价降低,所以Fe2O3是氧化剂,发生了还原反应;而Al失去电子,化合价升高,所以Al是还原剂,发生了氧化反应。
高温
氧化剂:在氧化还原反应中,得到电子(或电子对偏向)的物质, 在反应时所含元素的化合价降低的反应物。
还原剂:在氧化还原反应中,失去电子(或电子对偏离)的物质, 在反应时所含元素的化合价升高的反应物。
请找出下列反应的氧化剂、还原剂:
2Na + Cl2 = 2NaCl
H2 + CuO H2O + Cu
Mg + 2HCl = MgCl2 + H2↑
Zn + H2SO4 = ZnSO4 + H2↑
MnO2 + 4HCl(浓) = MnCl2 +Cl2↑+ H2O
Cl2+2NaOH=NaCl+NaClO+H2O
0
0
+1
-1
0
+2
+1
0
还原剂
氧化剂
氧化剂
还原剂
氧化剂
还原剂
氧化剂
还原剂
氧化剂
还原剂
氧化剂
还原剂
氧化反应
还原反应
重点归纳
化合价降低
氧化剂
发生了还原反应
化合价升高
还原剂
发生了氧化反应
得到电子
失去电子
反应物
氧化性
还原性
2、氧化产物、还原产物
Fe2O3+2Al == Al2O3+2Fe反应中,Al发生了氧化反应,所以Al2O3是氧化产物, Fe2O3发生了还原反应,所以Fe是氧化产物;
高温
氧化产物:反应物中发生氧化反应的某些元素所对应的生成物。
还原剂:反应物中发生还原反应的某些元素所对应的生成物。
请找出下列反应的氧化产物、还原产物:
2Na + Cl2 = 2NaCl
H2 + CuO H2O + Cu
Mg + 2HCl = MgCl2 + H2↑
Zn + H2SO4 = ZnSO4 + H2↑
MnO2 + 4HCl(浓) = MnCl2 +Cl2↑+ H2O
Cl2+2NaOH=NaCl+NaClO+H2O
0
0
+1
-1
0
+2
+1
0
还原产物
氧化产物
氧化产物
还原产物
氧化产物
还原产物
氧化产物
还原产物
氧化产物
还原产物
氧化产物
还原产物
重点归纳
氧化剂
发生了还原反应
得到氧化产物
还原剂
发生了氧化反应
产物
得到还原产物
1.在氧化还原反应中,水作为氧化剂的是( )
A.C+H2O CO+H2 B.3NO2+H2O=2HNO3+NO
C.2Na2O2+2H2O=4NaOH+O2↑ D.2F2+2H2O=4HF+O2
A
2.盐酸能发生下列反应:①Zn+2HCl═ZnCl2+H2↑②2HCl+CuO═CuCl2+H2O ③MnO2+4HCl═MnCl2+Cl2↑+2H2O,因此盐酸具有的性质是( )
A.只有酸性 B.只有氧化性
C.只有还原性 D.以上三种均具有
D
3.氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既不是氧化剂也不是还原剂等。下列反应与C+H2O(g)CO+H2相比较,水的作用相同的是( )
A. 3Fe+4H2O(g) FeO4+4H2 B.Na2O+H2O= 2NaOH
C.2F2+2H2O =4HF+O2 D.3NO2+H2O =2HNO3+NO
A
4.下列变化过程属于氧化反应的是( )
A.HCl→H2 B.Mg→Mg2+
C.Cl-→AgCl D.CuO→Cu
B
3、常见的氧化剂与还原剂
(1)常见的氧化剂
活泼的非金属单质:O2、Cl2、Br2
含高价金属阳离子的化合物:FeCl3 (Fe3+ )、 CuCl2 (Cu2+ )
含某些较高化合价元素的化合物:浓H2SO4 、HNO3、KMnO4( MnO4-)、MnO2
(2)常见的还原剂
活泼或或较活泼的金属:K、Ca、Na、Al、Mg、Zn (按金 属活动性顺序,还原性递减)
含低价金属阳离子的化合物:Fe2+
某些非金属单质:C、H2
含有较低化合价元素的化合物:HCl 、H2S、HI、KI
注意:元素在最高价时只有氧化性,最低价时只有还原性。
1.下列粒子中,只有氧化性的是( )
①S2- ②Fe2+ ③Fe3+ ④S ⑤H+ ⑥Na+ ⑦Mg
A.①⑦ B.②④ C.③⑤⑥ D. ②④⑤⑥
C
2.下列物质中,按只有氧化性,只有还原性,既有氧化性又有还原性的顺序排列的一组是( )
A.Na+、K、HCl B.Cl2、Al、H2
C.NO2、Na、Al3+ D.O2、SO2、H2O
A
3.下列变化中,加入还原剂才能实现的是( )
A.Na2O→NaOH B.H2SO4→H2
C.CuO→CuSO4 D.SO2→SO3
B
4.吸入人体内的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体内的活性氧,由此推断Na2SeO3的作用是( )
A.作还原剂 B.作氧化剂
C.既作氧化剂又作还原剂 D.既不作氧化剂又不作还原剂
A
5.在下列变化中,需要加入合适的氧化剂才能实现的是( )
A.HCl→H2 B.CO2→CO
C.Fe2O3→Fe D.Br-→Br2
D
4、氧化性与还原性强弱比较
(1)氧化性
氧化剂
>
氧化产物
(2)还原性
还原剂
>
还原产物
例:Mg + 2HCl = MgCl2 + H2↑, HCl是氧化剂, MgCl2是氧化产物, Mg是还原剂, H2是还原产物
氧化性: HCl > MgCl2
还原性: Mg > H2
注意:反应遵循强制弱
1.已知在某温度时发生如下三个反应:
①C+CO2=2CO;②C+H2O(g) =CO+H2 ;③CO+H2O CO2+H2,由此可判断,在该温度下,C、CO、H2的还原性的顺序是( )
A.CO>C>H2 B.CO>H2>C C.C>H2>CO D.C>CO>H2
D
2.已知:①2FeCl3+2KI===2FeCl2+2KCl+I2;②2FeCl2+Cl2===2FeCl3.下列粒子的氧化性从强到弱的顺序正确的是( )
A.Cl2>Fe3+>I2 B.I2>Cl2>Fe3+
C.Fe3+>Cl2>I2 D.Cl2>I2>Fe3+
A
3.已知在相同条件下,下列几种微粒的还原性强弱顺序为SO2>I->Fe2+>Br->Cl-。由此判断下列反应不能发生的是( )
A.2Fe3++SO2+2H2O =SO42-+4H++2Fe2+ B.2Br-+SO42-+4H+ =SO2↑+Br2+2H2O
C.2Fe2++2Br-+2Cl2 =2Fe3++Br2+4Cl- D.2Fe3++2I- = 2Fe2++I2
B
4.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应的化学方程式不正确的是( )
A.3Cl2+6FeI2=2FeCl3+4FeI3 B.Cl2+FeI2=FeCl2+I2
C.Co2O3+6HCl=2CoCl2+Cl2↑+3H2O D.2Fe3++2I-=2Fe2++I2
A
