山东省济宁市泗水一中2012-2013学年高二下学期期中考试 化学
文档属性
| 名称 | 山东省济宁市泗水一中2012-2013学年高二下学期期中考试 化学 |  | |
| 格式 | zip | ||
| 文件大小 | 251.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-06-06 14:39:18 | ||
图片预览



文档简介
山东省济宁市泗水一中2012-2013学年高二下学期期中检测
化学
一 、选择题(每小题只有一个选项符合题意,每小题2分,共50分)
1.对水的电离平衡不产生影响的粒子是( )
A.H∶Cl∶ B. C. D.
2.一定能在下列溶液中大量共存的离子组是 ( )
A.pH=0的溶液:Fe2+、Mg2+、NO3-,SO42-
B.由水电离出的c(H+)=1×10-13mol/L的溶液:HCO3-、K+、SO42-、Cl-
C.含大量Fe3+的溶液:NH4+、Na+、SCN-、Cl-
D.pH=14的溶液:Na+、K+、AlO2-、CO32-
3.在配制硫酸铁溶液时,先把硫酸铁晶体溶解在稀硫酸中,再加水稀释到所需的浓度,这样操作的目的是 ( )
A.提高硫酸铁的溶解度 B.防止硫酸铁分解
C.降低溶液的pH D.抑制硫酸铁水解
4.下列说法正确的是( )
A.纸上层析属于色谱分析法,其原理跟“毛细现象”相关,通常以滤纸作为惰性支持物,水作为固定相
B.重结晶时,溶液冷却速度越慢得到的晶体颗粒越小
C.用新制的Cu(OH)2浊液可以检验牙膏中的甘油,生成绛蓝色沉淀
D.将3~4根火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液和稀HNO3,
可以检验火柴头中的氯元素
5.在相同温度下,100mL 0.01mol/L醋酸与10mL 0.1mol/L醋酸相比,下列数值前者大于后者的是( )
A.中和时所需NaOH的量 B.电离程度 C.H+浓度 D.醋酸的物质的量
6.下列说法不正确的是( )
A.进行分液操作时,应先打开上口活塞或使塞上的凹槽对准漏斗口的小孔,然后打开旋塞,下层液体从下口放出,上层液体从漏斗上口倒出
B.纸层析法是以滤纸为惰性支持物,水为固定相,有机溶剂作流动相。用该方法可分离Fe3+和Cu2+,层析后氨熏显色,滤纸上方出现红棕色斑点
C.酸式滴定管、碱式滴定管、容量瓶、移液管都是准确量取一定体积液体的容器,它们在使用时都要进行检查是否漏水、水洗、润洗、注液、调整液面等几个过程
D.在制备硝酸钾晶体的实验中,趁热过滤时,承接滤液的小烧杯中预先加2mL蒸馏水,以防过滤时氯化钠晶体析出
7.下列说法中正确的是( )
A.用电子天平称量化学药品时,必须先称小烧杯的质量,再称量加入试剂后的总质量,两者之差即为药品的质量
B.测定空气中甲醛含量,使50mL注射器充满空气,通入到2mL2×10-4mol/L用硫酸酸化的高锰酸钾溶液中,重复前面的操作直到紫红色褪去,记录消耗空气体积,即可粗略测定空气中甲醛含量
C.实验中为了得到纯净的晶体,制得的硫酸亚铁铵和阿司匹林晶体均用酒精洗涤
D.铁钉镀锌前,先要用砂纸打磨直至表面变得光滑,然后放入45℃的浓盐酸中浸泡2min,再取出用水洗净
8.在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.澄清透明溶液:H+、Na+、SO42-、C6H5O-
B.常温下KW/c(H+)=0.1mol/L的溶液:K+、Na+、SiO32-、NO3-
C.铁片加入产生气泡的溶液:Na+、NH4+、I-、NO2-
D.NaHCO3溶液:K+、Na+、SO42-、Al3+
9.下列情况不能用勒夏特列原理解释的是( )
A.利用饱和NaCl溶液除去Cl2中的HCl
B.乙酸乙酯在碱性条件下水解更充分
C.工业合成氨反应:N2(g)+3H2(g)2NH3 (g) △H=-92.4kJ/mol,采用较高的温度下进行
D.将CO中毒的病人置于高压氧舱治疗
10.下列说法正确的是( )
A.△H<0、△S>0的反应在温度低时不能自发进行
B. NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) △H=+185.57 kJ·mol-l能自发进行,原因是体系有自发地向混乱度增大的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.增加反应物浓度,可使活化分子百分数增加,从而化学反应速率增大
11.CO2转化成有机物实现碳循环,是解决温室效应的有效途径之一,此反应化学平衡常数的表达式为:且温度升高,K值变小。下列说法正确的是 ( )
A.该反应的化学方程式为3H2(g)+CO2(g) CH3OH(g)+H2O(g)△H>O
B.在恒温、恒容的密闭容器中,混合气体的密度不再改变时,该反应一定达到平衡状态
C.在恒温、恒容的密闭容器中,增大H2的浓度时,CO2的转化率增大
D.平衡时,其他条件不变,使用催化剂有利用于CO2的转化
12.在容积一定的密闭容器中发生可逆反应A(g)+2B(g) 2C(g),△H>0;平衡移动关系如图所示。下列说法正确的是 ( )
A.P1< P2,纵坐标指A的质量分数
B.P1> P2,纵坐标指C的质量分数
C.P1< P2,纵坐标指A的转化率
D.P1< P2,纵坐标指混合气体的平均摩尔质量
13.在一个固定体积的密闭容器中,加入2molA和2molB,发生如下反应2A(气)+ 2B(气)3C(气)+ D(气),达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变, 按下列配比作为起始物质达到平衡后,C的浓度仍为Wmol/L的是( )
A. 2molA+1molB+3molC+1molD B. 3molC+1molD+1molB
C. 3molC+1molD D. 1molA+1molB+1.5molC+1molD
14.对于可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是( )
A.达到化学平衡状态时,4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到化学平衡状态
C.达到化学平衡状态后,若增大容器容积,则正反应速率减小,逆反应速率增大
D.化学反应速率的关系为2v正(NH3)=3v正(H2O)
15.右图是恒温下某反应的化学反应速率随反应时间变化的示意图。下列叙述与示意图不相
符合的是( )
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态Ⅱ
C.该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ
D.同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等
16. 下列含有极性键的非极性分子是( )
①CCl4 ②NH3 ③CH4 ④CO2 ⑤N2 ⑥H2O ⑦HF
A.②③④⑤ B.①③④⑤ C.①③④ D.以上均不对
17. 下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 ( )
A.SO2和SiO2 B.NaCl和HCl C.CCl4和KCl D.CO2和H2O
18. 下列说法正确的是 ( )
A.P和S属于第三周期元素,P的第一电离能比S小
B.Na和Rb属于第ⅠA族元素,Rb失电子能力比Na强
C.C和Si属于第ⅣA族元素,Si比C更容易和氢气反应
D.Cl和Br属于第ⅦA族元素,HClO4酸性比HBrO4弱
19.下列数据是对应物质的熔点表,有关的判断正确的是 ( )
Na2O
Na
AlF3
AlCl3
Al2O3
BCl3
CO2
SiO2
920 ℃
97.8 ℃
1291 ℃
190 ℃
2073 ℃
-107 ℃
-57 ℃
1723 ℃
A. 只要含有金属阳离子的晶体就一定是离子晶体
B. AlF3 和AlCl3 晶体熔化时,克服的微粒间作用力类型相同
C.同族元素的氧化物不可能形成不同类型的晶体
D.金属晶体的熔点不一定比分子晶体的高
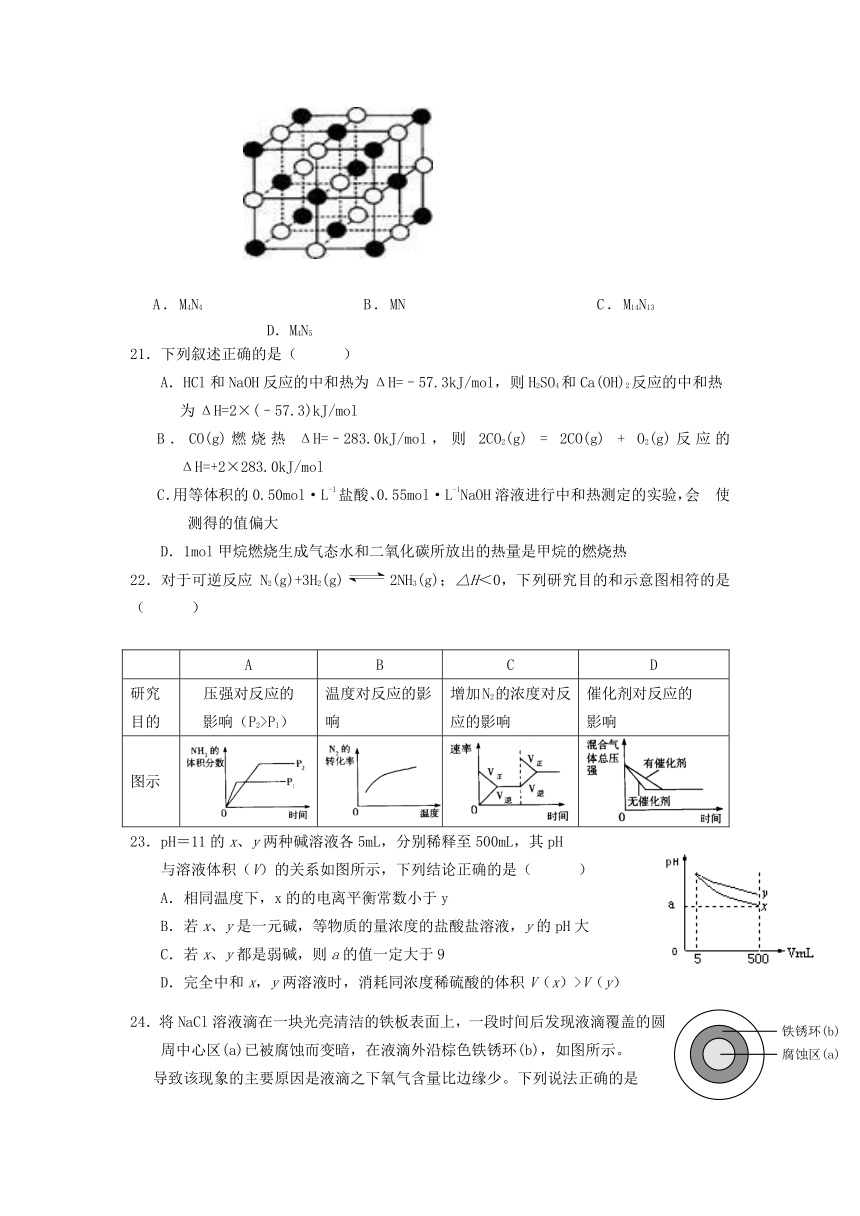
20. 最近发现一种由某金属原子M和非金属原子N构成的气态团簇分子,如图所示.顶角和面心的原子是M原子,棱的中心和体心的原子是N原子,它的化学式为( )
A.M4N4??????? ???B.MN??????????? ?C.M14N13??????????????D.M4N5
21.下列叙述正确的是( )
A.HCl和NaOH反应的中和热为ΔH=–57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热
为ΔH=2×(–57.3)kJ/mol
B.CO(g)燃烧热ΔH=–283.0kJ/mol,则2CO2(g) = 2CO(g) + O2(g)反应的 ΔH=+2×283.0kJ/mol
C.用等体积的0.50mol·L-1盐酸、0.55mol·L-1NaOH溶液进行中和热测定的实验,会 使测得的值偏大
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
22.对于可逆反应N2(g)+3H2(g)2NH3(g);△H<0,下列研究目的和示意图相符的是( )
A
B
C
D
研究目的
压强对反应的
影响(P2>P1)
温度对反应的影响
增加N2的浓度对反应的影响
催化剂对反应的
影响
图示
23.pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH
与溶液体积(V)的关系如图所示,下列结论正确的是( )
A.相同温度下,x的的电离平衡常数小于y
B.若x、y是一元碱,等物质的量浓度的盐酸盐溶液,y的pH大
C.若x、y都是弱碱,则a的值一定大于9
D.完全中和x,y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y)
24.将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示。
导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是( )
A.液滴中的Cl-由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e- = Cu2+
25.下列最终有关物质的量浓度关系正确的是( )
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合后溶液中离子浓度关系:
c(H+) + c(M+) = c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
D.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合,溶液成酸性:
c(CH3COO-)<c(CH3COOH)
二、填空题(共44分)
26.(11分)某化学兴趣小组对电化学问题进行了实验探究。
Ⅰ.利用右图装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生。
⑴写出负极的电极反应式 。
⑵某学生认为,铁电极可能参与反应,并对产物作出假设:
假设1:铁参与反应,被氧化生成Fe2+
假设2:铁参与反应,被氧化生成Fe3+
假设3: 。
⑶为了探究假设1、2,他采取如下操作:
①取0.01mol/L FeCl3溶液2mL于试管中,加入过量铁粉;
②取操作①试管的上层清夜加入2滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③取少量正极附近溶液加入2滴K3[Fe(CN)6]溶液,未见蓝色沉淀生成;
④取少量正极附近溶液加入2滴KSCN溶液,未见溶液变红;
据②、③、④现象得出的结论是 。
⑷该实验原理可应用于防护钢铁腐蚀,请再举一例防护钢铁腐蚀的措施 。
Ⅱ.利用右图装置作电解50mL 0.5mol/L的CuCl2溶液实验。
实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色;
B.电解一段时间以后,阴极表面除有铜吸附外,还出现了少量气泡和浅蓝色固体。
⑴分析实验记录A中试纸颜色变化,用离子方程式解释:① ;
② 。
⑵分析实验记录B中浅蓝色固体可能是 (写化学式),试分析生成该物质的原因 。
27.(8分)下表是元素周期表的一部分,表中列出了8种元素在周期表中的位置。请回答有关问题。
主族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
⑤
⑥
⑦
3
②
④
4
①
③
⑧
(1)写出元素⑧的基态原子核外电子排布式 ;
(2)元素⑤⑥⑦第一电离能由大到小的顺序是 (用电离能和元素符号表示);
(3)元素①、②、③对应的氧化物熔点由高到低的顺序排列是 (填化学式);
(4)元素③、②、④形成的单质晶体的熔点升高的原因是
。
28.(7分)某班学生对BeCl2是离子化合物还是共价化合物进行集体探究,从经验看铍是金属元素,易失去电子,氯元素易得到电子,请回答以下问题:
(1) Be的电负性是1.5,Cl的电负性是3.0,则BeCl2应为 化合物。
(2)工业上制取BeCl2方法是:将得到的BeCl2溶液在HCl气流中蒸干灼烧,防止BeCl2水解,请写出BeCl2水解的化学方程式 。
(3)经实验验证,熔融的BeCl2不能导电,说明它是 化合物;BeCl2能溶于水,水溶液能导电,因它在溶液中能电离,写出它的电离方程式 。
(4)在周期表中,铍元素和铝元素恰好处于对角线位置,根据对角线法则,判断BeCl2应与 (填MgCl2或AlCl3)化学性质更相似。
(5)0.1mol氢氧化铍恰好能和100mL0.2mol/L的氢氧化钠溶液发生反应,写出反应的化学方程式 。
29.(15分)下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp (25℃)。
电解质
平衡方程式
平衡常数K
Ksp
CH3COOH
CH3COOHCH3COO-+H+
1.76×10-5
H2CO3
H2CO3H++HCO
HCOH++CO
K1=4.31×10-7
K2=5.61×10-11
C6H5OH
C6H5OH C6H5O-+H+
1.1×10-10
H3PO4
H3PO4H++H2PO
H2POH++HPO
HPOH++PO
K1=7.52×10-3
K2=6.23×10-8
K3=2.20×10-13
H3BO3
5.7×10-10
NH3·H2O
NH3·H2O NH4++OH-
1.76×10-5
H2O
Kw=1.0×10-14
Mg(OH)2
Mg(OH)2 Mg2++2OH-
5.6×10-12
回答下列问题:
I.(1)由上表分析,若①CH3COOH ②HCO ③C6H5OH ④H2PO均可看作酸,则它们酸性由强到弱的顺序为 (须填编号);
(2)写出C6H5OH与Na3PO4反应的离子方程式: ;
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)
c(NH4+);(填“>”、“=”或“<”)
(4)25℃时,向10mL 0.01mol/L苯酚溶液中滴加VmL 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是 ;
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度大于10mL 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+ 2 c(NH4+)= c(C6H5O-)+ c(C6H5OH)
(5)如左上图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
① T1 T2(填>、=、<);
② 讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是 。
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
II.平衡常数的计算:
(1)用0.1000mol·L-1NaOH溶液滴定20.00mL某未知浓度的醋酸溶液,滴定曲线右上图。其中①点所示溶液中c(CH3COO-)=2c(CH3COOH)
③点所示溶液中存在:c(CH3COO-)+c(CH3COOH)=c(Na+)
则CH3COOH的电离平衡常数Ka= 。
(2)水解反应是典型的可逆反应。水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式:Kh= 。
(3)MgCl2溶液和氨水混合后存在下列化学平衡:Mg2+(aq)+2NH3·H2O(aq)2NH4+(aq)+Mg(OH)2(s)
试列出该反应平衡常数K与Kb(NH3·H2O)、Ksp[Mg(OH)2]的关系式并计算: 。
三、计算题(本题共6分)
30.用图所示的装置进行电解。通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色。
(1)A中Fe电极处所发生的电极方程式为 。
(2)在B中观察到的现象是 。
(3)室温下,若从电解开始到结束,A、B装置中共收集到气体0.168 L(标况),若电解过程中无其他副反应发生,经测定电解后A中溶液体积恰为1000mL,求A溶液的pH。
参考答案:
1-5 CDDAB 6-10 CBBCB 11-15 CBCAB 16-20 CDBCC 21-25 BCCBA
26.Ⅰ、⑴Zn-2e-=Zn2+(1分);
⑵铁参与反应,被氧化生成Fe2+和Fe3+(1分);
⑶正极附近溶液不含Fe2+和Fe3+(1分);
⑷油漆(其他合理答案均可)(1分)。
Ⅱ、⑴2I-+Cl2=I2+2Cl-(2分);5Cl2+I2+6H2O=10Cl-+2IO3-+12H+(2分);
⑵Cu(OH)2(1分),电解较长时间后,c(Cu2+)下降,H+开始放电,溶液pH增大,Cu2+转化为Cu(OH)2(2分);
27.(8分;2分/空)
(1) 1s22s22p63s23p63d104s24p5
(2) I1(O)>I1(N)>I1(C)
(3) MgO>CaO>K2O
(4) 金属阳离子半径减小,自由电子增多,金属键增强,熔点升高。
28.(1)共价(1分)
(2)BeCl2+2H2O 2HCl+Be(OH)2(没有写可逆号给1分)
(3)共价 ;(1分)BeCl2 === Be2+ + 2Cl—(2分)
(4)AlCl3 (1分)
(5)Be(OH)2+2NaOH===Na2BeO2+2H2O(2分)
29.Ⅰ、(1)①④③② (2分)
(2)C6H5OH + PO= C6H5O-+ HPO (3分)
(3)= (1分)
(4)CD (2分)
(5)①<(1分) ②ABC (2分)
Ⅱ、(1)2×10 (5 mol·L -1(2分)
(2)Kh==Kw/Ka (1分)
(3)=55.3 (1分)
30. (1)4AgNO3 + 2H2O=4Ag + O2↑+4HNO3 (2)铜片溶解,气体生成、蓝色沉淀 (3)2
化学
一 、选择题(每小题只有一个选项符合题意,每小题2分,共50分)
1.对水的电离平衡不产生影响的粒子是( )
A.H∶Cl∶ B. C. D.
2.一定能在下列溶液中大量共存的离子组是 ( )
A.pH=0的溶液:Fe2+、Mg2+、NO3-,SO42-
B.由水电离出的c(H+)=1×10-13mol/L的溶液:HCO3-、K+、SO42-、Cl-
C.含大量Fe3+的溶液:NH4+、Na+、SCN-、Cl-
D.pH=14的溶液:Na+、K+、AlO2-、CO32-
3.在配制硫酸铁溶液时,先把硫酸铁晶体溶解在稀硫酸中,再加水稀释到所需的浓度,这样操作的目的是 ( )
A.提高硫酸铁的溶解度 B.防止硫酸铁分解
C.降低溶液的pH D.抑制硫酸铁水解
4.下列说法正确的是( )
A.纸上层析属于色谱分析法,其原理跟“毛细现象”相关,通常以滤纸作为惰性支持物,水作为固定相
B.重结晶时,溶液冷却速度越慢得到的晶体颗粒越小
C.用新制的Cu(OH)2浊液可以检验牙膏中的甘油,生成绛蓝色沉淀
D.将3~4根火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液和稀HNO3,
可以检验火柴头中的氯元素
5.在相同温度下,100mL 0.01mol/L醋酸与10mL 0.1mol/L醋酸相比,下列数值前者大于后者的是( )
A.中和时所需NaOH的量 B.电离程度 C.H+浓度 D.醋酸的物质的量
6.下列说法不正确的是( )
A.进行分液操作时,应先打开上口活塞或使塞上的凹槽对准漏斗口的小孔,然后打开旋塞,下层液体从下口放出,上层液体从漏斗上口倒出
B.纸层析法是以滤纸为惰性支持物,水为固定相,有机溶剂作流动相。用该方法可分离Fe3+和Cu2+,层析后氨熏显色,滤纸上方出现红棕色斑点
C.酸式滴定管、碱式滴定管、容量瓶、移液管都是准确量取一定体积液体的容器,它们在使用时都要进行检查是否漏水、水洗、润洗、注液、调整液面等几个过程
D.在制备硝酸钾晶体的实验中,趁热过滤时,承接滤液的小烧杯中预先加2mL蒸馏水,以防过滤时氯化钠晶体析出
7.下列说法中正确的是( )
A.用电子天平称量化学药品时,必须先称小烧杯的质量,再称量加入试剂后的总质量,两者之差即为药品的质量
B.测定空气中甲醛含量,使50mL注射器充满空气,通入到2mL2×10-4mol/L用硫酸酸化的高锰酸钾溶液中,重复前面的操作直到紫红色褪去,记录消耗空气体积,即可粗略测定空气中甲醛含量
C.实验中为了得到纯净的晶体,制得的硫酸亚铁铵和阿司匹林晶体均用酒精洗涤
D.铁钉镀锌前,先要用砂纸打磨直至表面变得光滑,然后放入45℃的浓盐酸中浸泡2min,再取出用水洗净
8.在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.澄清透明溶液:H+、Na+、SO42-、C6H5O-
B.常温下KW/c(H+)=0.1mol/L的溶液:K+、Na+、SiO32-、NO3-
C.铁片加入产生气泡的溶液:Na+、NH4+、I-、NO2-
D.NaHCO3溶液:K+、Na+、SO42-、Al3+
9.下列情况不能用勒夏特列原理解释的是( )
A.利用饱和NaCl溶液除去Cl2中的HCl
B.乙酸乙酯在碱性条件下水解更充分
C.工业合成氨反应:N2(g)+3H2(g)2NH3 (g) △H=-92.4kJ/mol,采用较高的温度下进行
D.将CO中毒的病人置于高压氧舱治疗
10.下列说法正确的是( )
A.△H<0、△S>0的反应在温度低时不能自发进行
B. NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) △H=+185.57 kJ·mol-l能自发进行,原因是体系有自发地向混乱度增大的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.增加反应物浓度,可使活化分子百分数增加,从而化学反应速率增大
11.CO2转化成有机物实现碳循环,是解决温室效应的有效途径之一,此反应化学平衡常数的表达式为:且温度升高,K值变小。下列说法正确的是 ( )
A.该反应的化学方程式为3H2(g)+CO2(g) CH3OH(g)+H2O(g)△H>O
B.在恒温、恒容的密闭容器中,混合气体的密度不再改变时,该反应一定达到平衡状态
C.在恒温、恒容的密闭容器中,增大H2的浓度时,CO2的转化率增大
D.平衡时,其他条件不变,使用催化剂有利用于CO2的转化
12.在容积一定的密闭容器中发生可逆反应A(g)+2B(g) 2C(g),△H>0;平衡移动关系如图所示。下列说法正确的是 ( )
A.P1< P2,纵坐标指A的质量分数
B.P1> P2,纵坐标指C的质量分数
C.P1< P2,纵坐标指A的转化率
D.P1< P2,纵坐标指混合气体的平均摩尔质量
13.在一个固定体积的密闭容器中,加入2molA和2molB,发生如下反应2A(气)+ 2B(气)3C(气)+ D(气),达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变, 按下列配比作为起始物质达到平衡后,C的浓度仍为Wmol/L的是( )
A. 2molA+1molB+3molC+1molD B. 3molC+1molD+1molB
C. 3molC+1molD D. 1molA+1molB+1.5molC+1molD
14.对于可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是( )
A.达到化学平衡状态时,4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到化学平衡状态
C.达到化学平衡状态后,若增大容器容积,则正反应速率减小,逆反应速率增大
D.化学反应速率的关系为2v正(NH3)=3v正(H2O)
15.右图是恒温下某反应的化学反应速率随反应时间变化的示意图。下列叙述与示意图不相
符合的是( )
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态Ⅱ
C.该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ
D.同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等
16. 下列含有极性键的非极性分子是( )
①CCl4 ②NH3 ③CH4 ④CO2 ⑤N2 ⑥H2O ⑦HF
A.②③④⑤ B.①③④⑤ C.①③④ D.以上均不对
17. 下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 ( )
A.SO2和SiO2 B.NaCl和HCl C.CCl4和KCl D.CO2和H2O
18. 下列说法正确的是 ( )
A.P和S属于第三周期元素,P的第一电离能比S小
B.Na和Rb属于第ⅠA族元素,Rb失电子能力比Na强
C.C和Si属于第ⅣA族元素,Si比C更容易和氢气反应
D.Cl和Br属于第ⅦA族元素,HClO4酸性比HBrO4弱
19.下列数据是对应物质的熔点表,有关的判断正确的是 ( )
Na2O
Na
AlF3
AlCl3
Al2O3
BCl3
CO2
SiO2
920 ℃
97.8 ℃
1291 ℃
190 ℃
2073 ℃
-107 ℃
-57 ℃
1723 ℃
A. 只要含有金属阳离子的晶体就一定是离子晶体
B. AlF3 和AlCl3 晶体熔化时,克服的微粒间作用力类型相同
C.同族元素的氧化物不可能形成不同类型的晶体
D.金属晶体的熔点不一定比分子晶体的高
20. 最近发现一种由某金属原子M和非金属原子N构成的气态团簇分子,如图所示.顶角和面心的原子是M原子,棱的中心和体心的原子是N原子,它的化学式为( )
A.M4N4??????? ???B.MN??????????? ?C.M14N13??????????????D.M4N5
21.下列叙述正确的是( )
A.HCl和NaOH反应的中和热为ΔH=–57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热
为ΔH=2×(–57.3)kJ/mol
B.CO(g)燃烧热ΔH=–283.0kJ/mol,则2CO2(g) = 2CO(g) + O2(g)反应的 ΔH=+2×283.0kJ/mol
C.用等体积的0.50mol·L-1盐酸、0.55mol·L-1NaOH溶液进行中和热测定的实验,会 使测得的值偏大
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
22.对于可逆反应N2(g)+3H2(g)2NH3(g);△H<0,下列研究目的和示意图相符的是( )
A
B
C
D
研究目的
压强对反应的
影响(P2>P1)
温度对反应的影响
增加N2的浓度对反应的影响
催化剂对反应的
影响
图示
23.pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH
与溶液体积(V)的关系如图所示,下列结论正确的是( )
A.相同温度下,x的的电离平衡常数小于y
B.若x、y是一元碱,等物质的量浓度的盐酸盐溶液,y的pH大
C.若x、y都是弱碱,则a的值一定大于9
D.完全中和x,y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y)
24.将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示。
导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是( )
A.液滴中的Cl-由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e- = Cu2+
25.下列最终有关物质的量浓度关系正确的是( )
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合后溶液中离子浓度关系:
c(H+) + c(M+) = c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
D.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合,溶液成酸性:
c(CH3COO-)<c(CH3COOH)
二、填空题(共44分)
26.(11分)某化学兴趣小组对电化学问题进行了实验探究。
Ⅰ.利用右图装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生。
⑴写出负极的电极反应式 。
⑵某学生认为,铁电极可能参与反应,并对产物作出假设:
假设1:铁参与反应,被氧化生成Fe2+
假设2:铁参与反应,被氧化生成Fe3+
假设3: 。
⑶为了探究假设1、2,他采取如下操作:
①取0.01mol/L FeCl3溶液2mL于试管中,加入过量铁粉;
②取操作①试管的上层清夜加入2滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③取少量正极附近溶液加入2滴K3[Fe(CN)6]溶液,未见蓝色沉淀生成;
④取少量正极附近溶液加入2滴KSCN溶液,未见溶液变红;
据②、③、④现象得出的结论是 。
⑷该实验原理可应用于防护钢铁腐蚀,请再举一例防护钢铁腐蚀的措施 。
Ⅱ.利用右图装置作电解50mL 0.5mol/L的CuCl2溶液实验。
实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色;
B.电解一段时间以后,阴极表面除有铜吸附外,还出现了少量气泡和浅蓝色固体。
⑴分析实验记录A中试纸颜色变化,用离子方程式解释:① ;
② 。
⑵分析实验记录B中浅蓝色固体可能是 (写化学式),试分析生成该物质的原因 。
27.(8分)下表是元素周期表的一部分,表中列出了8种元素在周期表中的位置。请回答有关问题。
主族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
⑤
⑥
⑦
3
②
④
4
①
③
⑧
(1)写出元素⑧的基态原子核外电子排布式 ;
(2)元素⑤⑥⑦第一电离能由大到小的顺序是 (用电离能和元素符号表示);
(3)元素①、②、③对应的氧化物熔点由高到低的顺序排列是 (填化学式);
(4)元素③、②、④形成的单质晶体的熔点升高的原因是
。
28.(7分)某班学生对BeCl2是离子化合物还是共价化合物进行集体探究,从经验看铍是金属元素,易失去电子,氯元素易得到电子,请回答以下问题:
(1) Be的电负性是1.5,Cl的电负性是3.0,则BeCl2应为 化合物。
(2)工业上制取BeCl2方法是:将得到的BeCl2溶液在HCl气流中蒸干灼烧,防止BeCl2水解,请写出BeCl2水解的化学方程式 。
(3)经实验验证,熔融的BeCl2不能导电,说明它是 化合物;BeCl2能溶于水,水溶液能导电,因它在溶液中能电离,写出它的电离方程式 。
(4)在周期表中,铍元素和铝元素恰好处于对角线位置,根据对角线法则,判断BeCl2应与 (填MgCl2或AlCl3)化学性质更相似。
(5)0.1mol氢氧化铍恰好能和100mL0.2mol/L的氢氧化钠溶液发生反应,写出反应的化学方程式 。
29.(15分)下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp (25℃)。
电解质
平衡方程式
平衡常数K
Ksp
CH3COOH
CH3COOHCH3COO-+H+
1.76×10-5
H2CO3
H2CO3H++HCO
HCOH++CO
K1=4.31×10-7
K2=5.61×10-11
C6H5OH
C6H5OH C6H5O-+H+
1.1×10-10
H3PO4
H3PO4H++H2PO
H2POH++HPO
HPOH++PO
K1=7.52×10-3
K2=6.23×10-8
K3=2.20×10-13
H3BO3
5.7×10-10
NH3·H2O
NH3·H2O NH4++OH-
1.76×10-5
H2O
Kw=1.0×10-14
Mg(OH)2
Mg(OH)2 Mg2++2OH-
5.6×10-12
回答下列问题:
I.(1)由上表分析,若①CH3COOH ②HCO ③C6H5OH ④H2PO均可看作酸,则它们酸性由强到弱的顺序为 (须填编号);
(2)写出C6H5OH与Na3PO4反应的离子方程式: ;
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)
c(NH4+);(填“>”、“=”或“<”)
(4)25℃时,向10mL 0.01mol/L苯酚溶液中滴加VmL 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是 ;
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度大于10mL 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+ 2 c(NH4+)= c(C6H5O-)+ c(C6H5OH)
(5)如左上图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
① T1 T2(填>、=、<);
② 讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是 。
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
II.平衡常数的计算:
(1)用0.1000mol·L-1NaOH溶液滴定20.00mL某未知浓度的醋酸溶液,滴定曲线右上图。其中①点所示溶液中c(CH3COO-)=2c(CH3COOH)
③点所示溶液中存在:c(CH3COO-)+c(CH3COOH)=c(Na+)
则CH3COOH的电离平衡常数Ka= 。
(2)水解反应是典型的可逆反应。水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式:Kh= 。
(3)MgCl2溶液和氨水混合后存在下列化学平衡:Mg2+(aq)+2NH3·H2O(aq)2NH4+(aq)+Mg(OH)2(s)
试列出该反应平衡常数K与Kb(NH3·H2O)、Ksp[Mg(OH)2]的关系式并计算: 。
三、计算题(本题共6分)
30.用图所示的装置进行电解。通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色。
(1)A中Fe电极处所发生的电极方程式为 。
(2)在B中观察到的现象是 。
(3)室温下,若从电解开始到结束,A、B装置中共收集到气体0.168 L(标况),若电解过程中无其他副反应发生,经测定电解后A中溶液体积恰为1000mL,求A溶液的pH。
参考答案:
1-5 CDDAB 6-10 CBBCB 11-15 CBCAB 16-20 CDBCC 21-25 BCCBA
26.Ⅰ、⑴Zn-2e-=Zn2+(1分);
⑵铁参与反应,被氧化生成Fe2+和Fe3+(1分);
⑶正极附近溶液不含Fe2+和Fe3+(1分);
⑷油漆(其他合理答案均可)(1分)。
Ⅱ、⑴2I-+Cl2=I2+2Cl-(2分);5Cl2+I2+6H2O=10Cl-+2IO3-+12H+(2分);
⑵Cu(OH)2(1分),电解较长时间后,c(Cu2+)下降,H+开始放电,溶液pH增大,Cu2+转化为Cu(OH)2(2分);
27.(8分;2分/空)
(1) 1s22s22p63s23p63d104s24p5
(2) I1(O)>I1(N)>I1(C)
(3) MgO>CaO>K2O
(4) 金属阳离子半径减小,自由电子增多,金属键增强,熔点升高。
28.(1)共价(1分)
(2)BeCl2+2H2O 2HCl+Be(OH)2(没有写可逆号给1分)
(3)共价 ;(1分)BeCl2 === Be2+ + 2Cl—(2分)
(4)AlCl3 (1分)
(5)Be(OH)2+2NaOH===Na2BeO2+2H2O(2分)
29.Ⅰ、(1)①④③② (2分)
(2)C6H5OH + PO= C6H5O-+ HPO (3分)
(3)= (1分)
(4)CD (2分)
(5)①<(1分) ②ABC (2分)
Ⅱ、(1)2×10 (5 mol·L -1(2分)
(2)Kh==Kw/Ka (1分)
(3)=55.3 (1分)
30. (1)4AgNO3 + 2H2O=4Ag + O2↑+4HNO3 (2)铜片溶解,气体生成、蓝色沉淀 (3)2
同课章节目录
