江苏省盐城市2021-2022学年高二下学期期末模拟检测化学试题(Word版含答案)
文档属性
| 名称 | 江苏省盐城市2021-2022学年高二下学期期末模拟检测化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-29 15:32:23 | ||
图片预览




文档简介
江苏省盐城市2021-2022学年高二下学期期末模拟检测
化学试卷
(考试时间:75分钟 满分:100分)
可能用到的相对原子质量:H-1 C-12 O-16
一、单项选择题:共14题,每题3分,共42分。每题只有一个选项符合题意。
1.北京冬奥会国家速滑馆用CO2代替氟利昂(氟氯代烃)、液氨等传统制冷剂,采取跨临界直冷制冰技术制造出更优质冰面,助力选手发挥,打造科技冬奥。下列说法正确的是 ( B )
A.减少氟利昂的使用可有效防治酸雨
B.氨气易液化与分子间存在氢键有关
C.CO2是含非极性键的极性分子
D.冰是原子间通过共价键形成的原子晶体
2.下列有关物质的化学用语正确的是 ( C )
A.乙醇的空间填充模型:
B.甲基的电子式:
C.含10个中子的O原子:
D.间二甲苯的结构简式:
3.下列推理正确的是 ( B )
A.甲烷的一氯代物只有一种结构,说明甲烷不是平面正方型而是正四面体型
B.每个CH3COOH分子中有7个σ键和1个π键,C原子的杂化方式有sp3和sp2两种
C.分子式为C2H6O的有机物存在三种化学环境不同的氢,说明该有机物是CH3OCH3
D.分子式为C4H6的炔烃所有碳原子均在同一直线上,说明该炔烃是HC≡CCH2CH3
4.以乙炔为原料在不同的反应条件下可以合成多种化合物,部分如下图所示。
下列说法不正确的是: ( D )
A.正四面体烷与乙烯基乙炔互为同分异构体
B.乙烯基乙炔中所有原子一定共平面
C.1mol乙烯基乙炔最多能与3molBr2发生加成反应
D.环辛四烯的一种同分异构体可能同时含苯环和碳碳三键
5. 在水溶液中与HCHO发生如下反应:。下列说法正确的是 ( D )
A. HCHO的分子构型是是三角锥形
B. 基态的电子排布式为
C. 中与形成配位键的原子是H
D. 1mol 中所含键的数目是6mol
6. 在25℃时两种酸的电离常数如下:H2CO3 :Ki1=4.2×10-7 , Ki2=5.6×10-11;
H2S :Ki1=5.7×10-8,Ki2=1.2×10-15 ,则下列反应可能发生的是 ( C )
NaHCO3+NaHS → Na2CO3+H2S↑ B.Na2S+H2O+CO2 → Na2CO3+H2S↑
C. H2S+Na2CO3 → NaHS+NaHCO3 D. H2S+NaHCO3 → NaHS+H2CO3
7. X、Y、Z、W属于周期表短周期主族元素,且原子序数依次增大。元素X的基态原子中所含3个能级的电子数均相等,元素Y的基态原子中2p能级上成单电子数与X相同,Z与X同主族,元素W的基态原子只含有1个未成对电子。下列说法正确的是 ( B )
A. 原子半径; B. 第一电离能:
C. 和的晶体类型相同 D. 最高价氧化物对应水化物的酸性:W<Z
8. 有科学家提出一种常温、常压、有催化剂条件下合成氨的新方法,反应原理如下:
△H
已知:
①N2(g)+3H2(g)2NH3(g)
②
③
下列有关说法正确是 ( D )
A. 反应①在任何条件下都能自发进行 B.
C. (g)的燃烧热为b D. 合成氨反应使用催化剂可以降低活化能
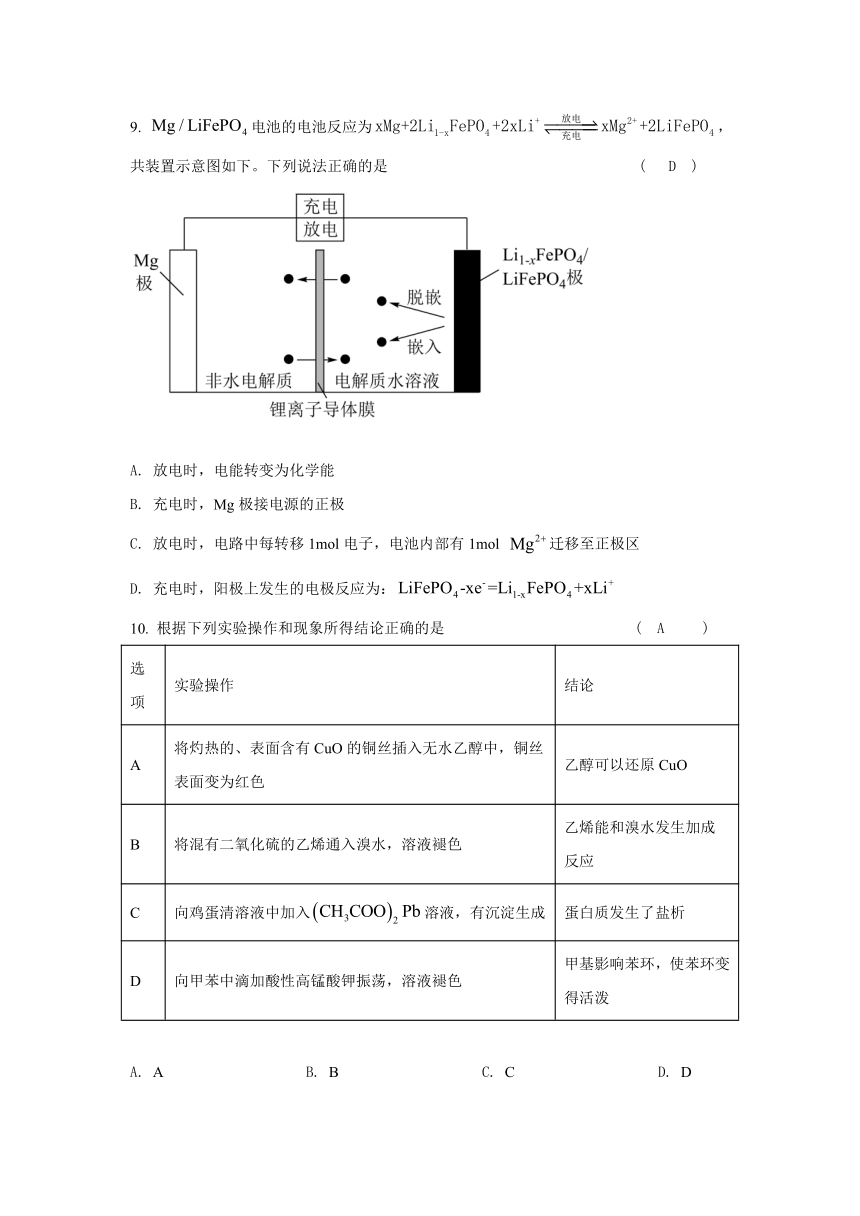
9. 电池的电池反应为,共装置示意图如下。下列说法正确的是 ( D )
A. 放电时,电能转变为化学能
B. 充电时,Mg极接电源的正极
C. 放电时,电路中每转移1mol电子,电池内部有1mol 迁移至正极区
D. 充电时,阳极上发生的电极反应为:
10. 根据下列实验操作和现象所得结论正确的是 ( A )
选项 实验操作 结论
A 将灼热的、表面含有CuO的铜丝插入无水乙醇中,铜丝表面变为红色 乙醇可以还原CuO
B 将混有二氧化硫的乙烯通入溴水,溶液褪色 乙烯能和溴水发生加成反应
C 向鸡蛋清溶液中加入溶液,有沉淀生成 蛋白质发生了盐析
D 向甲苯中滴加酸性高锰酸钾振荡,溶液褪色 甲基影响苯环,使苯环变得活泼
A. A B. B C. C D. D
11.下列说法不正确的是 ( B )
A.有机物 的分子式为C5H8
B.对二甲苯的核磁共振氢谱有3个特征峰
C.含有手性碳原子的分子存在对映异构体
D.2-甲基丙烯不存在顺反异构体
12. 对于反应N2O4(g)2NO2(g) △H=+57kJ·mol-1,下列有关说法正确的是( A )
A. 若容器体积不变,气体颜色不变时说明该反应建立化学平衡
B.升高体系温度正反应速率增大,逆反应速率减小
C. 其它条件不变,向平衡后的容器中再加入少量N2O4,新平衡后的值变大
D. 增大体系的压强能提高N2O4的反应速率和转化率
13. 下列图示与对应的叙述不相符合的是 ( C )
A. 图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH变化曲线,其中a表示氨水稀释时pH的变化曲线
B.图3表示工业上用CO生产甲醇的反应CO(g)+2H2(g)CH3OH(g),
该反应的ΔH=-91 kJ·mol-1
C. 图2表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂
D. 图4表示10 mL 0.01 mol·L-1酸性KMnO4溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用)
14. 室温下,通过下列实验探究NaHS溶液的性质。
实验 实验操作和现象
1 向0.1mol L-1NaHS溶液中滴加几滴酚酞试剂,溶液变红
2 向0.1mol L-1NaHS溶液中加入等体积0.1mol L-1NaOH溶液充分混合
3 向0.1mol L-1NaHS溶液中通入过氯气,无淡黄色沉淀产生
4 向0.1mol L-1NaHS溶液中滴加过CuCl2溶液,产生黑色沉淀
下列有关说法正确的是 ( B )
A. 0.1mol/LNaHS溶液中:c(HS-)>c(S2-)>c(H2S)
B. 实验2所得溶液中:c(Na+)-c(S2-)-c(HS-)-c(H2S)=0.05mol L-1
C. 实验3证明HS-不能被氧化
D. 实验4反应静置后的上层清液中有c(Cu2+) c(S2-)二、 非选择题:共4题,共58分。
15.完成下列填充(18分)
(1)用系统命名法对进行命名:______________________。
(2)乙酸的键线式________________________________
(3)甲烷与氯气光照的反应机理(写一步)·Cl+CH4→_______________________
(4)写出CH3CO1OCH2CH3 与H218O加稀硫酸共热的方程式
_______________________________________________________________________
(5)写出甲苯硝化制取TNT的化学方程式__________________________________________
(6)某有机物的质谱图和核磁共振氢谱如下,则该有机物的相对分子质量为________
分子中化学环境不同的氢原子有______________种
(7)萘()与苯都属于芳香烃,是否互为同系物________(填是或否)
萘的一氯代物有 ___________ 种。
(
O
OH
)
(1)2,2,4-三甲基戊烷 (2)
(3)·CH3+HCl (4)
(5)
(6)72, 4 (7) 否,2 (每空2分)
15(10分). 我国科学家研发的金球首套千吨级太阳能燃料合成项目,为实现“碳中和”目标作出了重大贡献。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。
(1)钙钛矿型化合物是一类可用于生产太阳能电池的功能材料,的晶胞如图所示。
①基态原子核外电子排布式为_______。
②组成元素的电负性大小顺序是_______;
一个晶胞中含________O2-。
(2)甲醇的沸点介于水和
甲硫醇之间,其原因是__________________________________________
_____________________________________________________________________________。
(3)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为固溶体。在中掺杂少量后形成的催化剂,化学式可表示为,则___________________(用含x的表达式)。
【答案】(1) ①. ②. ③. 12
(2) 甲硫醇不能形成分子间氢键,而甲醇和水均能,且水比甲醇的氢键多
(3) (每空2分)
17(15分) 化学反应原理对化学反应的研究具有指导意义。
(1)由金红石TiO2制取单质Ti,涉及到的反应为:
① Cs)+O2g)=CO2g);ΔH=3935 kJ·mol-1
② 2COg)+O2g)=2CO2g);ΔH=566 kJ·mol-1
③ TiO2s)+2Cl2g)=TiCl4s)+O2g);ΔH=+141 kJ·mol-1
则TiO2s)+2Cl2g)+2Cs)=TiCl4s)+2COg)的 ΔH=__________________。
(2)一定条件下,Pd-Mg/SiO2催化剂可使CO2甲烷化从而变废为宝,其反应机理如图所示,该反应的化学方程式为_________________________________________________________,反应过程中碳元素的化合价为-2价的中间体是______________________________。
用Cl2生产某些含氯有机物时会产生
副产物HCl。利用反应A,可实现氯的循环
利用。A:4HCl+O22Cl2+2H2O
已知:ⅰ.此条件下反应A中,4 mol HCl被
氧化,生成气态水,放出115.6kJ的热量。
ⅱ.
①写出该条件下,反应A的热化学反应方程式____________________________________。
②断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为_________________kJ。
【答案】(1)80 kJ·mol1
(2) ①. CO2+4H2CH4+2H2O ②. MgOCH2
(3) ①. 4HCl(g)+O2(g)2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1 ②. 31.9
(每空3分)
18(15分). 国家主席习近平在9月22日召开的联合国大会上表示:“中国将争取在2060年前实现碳中和”。所谓“碳中和”,通俗地说,日常活动可能制造的二氧化碳排放量,通过植树、节能减排等方法来中和抵消。
(1)CO2甲烷化反应是由法国化学家PaulSabatier提出的,因此,该反应又叫Sabatier反应。CO2催化氢化制甲烷的研究过程如下图:
①上述过程中,产生H2反应的化学方程式为_____________________________________。
②HCOOH是CO2转化为CH4的中间体:CO2HCOOHCH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,原因是__________________________。
(2)二氧化碳加氢制甲醇的反应在绝热、恒容密闭体系中进行,发生的主要反应是:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。请回答下列有关问题:
①下列示意图正确且能说明该反应进行到t1时刻达到平衡状态的是_______(填标号)。
A. B. C. D.
②在2 L恒容密闭容器a和b中分别投入2 mol CO2和6 mol H2,在不同温度下进行二氧化碳加氢制甲醇的反应,各容器中甲醇的物质的量与时间的关系如图5所示。若容器a、容器b中的反应温度分别为T1、T2,则判断△H_______0(填“>”或“<”)。若容器b中改变条件时,反应情况会由曲线b变为曲线c,则改变的条件是_______。容器b中0~10 min氢气的平均反应速率v(H2)=_______mol L-1 min-1。
(3)已知CO2催化加氢合成乙醇的反应原理为2CO2(g)+6H2(g)C2H5OH(g)+3H2O(g) △H<0。恒压条件下达到平衡状态时,体系中各物质的物质的量分数与温度的关系如图6所示,则图中c的化学式为_______。
【答案】(1) ①. 3Fe+4H2OFe3O4+4H2 ②. 当增加镍粉的用量时,第Ⅱ步反应速率增加更大
①. BC (3分) ②. < ③. 加入催化剂 ④. 0.225 (3) H2O
(其它每空2分)
化学试卷
(考试时间:75分钟 满分:100分)
可能用到的相对原子质量:H-1 C-12 O-16
一、单项选择题:共14题,每题3分,共42分。每题只有一个选项符合题意。
1.北京冬奥会国家速滑馆用CO2代替氟利昂(氟氯代烃)、液氨等传统制冷剂,采取跨临界直冷制冰技术制造出更优质冰面,助力选手发挥,打造科技冬奥。下列说法正确的是 ( B )
A.减少氟利昂的使用可有效防治酸雨
B.氨气易液化与分子间存在氢键有关
C.CO2是含非极性键的极性分子
D.冰是原子间通过共价键形成的原子晶体
2.下列有关物质的化学用语正确的是 ( C )
A.乙醇的空间填充模型:
B.甲基的电子式:
C.含10个中子的O原子:
D.间二甲苯的结构简式:
3.下列推理正确的是 ( B )
A.甲烷的一氯代物只有一种结构,说明甲烷不是平面正方型而是正四面体型
B.每个CH3COOH分子中有7个σ键和1个π键,C原子的杂化方式有sp3和sp2两种
C.分子式为C2H6O的有机物存在三种化学环境不同的氢,说明该有机物是CH3OCH3
D.分子式为C4H6的炔烃所有碳原子均在同一直线上,说明该炔烃是HC≡CCH2CH3
4.以乙炔为原料在不同的反应条件下可以合成多种化合物,部分如下图所示。
下列说法不正确的是: ( D )
A.正四面体烷与乙烯基乙炔互为同分异构体
B.乙烯基乙炔中所有原子一定共平面
C.1mol乙烯基乙炔最多能与3molBr2发生加成反应
D.环辛四烯的一种同分异构体可能同时含苯环和碳碳三键
5. 在水溶液中与HCHO发生如下反应:。下列说法正确的是 ( D )
A. HCHO的分子构型是是三角锥形
B. 基态的电子排布式为
C. 中与形成配位键的原子是H
D. 1mol 中所含键的数目是6mol
6. 在25℃时两种酸的电离常数如下:H2CO3 :Ki1=4.2×10-7 , Ki2=5.6×10-11;
H2S :Ki1=5.7×10-8,Ki2=1.2×10-15 ,则下列反应可能发生的是 ( C )
NaHCO3+NaHS → Na2CO3+H2S↑ B.Na2S+H2O+CO2 → Na2CO3+H2S↑
C. H2S+Na2CO3 → NaHS+NaHCO3 D. H2S+NaHCO3 → NaHS+H2CO3
7. X、Y、Z、W属于周期表短周期主族元素,且原子序数依次增大。元素X的基态原子中所含3个能级的电子数均相等,元素Y的基态原子中2p能级上成单电子数与X相同,Z与X同主族,元素W的基态原子只含有1个未成对电子。下列说法正确的是 ( B )
A. 原子半径; B. 第一电离能:
C. 和的晶体类型相同 D. 最高价氧化物对应水化物的酸性:W<Z
8. 有科学家提出一种常温、常压、有催化剂条件下合成氨的新方法,反应原理如下:
△H
已知:
①N2(g)+3H2(g)2NH3(g)
②
③
下列有关说法正确是 ( D )
A. 反应①在任何条件下都能自发进行 B.
C. (g)的燃烧热为b D. 合成氨反应使用催化剂可以降低活化能
9. 电池的电池反应为,共装置示意图如下。下列说法正确的是 ( D )
A. 放电时,电能转变为化学能
B. 充电时,Mg极接电源的正极
C. 放电时,电路中每转移1mol电子,电池内部有1mol 迁移至正极区
D. 充电时,阳极上发生的电极反应为:
10. 根据下列实验操作和现象所得结论正确的是 ( A )
选项 实验操作 结论
A 将灼热的、表面含有CuO的铜丝插入无水乙醇中,铜丝表面变为红色 乙醇可以还原CuO
B 将混有二氧化硫的乙烯通入溴水,溶液褪色 乙烯能和溴水发生加成反应
C 向鸡蛋清溶液中加入溶液,有沉淀生成 蛋白质发生了盐析
D 向甲苯中滴加酸性高锰酸钾振荡,溶液褪色 甲基影响苯环,使苯环变得活泼
A. A B. B C. C D. D
11.下列说法不正确的是 ( B )
A.有机物 的分子式为C5H8
B.对二甲苯的核磁共振氢谱有3个特征峰
C.含有手性碳原子的分子存在对映异构体
D.2-甲基丙烯不存在顺反异构体
12. 对于反应N2O4(g)2NO2(g) △H=+57kJ·mol-1,下列有关说法正确的是( A )
A. 若容器体积不变,气体颜色不变时说明该反应建立化学平衡
B.升高体系温度正反应速率增大,逆反应速率减小
C. 其它条件不变,向平衡后的容器中再加入少量N2O4,新平衡后的值变大
D. 增大体系的压强能提高N2O4的反应速率和转化率
13. 下列图示与对应的叙述不相符合的是 ( C )
A. 图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH变化曲线,其中a表示氨水稀释时pH的变化曲线
B.图3表示工业上用CO生产甲醇的反应CO(g)+2H2(g)CH3OH(g),
该反应的ΔH=-91 kJ·mol-1
C. 图2表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂
D. 图4表示10 mL 0.01 mol·L-1酸性KMnO4溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用)
14. 室温下,通过下列实验探究NaHS溶液的性质。
实验 实验操作和现象
1 向0.1mol L-1NaHS溶液中滴加几滴酚酞试剂,溶液变红
2 向0.1mol L-1NaHS溶液中加入等体积0.1mol L-1NaOH溶液充分混合
3 向0.1mol L-1NaHS溶液中通入过氯气,无淡黄色沉淀产生
4 向0.1mol L-1NaHS溶液中滴加过CuCl2溶液,产生黑色沉淀
下列有关说法正确的是 ( B )
A. 0.1mol/LNaHS溶液中:c(HS-)>c(S2-)>c(H2S)
B. 实验2所得溶液中:c(Na+)-c(S2-)-c(HS-)-c(H2S)=0.05mol L-1
C. 实验3证明HS-不能被氧化
D. 实验4反应静置后的上层清液中有c(Cu2+) c(S2-)
15.完成下列填充(18分)
(1)用系统命名法对进行命名:______________________。
(2)乙酸的键线式________________________________
(3)甲烷与氯气光照的反应机理(写一步)·Cl+CH4→_______________________
(4)写出CH3CO1OCH2CH3 与H218O加稀硫酸共热的方程式
_______________________________________________________________________
(5)写出甲苯硝化制取TNT的化学方程式__________________________________________
(6)某有机物的质谱图和核磁共振氢谱如下,则该有机物的相对分子质量为________
分子中化学环境不同的氢原子有______________种
(7)萘()与苯都属于芳香烃,是否互为同系物________(填是或否)
萘的一氯代物有 ___________ 种。
(
O
OH
)
(1)2,2,4-三甲基戊烷 (2)
(3)·CH3+HCl (4)
(5)
(6)72, 4 (7) 否,2 (每空2分)
15(10分). 我国科学家研发的金球首套千吨级太阳能燃料合成项目,为实现“碳中和”目标作出了重大贡献。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。
(1)钙钛矿型化合物是一类可用于生产太阳能电池的功能材料,的晶胞如图所示。
①基态原子核外电子排布式为_______。
②组成元素的电负性大小顺序是_______;
一个晶胞中含________O2-。
(2)甲醇的沸点介于水和
甲硫醇之间,其原因是__________________________________________
_____________________________________________________________________________。
(3)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为固溶体。在中掺杂少量后形成的催化剂,化学式可表示为,则___________________(用含x的表达式)。
【答案】(1) ①. ②. ③. 12
(2) 甲硫醇不能形成分子间氢键,而甲醇和水均能,且水比甲醇的氢键多
(3) (每空2分)
17(15分) 化学反应原理对化学反应的研究具有指导意义。
(1)由金红石TiO2制取单质Ti,涉及到的反应为:
① Cs)+O2g)=CO2g);ΔH=3935 kJ·mol-1
② 2COg)+O2g)=2CO2g);ΔH=566 kJ·mol-1
③ TiO2s)+2Cl2g)=TiCl4s)+O2g);ΔH=+141 kJ·mol-1
则TiO2s)+2Cl2g)+2Cs)=TiCl4s)+2COg)的 ΔH=__________________。
(2)一定条件下,Pd-Mg/SiO2催化剂可使CO2甲烷化从而变废为宝,其反应机理如图所示,该反应的化学方程式为_________________________________________________________,反应过程中碳元素的化合价为-2价的中间体是______________________________。
用Cl2生产某些含氯有机物时会产生
副产物HCl。利用反应A,可实现氯的循环
利用。A:4HCl+O22Cl2+2H2O
已知:ⅰ.此条件下反应A中,4 mol HCl被
氧化,生成气态水,放出115.6kJ的热量。
ⅱ.
①写出该条件下,反应A的热化学反应方程式____________________________________。
②断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为_________________kJ。
【答案】(1)80 kJ·mol1
(2) ①. CO2+4H2CH4+2H2O ②. MgOCH2
(3) ①. 4HCl(g)+O2(g)2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1 ②. 31.9
(每空3分)
18(15分). 国家主席习近平在9月22日召开的联合国大会上表示:“中国将争取在2060年前实现碳中和”。所谓“碳中和”,通俗地说,日常活动可能制造的二氧化碳排放量,通过植树、节能减排等方法来中和抵消。
(1)CO2甲烷化反应是由法国化学家PaulSabatier提出的,因此,该反应又叫Sabatier反应。CO2催化氢化制甲烷的研究过程如下图:
①上述过程中,产生H2反应的化学方程式为_____________________________________。
②HCOOH是CO2转化为CH4的中间体:CO2HCOOHCH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,原因是__________________________。
(2)二氧化碳加氢制甲醇的反应在绝热、恒容密闭体系中进行,发生的主要反应是:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。请回答下列有关问题:
①下列示意图正确且能说明该反应进行到t1时刻达到平衡状态的是_______(填标号)。
A. B. C. D.
②在2 L恒容密闭容器a和b中分别投入2 mol CO2和6 mol H2,在不同温度下进行二氧化碳加氢制甲醇的反应,各容器中甲醇的物质的量与时间的关系如图5所示。若容器a、容器b中的反应温度分别为T1、T2,则判断△H_______0(填“>”或“<”)。若容器b中改变条件时,反应情况会由曲线b变为曲线c,则改变的条件是_______。容器b中0~10 min氢气的平均反应速率v(H2)=_______mol L-1 min-1。
(3)已知CO2催化加氢合成乙醇的反应原理为2CO2(g)+6H2(g)C2H5OH(g)+3H2O(g) △H<0。恒压条件下达到平衡状态时,体系中各物质的物质的量分数与温度的关系如图6所示,则图中c的化学式为_______。
【答案】(1) ①. 3Fe+4H2OFe3O4+4H2 ②. 当增加镍粉的用量时,第Ⅱ步反应速率增加更大
①. BC (3分) ②. < ③. 加入催化剂 ④. 0.225 (3) H2O
(其它每空2分)
同课章节目录
