第三单元课题2原子的结构第一课时-2022-2023学年九年级化学人教版上册(共21张PPT)
文档属性
| 名称 | 第三单元课题2原子的结构第一课时-2022-2023学年九年级化学人教版上册(共21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 726.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-29 16:14:33 | ||
图片预览







文档简介
(共21张PPT)
九年级化学组
人教版九年级化学上册
课题2 原子的结构(1)
第三单元 物质构成的奥秘
新课导入
+
+
+
+
+
+
+
+
?
卢瑟福
1911年,英国科学家卢瑟福用一束平行高速运动的α料子轰击金箔时发现:
①有一部分α粒子改变了原来的运动方向;
②大部分α粒子基本不改变运动方向;
③极少数α粒子出现反弹.
学习目标
1、知道原子的结构,以及构成粒子之间的关系;
2、理解原子不显电性的原因
3、知道相对原子质量的含义,并会查相对原子
质量表
探究新知
1、原子和原子核分别是由什么构成的?
2、原子中各粒子的带电情况?
3、原子中,核电荷数、质子数、核外电子数之间存在什么关系?
4.为什么整个原子不显电性?
阅读内容:阅读课本P53
阅读要求:回答下列问题
探究新知
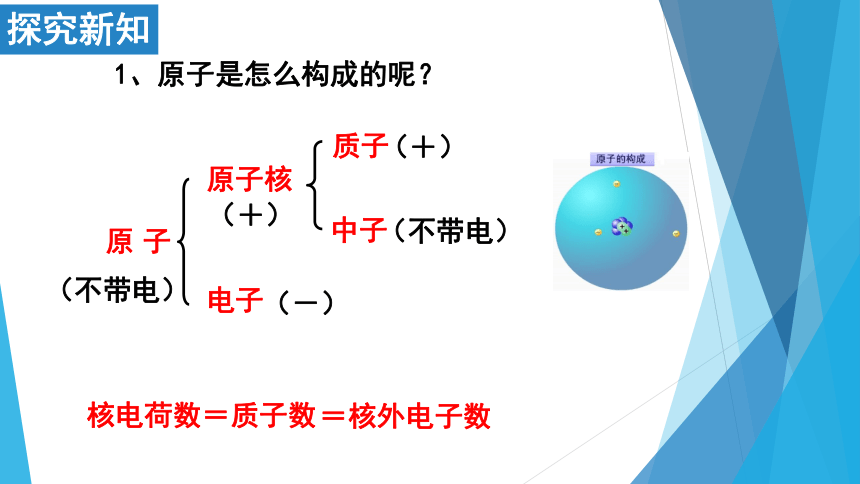
1.原子是由居于原子中心的_______和________构成, 原子核是由_______和______构成。
2、一个原子只有____原子核。
3、每个质子带1个单位的_______,每个电子带1个单位的_________,中子_______电。
原子核
核外电子
负电荷
正电荷
质子
中子
不带
一个
4、由于原子核内质子所带电荷与核外电子的电荷_________,_________,因此,原子不显电性。
5. 核电荷数即_____________________。
6、原子中,核电荷数___质子数___核外电子数
=
=
数量相等
电性相反
原子核所带的正电荷数
探究新知
原 子
电子
原子核
质子
中子
(+)
(不带电)
(-)
(+)
(不带电)
核电荷数=质子数
=核外电子数
1、原子是怎么构成的呢?
探究新知
2.原子带电吗?分子呢?
由于原子核和核外电子所带电量相等,但是电性相反,所以整个原子不显电性。由此可知,由原子构成的分子也不显电性
思考与讨论
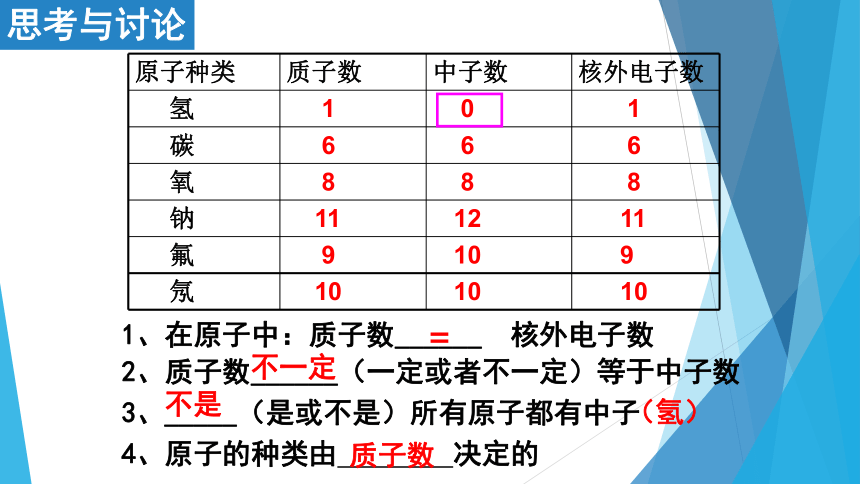
3、_____(是或不是)所有原子都有中子
原子种类 质子数 中子数 核外电子数
氢 1 0 1
碳 6 6 6
氧 8 8 8
钠 11 12 11
氟 9 10 9
氖 10 10 10
1、在原子中:质子数______ 核外电子数
2、质子数______(一定或者不一定)等于中子数
=
不一定
不是
4、原子的种类由 决定的
质子数
(氢)
即时演练
1.原子核( )
A、由电子和质子构成
B、由质子和中子构成
C、由电子和中子构成
D、由质子、中子和电子构成
B
2.在原子里,质子数等于( )
A、中子数
B、电子数
C、中子数和电子数之和
D、中子数和电子数之差
B
探究新知
阅读内容:阅读课本P56 三.相对原子质量
阅读要求:仔细阅读,回答相关问题
1. 什么是相对原子质量?
2. 相对原子质量与原子实际质量有什么关系?
3.原子的质量主要集中在哪里?
探究新知
1、以一种碳原子质量的____为标准,其他原子的质量跟它相比较所得的____,作为这种原子的相对原子质量(符号为Ar)。这种碳原子的质量的1/12等于 kg,其计算公式为:
2、原子的质量主要集中在______。质子、中子的相对质量均约等于_____。
Ar=
( )
( )
原子核
1
比
1/12
1.66 x 10-27
一种原子的质量
碳原子质量的1/12
探究新知
1、相对原子质量(符号Ar)公式
Ar( 某原子)=
( )
( )
某原子的质量
碳原子质量的1/12
说明:一个碳原子的质量等于1.993 x 10-26kg
氢原子的相对原子质量
一个原子的实际质量
一个碳原子质量×1/12
=
1.67×10-27kg
= 1
=
如:
1.66 x 10-27
探究新知
(1)相对原子质量是原子的真实质量吗?它的单位是什么?
(2)原子的”实际质量”与其”相对原子质量”成什么关系?
不是,是一个比值,
单位为1,通常省略不写
正比关系
探究新知
原子种类 质子数 中子数 相对原子质量
氢 1 0 1
碳 6 6 12
氧 8 8 16
钠 11 12 23
铁 26 30 56
2、根据下表,你能看出质子数、中子数、相对原子质量三者之间的数量关系吗?
相对原子质量(Ar) =
质子数+中子数
探究新知
表 构成原子的粒子的质量
粒子种类 质量
质子
中子
电子
1.6726×10-27kg
1.6749×10-27kg
质子质量的1/1836
原子的质量主要集中在原子核;
质子、中子的相对质量均约等于1;
电子的质量最小
3、根据下表,可得出什么信息
课堂小结
核电荷数=质子数
=核外电子数
原 子
电 子
原子核
质子
中子
(+)
(不带电)
(-)
(+)
(不带电)
一、原子的构成
二、相对原子质量(符号Ar)公式
Ar=
( )
( )
一种原子的质量
碳原 子质量的1/12
相对原子质量(Ar) = 质子数+中子数
当堂练习
1、下列有关原子知识的叙述正确的是( )
A.原子是构成一切物质的微粒
B.原子是化学变化中的最小微粒
C.原子是构成物质的最小微粒
D.原子是保持物质化学性质的最小微粒
2、在化学反应中,可再分的粒子是 ( )
A.水分子 B.氧原子
C.碳原子的原子核 D.电子
B
A
当堂练习
3.某原子的质子数为26,中子数比质子数多4个,则该原子中所含的粒子总数为 ( )
A.26 B.56
C.82 D.86
4.一种原子的核内有6个质子6个中子,另一种原子核内有6个质子7个中子产则它们不相同的是 ( )
A.核电荷数 B.电子数
C.原子的质量 D.原子所带电量
C
C
5、在分子、原子、原子核、质子、中子、电子等粒子中,找出符合下列条件的粒子,填在相应的横线上。
(1)能保持物质的化学性质的最小粒子是_____;
(2)化学变化中的最小粒子是______;
(3)原子中带正电荷的粒子是_____________;
(4)不显电性的粒子是___________________;
(5)质量最小的粒子是_____;
(6)决定原子质量大小的粒子是_____________;
(7)质量与氢原子近似相等的是_________。
分子
原子
原子核、质子
分子、原子、中子
电子
原子核、质子和中子
质子、中子
(由分子构成的物质)
甲原子与乙原子的质量比为a∶b,而乙原子与碳原子的质量比为c∶d,则甲的相对原子质量为 ( )
A.12ac/bd B.bc/12ad
C.12bd/ac D.ad/12bc
A
选做题
解析:
因为甲:乙=a:b,甲=(a .乙):b
又因乙:碳原子=c:d,乙=(碳原子.c):d
甲=(a . c .碳原子):(b . d)
故甲原子的相对原子质量为(12ac):(b . d)
即12ac/bd
核电荷数=质子数
=核外电子数
原 子
电 子
原子核
质子
中子
(+)
(不带电)
(-)
(+)
(不带电)
一、原子的构成
二、相对原子质量(符号Ar)公式
Ar=
( )
( )
一种原子的质量
碳原 子质量的1/12
相对原子质量(Ar) = 质子数+中子数
板书设计
九年级化学组
人教版九年级化学上册
课题2 原子的结构(1)
第三单元 物质构成的奥秘
新课导入
+
+
+
+
+
+
+
+
?
卢瑟福
1911年,英国科学家卢瑟福用一束平行高速运动的α料子轰击金箔时发现:
①有一部分α粒子改变了原来的运动方向;
②大部分α粒子基本不改变运动方向;
③极少数α粒子出现反弹.
学习目标
1、知道原子的结构,以及构成粒子之间的关系;
2、理解原子不显电性的原因
3、知道相对原子质量的含义,并会查相对原子
质量表
探究新知
1、原子和原子核分别是由什么构成的?
2、原子中各粒子的带电情况?
3、原子中,核电荷数、质子数、核外电子数之间存在什么关系?
4.为什么整个原子不显电性?
阅读内容:阅读课本P53
阅读要求:回答下列问题
探究新知
1.原子是由居于原子中心的_______和________构成, 原子核是由_______和______构成。
2、一个原子只有____原子核。
3、每个质子带1个单位的_______,每个电子带1个单位的_________,中子_______电。
原子核
核外电子
负电荷
正电荷
质子
中子
不带
一个
4、由于原子核内质子所带电荷与核外电子的电荷_________,_________,因此,原子不显电性。
5. 核电荷数即_____________________。
6、原子中,核电荷数___质子数___核外电子数
=
=
数量相等
电性相反
原子核所带的正电荷数
探究新知
原 子
电子
原子核
质子
中子
(+)
(不带电)
(-)
(+)
(不带电)
核电荷数=质子数
=核外电子数
1、原子是怎么构成的呢?
探究新知
2.原子带电吗?分子呢?
由于原子核和核外电子所带电量相等,但是电性相反,所以整个原子不显电性。由此可知,由原子构成的分子也不显电性
思考与讨论
3、_____(是或不是)所有原子都有中子
原子种类 质子数 中子数 核外电子数
氢 1 0 1
碳 6 6 6
氧 8 8 8
钠 11 12 11
氟 9 10 9
氖 10 10 10
1、在原子中:质子数______ 核外电子数
2、质子数______(一定或者不一定)等于中子数
=
不一定
不是
4、原子的种类由 决定的
质子数
(氢)
即时演练
1.原子核( )
A、由电子和质子构成
B、由质子和中子构成
C、由电子和中子构成
D、由质子、中子和电子构成
B
2.在原子里,质子数等于( )
A、中子数
B、电子数
C、中子数和电子数之和
D、中子数和电子数之差
B
探究新知
阅读内容:阅读课本P56 三.相对原子质量
阅读要求:仔细阅读,回答相关问题
1. 什么是相对原子质量?
2. 相对原子质量与原子实际质量有什么关系?
3.原子的质量主要集中在哪里?
探究新知
1、以一种碳原子质量的____为标准,其他原子的质量跟它相比较所得的____,作为这种原子的相对原子质量(符号为Ar)。这种碳原子的质量的1/12等于 kg,其计算公式为:
2、原子的质量主要集中在______。质子、中子的相对质量均约等于_____。
Ar=
( )
( )
原子核
1
比
1/12
1.66 x 10-27
一种原子的质量
碳原子质量的1/12
探究新知
1、相对原子质量(符号Ar)公式
Ar( 某原子)=
( )
( )
某原子的质量
碳原子质量的1/12
说明:一个碳原子的质量等于1.993 x 10-26kg
氢原子的相对原子质量
一个原子的实际质量
一个碳原子质量×1/12
=
1.67×10-27kg
= 1
=
如:
1.66 x 10-27
探究新知
(1)相对原子质量是原子的真实质量吗?它的单位是什么?
(2)原子的”实际质量”与其”相对原子质量”成什么关系?
不是,是一个比值,
单位为1,通常省略不写
正比关系
探究新知
原子种类 质子数 中子数 相对原子质量
氢 1 0 1
碳 6 6 12
氧 8 8 16
钠 11 12 23
铁 26 30 56
2、根据下表,你能看出质子数、中子数、相对原子质量三者之间的数量关系吗?
相对原子质量(Ar) =
质子数+中子数
探究新知
表 构成原子的粒子的质量
粒子种类 质量
质子
中子
电子
1.6726×10-27kg
1.6749×10-27kg
质子质量的1/1836
原子的质量主要集中在原子核;
质子、中子的相对质量均约等于1;
电子的质量最小
3、根据下表,可得出什么信息
课堂小结
核电荷数=质子数
=核外电子数
原 子
电 子
原子核
质子
中子
(+)
(不带电)
(-)
(+)
(不带电)
一、原子的构成
二、相对原子质量(符号Ar)公式
Ar=
( )
( )
一种原子的质量
碳原 子质量的1/12
相对原子质量(Ar) = 质子数+中子数
当堂练习
1、下列有关原子知识的叙述正确的是( )
A.原子是构成一切物质的微粒
B.原子是化学变化中的最小微粒
C.原子是构成物质的最小微粒
D.原子是保持物质化学性质的最小微粒
2、在化学反应中,可再分的粒子是 ( )
A.水分子 B.氧原子
C.碳原子的原子核 D.电子
B
A
当堂练习
3.某原子的质子数为26,中子数比质子数多4个,则该原子中所含的粒子总数为 ( )
A.26 B.56
C.82 D.86
4.一种原子的核内有6个质子6个中子,另一种原子核内有6个质子7个中子产则它们不相同的是 ( )
A.核电荷数 B.电子数
C.原子的质量 D.原子所带电量
C
C
5、在分子、原子、原子核、质子、中子、电子等粒子中,找出符合下列条件的粒子,填在相应的横线上。
(1)能保持物质的化学性质的最小粒子是_____;
(2)化学变化中的最小粒子是______;
(3)原子中带正电荷的粒子是_____________;
(4)不显电性的粒子是___________________;
(5)质量最小的粒子是_____;
(6)决定原子质量大小的粒子是_____________;
(7)质量与氢原子近似相等的是_________。
分子
原子
原子核、质子
分子、原子、中子
电子
原子核、质子和中子
质子、中子
(由分子构成的物质)
甲原子与乙原子的质量比为a∶b,而乙原子与碳原子的质量比为c∶d,则甲的相对原子质量为 ( )
A.12ac/bd B.bc/12ad
C.12bd/ac D.ad/12bc
A
选做题
解析:
因为甲:乙=a:b,甲=(a .乙):b
又因乙:碳原子=c:d,乙=(碳原子.c):d
甲=(a . c .碳原子):(b . d)
故甲原子的相对原子质量为(12ac):(b . d)
即12ac/bd
核电荷数=质子数
=核外电子数
原 子
电 子
原子核
质子
中子
(+)
(不带电)
(-)
(+)
(不带电)
一、原子的构成
二、相对原子质量(符号Ar)公式
Ar=
( )
( )
一种原子的质量
碳原 子质量的1/12
相对原子质量(Ar) = 质子数+中子数
板书设计
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
